2.2 氯及其化合物 同步练习题(含解析)高中化学人教版(2019)必修第一册
文档属性
| 名称 | 2.2 氯及其化合物 同步练习题(含解析)高中化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 266.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-20 15:15:44 | ||
图片预览



文档简介
2.2 氯及其化合物 同步练习题
一、选择题
1.化学与生产、生活密切相关。下列说法不正确的是
A.医用酒精和胶体可用丁达尔效应区分
B.如果钠等可燃物着火,应立即用水扑灭
C.疫苗一般应冷藏存放,可以通过氧化灭活病毒
D.在食品袋中放入盛有铁粉的透气小袋,可防止食物氧化变质
2.化学与社会、生活密切相关,下列说法不正确的是
A.漂白粉和漂粉精既可作漂白棉、麻的漂白剂,也可用作游泳池等场所消毒剂
B.在清洗卫生间时,混合使用“洁厕灵”和“84消毒液”可增强消毒效果
C.氧化还原反应广泛存在于生产和生活中,如金属的冶炼、食物的腐败、绿色植物的光合作用等
D.小苏打受热分解或与面团发酵产生的酸反应产生气体,因此可用作面点膨松剂
3.利用数字化实验测定光照氯水过程,得到如图所示的坐标图,其中横坐标代表时间,纵坐标代表某种物理量,下列物理量的变化与图像不相符的是
A.溶液的pH
B.溶液中氯离子的物质的量浓度
C.溶液的导电能力
D.容器中氧气的体积分数
4.下列说法错误的是
A.石墨可用于人工降雨 B.干冰可用于人工降雨
C.活性炭可用于吸附色素 D.氯气可用于自来水消毒
5.关于液氯与氯水,下列判断错误的是
A.均呈黄绿色 B.均含氯分子
C.均含氯离子 D.均有氧化性
6.把氯气通入紫色石蕊试液中,观察到的现象是
A.先变蓝后变红 B.先变红后变紫 C.先变红后褪色 D.无明显变化
7.实验室制备 Cl2 可用下列反应:。利用上述反应制备 Cl2时,下列说法正确的是
A.制备 Cl2可以采用图1装置
B.除去 Cl2中含有的少量 HCl 可以通过饱和的 NaHCO3溶液
C.干燥 Cl2可以选用浓硫酸或碱石灰等干燥剂
D.收集 Cl2 使用图2装置能防止 Cl2逸出,减少污染:
8.下列说法不正确的是
A.直径为1.3×10-9m的“钴酞菁”分子分散在水中能形成胶体,该分子直径比Na+的直径大
B.观察钾的焰色反应要透过蓝色钴玻璃
C.可以用滤纸分离除去Fe(OH)3胶体中的FeCl3
D.瑞典化学家舍勒最早发现氯气,英国化学家戴维最早确认氯气是种新元素组成的单质
二、非选择题
9.简要回答下列问题。
(1)将食品置于低温条件下,常常可以保存更长时间的原因是_____。
(2)盛有浓硫酸的容器敞口放置一段时间后,硫酸浓度变小的原因是_____。
(3)工业浓硝酸通常呈黄色,用化学方程式解释:______。
(4)84消毒液(含HClO)能用于杀菌消毒,其原因是______。
10.氯离子是维持血清电解质平衡和酸碱平衡重要物质,人体中氯的正常值范围是96~106mmol L 1,氯及其化合物在生活中也有着重要用途。下图为氯及其化合物的“价—类”二维图。
(1)若经体检测得某人体内含量为,此测量值_______(填“处于”或“不处于”)人体中氯的正常值范围内。
(2)A物质光照分解的产物可以设计成数字化实验。实验步骤如下:
I.将传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;
II.将三种传感器分别插入盛有氯水的广口瓶中;
III.用强光照射氯水,同时开始采集数据。
图甲和图乙的纵坐标可能分别为_______(填序号)。
A.氯水的、离子浓度 B.氯离子浓度、氯水的
C.氧气的体积分数、氯离子浓度 D.氧气的体积分数、氯水的
该过程的化学反应方程式为_______。
(3)某同学想利用以下试剂探究的化学性质:
A. B. C. D.
i.从物质类别的视角,属于强酸,可能与_______发生反应(填序号)。
ii.从元素价态的视角,具有氧化性,可能与_______发生反应(填序号)。
(4)碘是生命体中的必需元素,碘及其化合物在生活中也有重要的用途。实验室制取少量可用如下方法:。请根据方程式回答问题:
①从上述反应中可以判断和氧化性的关系为_______>_______。
②反应有生成,转移_______电子。
11.现有X、Y、Z三种元素。
①X的单质可以在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色。
②X的单质可与Y的单质化合,生成X2Y。X2Y在常温下为液体。
③Z的单质溶于X2Y中,所得溶液具有漂白性。
请填写下列空白。
(1)X、Y、Z的元素名称分别为___、___、___。
(2)将XZ的水溶液滴入Na2CO3溶液中,有气泡产生,反应的离子方程式为___。
(3)Z的单质溶于X2Y中,反应的化学方程式为___。
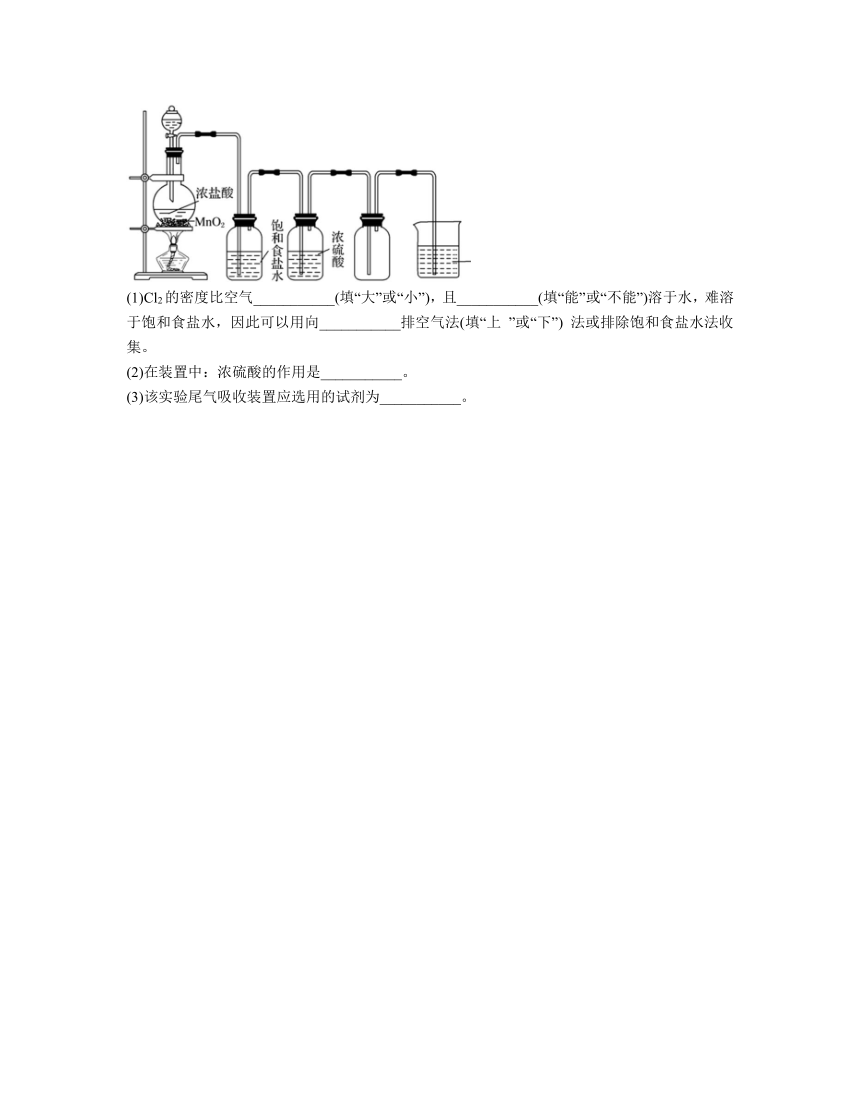
12.实验室用如下装置制取氯气,回答下列问题:
(1)Cl2的密度比空气___________(填“大”或“小”),且___________(填“能”或“不能”)溶于水,难溶于饱和食盐水,因此可以用向___________排空气法(填“上 ”或“下”) 法或排除饱和食盐水法收集。
(2)在装置中:浓硫酸的作用是___________。
(3)该实验尾气吸收装置应选用的试剂为___________。
【参考答案】
一、选择题
1.B
解析:A.医用酒精是溶液,医用酒精和胶体可用丁达尔效应区分,故A正确;
B.钠能与水反应,如果钠等可燃物着火,应立即用沙子盖灭,故B错误;
C.疫苗一般应冷藏存放,具有氧化性,可以通过氧化灭活病毒,故C正确;
D.铁具有还原性,在食品袋中放入盛有铁粉的透气小袋,可防止食物氧化变质,故D正确;
选B。
2.B
解析:A.漂白粉和漂粉精都能反应生成次氯酸,所以既可作漂白棉、麻的漂白剂,也可用作游泳池等场所消毒剂,故A正确;
B.“洁厕灵”的主要成分是HCl,“84消毒液”主要成分是NaClO,混合使用会发生反应:,氯气有毒,不但不能增强消毒效果,还可能发生中毒事件,故B错误;
C.金属冶炼、电镀、食物的腐败、绿色植物的光合作用等,都是氧化还原反应,故C正确;
D.小苏打为NaHCO3,受热分解生成CO2气体:2NaHCO3 Na2CO3+CO2+H2O,所以可以做面点膨松剂,故D正确;
故答案选B。
3.A
解析:A.氯水中存在反应,,见光分解生成HCl和氧气,随光照时间的延长,氯气最终转化为HCl,使溶液酸性增强,pH减小,物理量的变化与图像不相符,故A选;
B.由A中分析,氯气最终转化为HCl,溶液中氯离子的物质的量浓度,物理量的变化与图像相符,故B不选;
C.由以上反应分析,氯水中HClO光照最终生成HCl,该过程增大了溶液中离子浓度,导电能力增强,物理量的变化与图像相符,故C不选;
D.由以上分析,氯水中HClO分解生成氧气,容器中氧气的体积分数,物理量的变化与图像相符,故D不选;
故选:A。
4.A
解析:A. 石墨有多种用途,例如能导电作电极等,但不用于人工降雨,A错误;
B. 干冰、碘化银等可用于人工降雨,B正确;
C. 活性炭具有吸附性,可用于吸附色素,C正确;
D. 氯气与水反应生成的HClO具有强氧化性、可用于自来水消毒,D正确;
答案选A。
5.C
解析:A.氯水中含有氯气分子,液氯含有氯气分子,氯气为黄绿色气体,故A正确;
B.氯水中含有氯气分子,液氯含有氯气分子,故B正确;
C.氯气与水反应生成次氯酸和HCl,其中存在氯离子;液氯是氯气的液体状态,不含氯离子,故C错误;
D.氯水中含有氯气分子,液氯含有氯气分子,氯气具有氧化性,故D正确;
故选C。
6.C
解析:氯气能与水反应生成盐酸和次氯酸,盐酸显酸性,能使紫色石蕊溶液变红,但次氯酸具有漂白性,能使溶液红色褪去,因此把氯气通入紫色石蕊试液中,观察到的现象是:溶液先变红后褪色,
答案选C。
7.A
解析:A.,反应为固液不加热可以可以采用图1装置,A正确;
B.HCl会和碳酸氢钠反应生成二氧化碳气体,引入杂质,B错误;
C.氯气会和碱石灰反应,不能使碱石灰干燥,C错误;
D.图2装置为密闭装置,氯气不能进入装置,D错误;
故选A。
8.C
解析:A.“钴酞菁”分子(直径为)的微粒直径属于胶体分散系范围内,属于胶体分散系,溶液中分散质直径小于1nm,所以“钴酞菁”分子的直径比Na+大,A正确;
B.钾的火焰颜色要透过蓝色钴玻璃观察,主要滤去黄色的光,B正确;
C.胶体、溶液中分散质粒子直径小于滤纸孔径,二者都能透过滤纸,达不到提纯的目的,C不正确;
D.瑞典化学家舍勒最早发现氯气,英国化学家戴维最早确认氯气是一种新元素组成的单质,D正确;
故选C。
二、非选择题
9.(1)温度越低,化学反应速率越慢
(2)浓硫酸具有吸水性
(3)
(4)HClO具有强氧化性,能使蛋白质变性
解析:(1)低温环境下,食品发生氧化还原反应而变质的速率会变慢,所以将食品置于低温条件下,常常可以保存更长时间的原因是温度越低,化学反应速率越慢。
(2)浓硫酸具有吸水性,能够吸收空气中的吸水性而使硫酸溶液中的溶剂变多,所以硫酸浓度会变小,所以盛有浓硫酸的容器敞口放置一段时间后,硫酸浓度变小的原因是浓硫酸具有吸水性。
(3)浓硝酸在光照条件下会发生分解反应,生成NO2溶于硝酸中而使硝酸呈黄色,化学方程式为。
(4)HClO具有强氧化性,能使蛋白质变性,从而使细菌、病毒等失活,而达到杀菌消毒的作用。
10.(1)处于
(2) A
(3) AD C
(4) Cu2+ I2 2
解析:(1)人体中氯的正常值范围是96~106mmol L 1,若经体检测得某人体内含量为,此时氯的浓度值为,则此测量值处于人体中氯的正常值范围内;故答案为:处于。
(2)氯水中次氯酸光照分解变为氧气和盐酸,因此氢离子浓度增大,pH值减小,氧气量增多,离子浓度增大,因此甲为氯水的,乙为离子浓度,故D符合题意;该过程主要是次氯酸见光分解生成盐酸和氧气,其化学反应方程式为;故答案为D;。
(3)i.从物质类别的视角,属于强酸,可能与碱和盐反应即氢氧化钠和碳酸钙发生反应;故答案为:AD。
ii.从元素价态的视角,高氯酸中氯处于最高价态,具有氧化性,易和还原性物质发生氧化还原反应,即可能与二氧化硫发生反应;故答案为:C。
(4)①根据反应方程式分析硫酸铜中铜化合价降低,因此铜离子为氧化剂,KI中碘化合价升高,因此单质碘为氧化产物,根据氧化剂氧化性大于氧化产物氧化性,因此从上述反应中可以判断和氧化性的关系为Cu2+> ;故答案为:Cu2+;。
②根据方程式分析生成1mol单质碘,转移2mol电子;故答案为:2。
11. 氢 氧 氯 2H++=H2O+CO2↑ Cl2+H2OHCl+HClO
【分析】①X的单质可以在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色,则X是H,Z是Cl元素。
②X的单质可与Y的单质化合,生成X2Y。X2Y在常温下为液体,则Y是O元素。
③Z的单质溶于X2Y中,所得溶液具有漂白性,是由于发生反应:Cl2+H2OHCl+HClO,HClO具有强氧化性,会发生氧化漂白作用。
解析:(1)根据上述分析可知:X是氢元素,Y是氧元素,Z是氯元素。
(2)将XZ的水溶液就是盐酸,由于酸性:HCl>H2CO3,所以将盐酸滴入Na2CO3溶液中,二者发生复分解反应,产生CO2气体,因此看到有气泡产生,该反应的离子方程式为:2H++=H2O+CO2↑;
(3)Cl2能溶于水,在室温下1体积水能够溶解2体积的氯气,溶于水的氯气部分发生反应产生盐酸和次氯酸,该反应为可逆反应,反应方程式为:Cl2+H2OHCl+HClO。
12.(1) 大 能 上
(2)吸收水蒸气,干燥氯气
(3)氢氧化钠溶液
解析:MnO2和浓盐酸在加热条件下反应生成氯气,化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;浓盐酸易挥发,Cl2中混有HCl,将气体通过饱和食盐水可以除去Cl2中的HCl;浓硫酸具有吸水性,可以除去Cl2中的水蒸气;Cl2的密度比空气大,且能溶于水,难溶于饱和食盐水,因此可以用向上排空气法或排除饱和食盐水法收集;Cl2有毒,能和NaOH溶液反应,故可用NaOH溶液吸收尾气,防止污染空气。
(1)Cl2的密度比空气大,且能溶于水,难溶于饱和食盐水,因此可以用向上排空气法法或排除饱和食盐水法收集。
(2)浓硫酸具有吸水性,故浓硫酸的作用是吸收水蒸气,干燥氯气。
(3)Cl2有毒,能和NaOH溶液反应,故该实验尾气吸收装置应选用的试剂为氢氧化钠溶液。
一、选择题
1.化学与生产、生活密切相关。下列说法不正确的是
A.医用酒精和胶体可用丁达尔效应区分
B.如果钠等可燃物着火,应立即用水扑灭
C.疫苗一般应冷藏存放,可以通过氧化灭活病毒
D.在食品袋中放入盛有铁粉的透气小袋,可防止食物氧化变质
2.化学与社会、生活密切相关,下列说法不正确的是
A.漂白粉和漂粉精既可作漂白棉、麻的漂白剂,也可用作游泳池等场所消毒剂
B.在清洗卫生间时,混合使用“洁厕灵”和“84消毒液”可增强消毒效果
C.氧化还原反应广泛存在于生产和生活中,如金属的冶炼、食物的腐败、绿色植物的光合作用等
D.小苏打受热分解或与面团发酵产生的酸反应产生气体,因此可用作面点膨松剂
3.利用数字化实验测定光照氯水过程,得到如图所示的坐标图,其中横坐标代表时间,纵坐标代表某种物理量,下列物理量的变化与图像不相符的是
A.溶液的pH
B.溶液中氯离子的物质的量浓度
C.溶液的导电能力
D.容器中氧气的体积分数
4.下列说法错误的是
A.石墨可用于人工降雨 B.干冰可用于人工降雨
C.活性炭可用于吸附色素 D.氯气可用于自来水消毒
5.关于液氯与氯水,下列判断错误的是
A.均呈黄绿色 B.均含氯分子
C.均含氯离子 D.均有氧化性
6.把氯气通入紫色石蕊试液中,观察到的现象是
A.先变蓝后变红 B.先变红后变紫 C.先变红后褪色 D.无明显变化
7.实验室制备 Cl2 可用下列反应:。利用上述反应制备 Cl2时,下列说法正确的是
A.制备 Cl2可以采用图1装置
B.除去 Cl2中含有的少量 HCl 可以通过饱和的 NaHCO3溶液
C.干燥 Cl2可以选用浓硫酸或碱石灰等干燥剂
D.收集 Cl2 使用图2装置能防止 Cl2逸出,减少污染:
8.下列说法不正确的是
A.直径为1.3×10-9m的“钴酞菁”分子分散在水中能形成胶体,该分子直径比Na+的直径大
B.观察钾的焰色反应要透过蓝色钴玻璃
C.可以用滤纸分离除去Fe(OH)3胶体中的FeCl3
D.瑞典化学家舍勒最早发现氯气,英国化学家戴维最早确认氯气是种新元素组成的单质
二、非选择题
9.简要回答下列问题。
(1)将食品置于低温条件下,常常可以保存更长时间的原因是_____。
(2)盛有浓硫酸的容器敞口放置一段时间后,硫酸浓度变小的原因是_____。
(3)工业浓硝酸通常呈黄色,用化学方程式解释:______。
(4)84消毒液(含HClO)能用于杀菌消毒,其原因是______。
10.氯离子是维持血清电解质平衡和酸碱平衡重要物质,人体中氯的正常值范围是96~106mmol L 1,氯及其化合物在生活中也有着重要用途。下图为氯及其化合物的“价—类”二维图。
(1)若经体检测得某人体内含量为,此测量值_______(填“处于”或“不处于”)人体中氯的正常值范围内。
(2)A物质光照分解的产物可以设计成数字化实验。实验步骤如下:
I.将传感器、氢离子传感器、氧气传感器分别与数据采集器、计算机连接;
II.将三种传感器分别插入盛有氯水的广口瓶中;
III.用强光照射氯水,同时开始采集数据。
图甲和图乙的纵坐标可能分别为_______(填序号)。
A.氯水的、离子浓度 B.氯离子浓度、氯水的
C.氧气的体积分数、氯离子浓度 D.氧气的体积分数、氯水的
该过程的化学反应方程式为_______。
(3)某同学想利用以下试剂探究的化学性质:
A. B. C. D.
i.从物质类别的视角,属于强酸,可能与_______发生反应(填序号)。
ii.从元素价态的视角,具有氧化性,可能与_______发生反应(填序号)。
(4)碘是生命体中的必需元素,碘及其化合物在生活中也有重要的用途。实验室制取少量可用如下方法:。请根据方程式回答问题:
①从上述反应中可以判断和氧化性的关系为_______>_______。
②反应有生成,转移_______电子。
11.现有X、Y、Z三种元素。
①X的单质可以在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色。
②X的单质可与Y的单质化合,生成X2Y。X2Y在常温下为液体。
③Z的单质溶于X2Y中,所得溶液具有漂白性。
请填写下列空白。
(1)X、Y、Z的元素名称分别为___、___、___。
(2)将XZ的水溶液滴入Na2CO3溶液中,有气泡产生,反应的离子方程式为___。
(3)Z的单质溶于X2Y中,反应的化学方程式为___。
12.实验室用如下装置制取氯气,回答下列问题:
(1)Cl2的密度比空气___________(填“大”或“小”),且___________(填“能”或“不能”)溶于水,难溶于饱和食盐水,因此可以用向___________排空气法(填“上 ”或“下”) 法或排除饱和食盐水法收集。
(2)在装置中:浓硫酸的作用是___________。
(3)该实验尾气吸收装置应选用的试剂为___________。
【参考答案】
一、选择题
1.B
解析:A.医用酒精是溶液,医用酒精和胶体可用丁达尔效应区分,故A正确;
B.钠能与水反应,如果钠等可燃物着火,应立即用沙子盖灭,故B错误;
C.疫苗一般应冷藏存放,具有氧化性,可以通过氧化灭活病毒,故C正确;
D.铁具有还原性,在食品袋中放入盛有铁粉的透气小袋,可防止食物氧化变质,故D正确;
选B。
2.B
解析:A.漂白粉和漂粉精都能反应生成次氯酸,所以既可作漂白棉、麻的漂白剂,也可用作游泳池等场所消毒剂,故A正确;
B.“洁厕灵”的主要成分是HCl,“84消毒液”主要成分是NaClO,混合使用会发生反应:,氯气有毒,不但不能增强消毒效果,还可能发生中毒事件,故B错误;
C.金属冶炼、电镀、食物的腐败、绿色植物的光合作用等,都是氧化还原反应,故C正确;
D.小苏打为NaHCO3,受热分解生成CO2气体:2NaHCO3 Na2CO3+CO2+H2O,所以可以做面点膨松剂,故D正确;
故答案选B。
3.A
解析:A.氯水中存在反应,,见光分解生成HCl和氧气,随光照时间的延长,氯气最终转化为HCl,使溶液酸性增强,pH减小,物理量的变化与图像不相符,故A选;
B.由A中分析,氯气最终转化为HCl,溶液中氯离子的物质的量浓度,物理量的变化与图像相符,故B不选;
C.由以上反应分析,氯水中HClO光照最终生成HCl,该过程增大了溶液中离子浓度,导电能力增强,物理量的变化与图像相符,故C不选;
D.由以上分析,氯水中HClO分解生成氧气,容器中氧气的体积分数,物理量的变化与图像相符,故D不选;
故选:A。
4.A
解析:A. 石墨有多种用途,例如能导电作电极等,但不用于人工降雨,A错误;
B. 干冰、碘化银等可用于人工降雨,B正确;
C. 活性炭具有吸附性,可用于吸附色素,C正确;
D. 氯气与水反应生成的HClO具有强氧化性、可用于自来水消毒,D正确;
答案选A。
5.C
解析:A.氯水中含有氯气分子,液氯含有氯气分子,氯气为黄绿色气体,故A正确;
B.氯水中含有氯气分子,液氯含有氯气分子,故B正确;
C.氯气与水反应生成次氯酸和HCl,其中存在氯离子;液氯是氯气的液体状态,不含氯离子,故C错误;
D.氯水中含有氯气分子,液氯含有氯气分子,氯气具有氧化性,故D正确;
故选C。
6.C
解析:氯气能与水反应生成盐酸和次氯酸,盐酸显酸性,能使紫色石蕊溶液变红,但次氯酸具有漂白性,能使溶液红色褪去,因此把氯气通入紫色石蕊试液中,观察到的现象是:溶液先变红后褪色,
答案选C。
7.A
解析:A.,反应为固液不加热可以可以采用图1装置,A正确;
B.HCl会和碳酸氢钠反应生成二氧化碳气体,引入杂质,B错误;
C.氯气会和碱石灰反应,不能使碱石灰干燥,C错误;
D.图2装置为密闭装置,氯气不能进入装置,D错误;
故选A。
8.C
解析:A.“钴酞菁”分子(直径为)的微粒直径属于胶体分散系范围内,属于胶体分散系,溶液中分散质直径小于1nm,所以“钴酞菁”分子的直径比Na+大,A正确;
B.钾的火焰颜色要透过蓝色钴玻璃观察,主要滤去黄色的光,B正确;
C.胶体、溶液中分散质粒子直径小于滤纸孔径,二者都能透过滤纸,达不到提纯的目的,C不正确;
D.瑞典化学家舍勒最早发现氯气,英国化学家戴维最早确认氯气是一种新元素组成的单质,D正确;
故选C。
二、非选择题
9.(1)温度越低,化学反应速率越慢
(2)浓硫酸具有吸水性
(3)
(4)HClO具有强氧化性,能使蛋白质变性
解析:(1)低温环境下,食品发生氧化还原反应而变质的速率会变慢,所以将食品置于低温条件下,常常可以保存更长时间的原因是温度越低,化学反应速率越慢。
(2)浓硫酸具有吸水性,能够吸收空气中的吸水性而使硫酸溶液中的溶剂变多,所以硫酸浓度会变小,所以盛有浓硫酸的容器敞口放置一段时间后,硫酸浓度变小的原因是浓硫酸具有吸水性。
(3)浓硝酸在光照条件下会发生分解反应,生成NO2溶于硝酸中而使硝酸呈黄色,化学方程式为。
(4)HClO具有强氧化性,能使蛋白质变性,从而使细菌、病毒等失活,而达到杀菌消毒的作用。
10.(1)处于
(2) A
(3) AD C
(4) Cu2+ I2 2
解析:(1)人体中氯的正常值范围是96~106mmol L 1,若经体检测得某人体内含量为,此时氯的浓度值为,则此测量值处于人体中氯的正常值范围内;故答案为:处于。
(2)氯水中次氯酸光照分解变为氧气和盐酸,因此氢离子浓度增大,pH值减小,氧气量增多,离子浓度增大,因此甲为氯水的,乙为离子浓度,故D符合题意;该过程主要是次氯酸见光分解生成盐酸和氧气,其化学反应方程式为;故答案为D;。
(3)i.从物质类别的视角,属于强酸,可能与碱和盐反应即氢氧化钠和碳酸钙发生反应;故答案为:AD。
ii.从元素价态的视角,高氯酸中氯处于最高价态,具有氧化性,易和还原性物质发生氧化还原反应,即可能与二氧化硫发生反应;故答案为:C。
(4)①根据反应方程式分析硫酸铜中铜化合价降低,因此铜离子为氧化剂,KI中碘化合价升高,因此单质碘为氧化产物,根据氧化剂氧化性大于氧化产物氧化性,因此从上述反应中可以判断和氧化性的关系为Cu2+> ;故答案为:Cu2+;。
②根据方程式分析生成1mol单质碘,转移2mol电子;故答案为:2。
11. 氢 氧 氯 2H++=H2O+CO2↑ Cl2+H2OHCl+HClO
【分析】①X的单质可以在Z的单质中燃烧,生成XZ,燃烧时火焰为苍白色,则X是H,Z是Cl元素。
②X的单质可与Y的单质化合,生成X2Y。X2Y在常温下为液体,则Y是O元素。
③Z的单质溶于X2Y中,所得溶液具有漂白性,是由于发生反应:Cl2+H2OHCl+HClO,HClO具有强氧化性,会发生氧化漂白作用。
解析:(1)根据上述分析可知:X是氢元素,Y是氧元素,Z是氯元素。
(2)将XZ的水溶液就是盐酸,由于酸性:HCl>H2CO3,所以将盐酸滴入Na2CO3溶液中,二者发生复分解反应,产生CO2气体,因此看到有气泡产生,该反应的离子方程式为:2H++=H2O+CO2↑;
(3)Cl2能溶于水,在室温下1体积水能够溶解2体积的氯气,溶于水的氯气部分发生反应产生盐酸和次氯酸,该反应为可逆反应,反应方程式为:Cl2+H2OHCl+HClO。
12.(1) 大 能 上
(2)吸收水蒸气,干燥氯气
(3)氢氧化钠溶液
解析:MnO2和浓盐酸在加热条件下反应生成氯气,化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O;浓盐酸易挥发,Cl2中混有HCl,将气体通过饱和食盐水可以除去Cl2中的HCl;浓硫酸具有吸水性,可以除去Cl2中的水蒸气;Cl2的密度比空气大,且能溶于水,难溶于饱和食盐水,因此可以用向上排空气法或排除饱和食盐水法收集;Cl2有毒,能和NaOH溶液反应,故可用NaOH溶液吸收尾气,防止污染空气。
(1)Cl2的密度比空气大,且能溶于水,难溶于饱和食盐水,因此可以用向上排空气法法或排除饱和食盐水法收集。
(2)浓硫酸具有吸水性,故浓硫酸的作用是吸收水蒸气,干燥氯气。
(3)Cl2有毒,能和NaOH溶液反应,故该实验尾气吸收装置应选用的试剂为氢氧化钠溶液。
