辽宁省辽阳市2024-2025学年高一下学期7月期末化学试卷(含答案)
文档属性
| 名称 | 辽宁省辽阳市2024-2025学年高一下学期7月期末化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 753.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-19 19:09:49 | ||
图片预览



文档简介
辽宁省辽阳市2024-2025学年高一下学期期末考试 化学试卷
一、单选题
1.文物是历史的见证者。下列辽宁省博物馆馆藏文物中,其主要成分为有机物的是
A.白瓷横梁鸡冠壶 B.宋钧窑莲花式钵 C.辽契丹文铜鱼符 D.九霄环佩琴
2.科学、安全、有效和合理利用自然资源,是当今社会的重要课题。下列说法错误的是
A.要根据金属活泼性选择金属冶炼方法 B.蒸馏法淡化海水成本较高,不宜大规模推广
C.煤的干馏和石油的分馏过程中均会发生化学反应 D.合成药物可以促进人类健康,但不能过度使用
3.下列化学用语或表述正确的是
A.中子数为1的氢核素: B.为离子化合物
C.乙烯的空间填充模型: D.的电子式:
4.下列处理方法不合适的是
A.浓硫酸溅到手上,立即用质量分数为的溶液冲洗
B.将实验后剩余的钠块直接放回原试剂瓶
C.不能用手直接触摸实验室药品
D.水银温度计打碎后,立即用硫粉覆盖
5.下列人类活动中,没发生放热反应的是
A.燃烧甲烷做饭 B.用速冷冰袋冷敷伤痛处
C.氧炔焰焊接金属 D.Zn与稀硫酸反应制氢气
6.电池在生活中随处可见,下列装置能将化学能转化成电能的是
A. B. C. D.
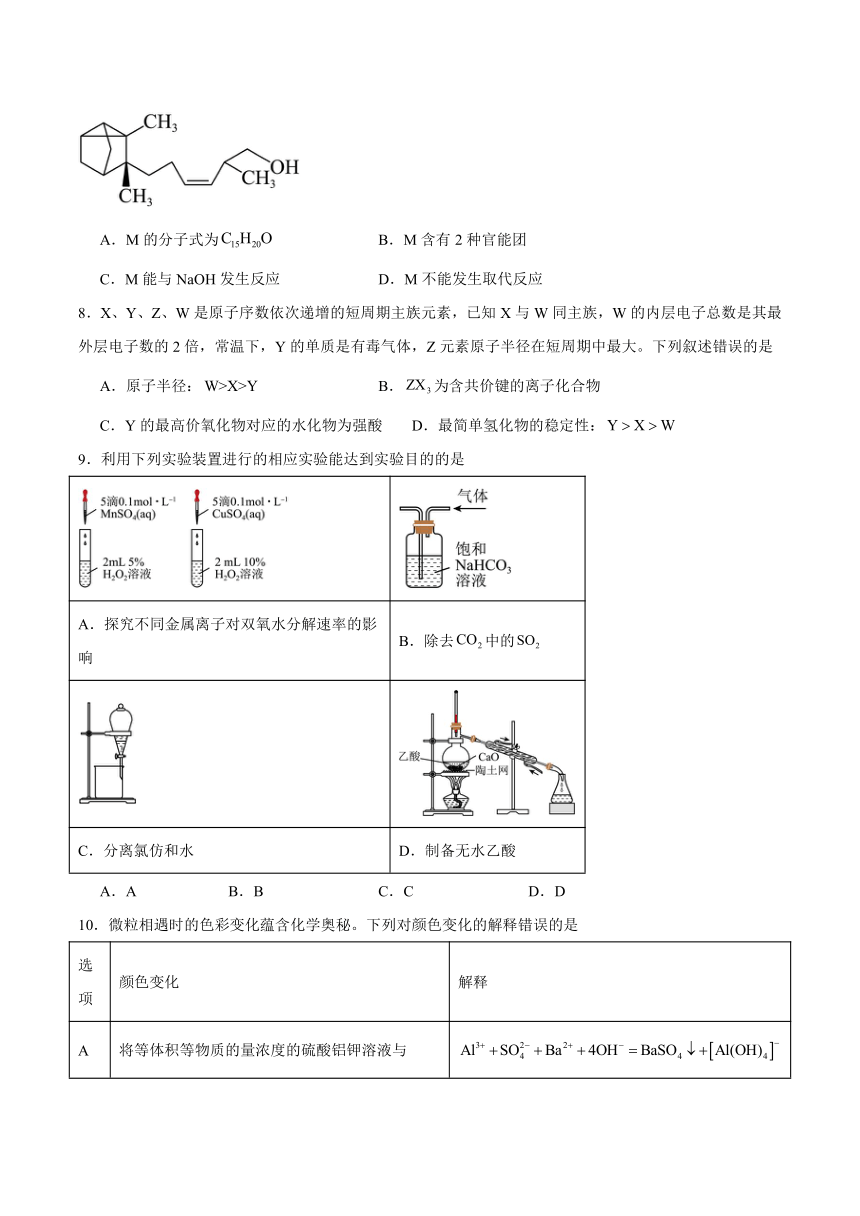
7.有机化合物M常用于调配高级香水、护肤品和洗涤剂等,在医疗上具有抗紫外线、减少黑色素生成、抗炎、镇静、抗肿瘤等功效,其分子结构如图。下列有关说法正确的是
A.M的分子式为 B.M含有2种官能团
C.M能与NaOH发生反应 D.M不能发生取代反应
8.X、Y、Z、W是原子序数依次递增的短周期主族元素,已知X与W同主族,W的内层电子总数是其最外层电子数的2倍,常温下,Y的单质是有毒气体,Z元素原子半径在短周期中最大。下列叙述错误的是
A.原子半径: B.为含共价键的离子化合物
C.Y的最高价氧化物对应的水化物为强酸 D.最简单氢化物的稳定性:
9.利用下列实验装置进行的相应实验能达到实验目的的是
A.探究不同金属离子对双氧水分解速率的影响 B.除去中的
C.分离氯仿和水 D.制备无水乙酸
A.A B.B C.C D.D
10.微粒相遇时的色彩变化蕴含化学奥秘。下列对颜色变化的解释错误的是
选项 颜色变化 解释
A 将等体积等物质的量浓度的硫酸铝钾溶液与溶液混合,有白色沉淀产生
B 将铜粉加入含有双氧水的稀硫酸中,溶液变蓝
C 将新制氯水滴入淀粉-KI溶液中,溶液变蓝
D 将KSCN溶液滴入溶液中,溶液变为红色
A.A B.B C.C D.D
11.实验室用NaClO溶液与反应可制备联氨,反应原理为(未配平),设为阿伏加德罗常数的值。下列关于该反应的说法正确的是
A.溶液中含的数目为 B.22.4L氨气中含有分子的数目为
C.中含有中子的数目为 D.每生成,转移电子的数目为
12.白合金是铜钴矿冶炼过程的中间产物,一种从白合金(主要含,还含少量)中分离回收金属的流程如下:
已知:难溶于稀硫酸。
下列说法正确的是
A.“滤液1”中的金属离子只有
B.“氧化”时的反应为
C.“滤渣2”中的为两性氧化物
D.“焙烧2”中发生了反应
13.0.3g有机化合物R在足量氧气中充分燃烧,只生成和。下列说法错误的是
A.R属于烃类 B.光照下,R能与氯气发生取代反应
C.R中含有不饱和键 D.R中碳、氢原子个数比为1:3
14.下列方案、现象和结论均正确的是
选项 方案 现象 结论
A 取少量蔗糖于烧杯中,加入少量水,搅拌均匀,再加入浓硫酸,迅速搅拌 蔗糖变黑,同时膨胀变大 浓硫酸具有脱水性及强氧化性
B 向红色石蕊试液中通入 红色石蕊试液褪色 具有漂白性
C 向溶液中投入金属Na 有红色固体析出 Na的活泼性比Cu强
D 将红热的木炭投入稀硝酸中 产生红棕色气体 木炭与稀硝酸在加热条件下反应生成
A.A B.B C.C D.D
15.某澄清溶液中,可能含有中的几种离子。现取该溶液100mL进行如下实验:
序号 实验内容 实验结果
I 向该溶液中加入足量稀盐酸 产生白色沉淀并放出1.12L(标准状况下)气体
Ⅱ 将I的反应混合液过滤,先对沉淀洗涤,后灼烧至恒重,称量所得固体质量 固体质量为3.0g
Ⅲ 向Ⅱ的滤液中滴加溶液 无明显现象
下列说法错误的是
A.原溶液中一定不存在 B.原溶液中不确定是否含有和
C.原溶液中 D.原溶液中一定含有,且
二、解答题
16.含硫废盐水的主要成分为接近饱和的氯化钠以及硫化钠、硫氢化钠,还含有溶解在水中的硫化氢,硫含量为。将含硫废盐水进行回收和综合利用的流程如图。
回答下列问题:
(1)加入盐酸时,发生的主要反应的离子方程式为 、 。
(2)加入盐酸时,需向含硫高浓度废盐水中通入高纯,代替通入空气的原因是 。
(3)加入盐酸时,3h内,反应液pH变化和温度变化对除硫效果的影响如下。
温度对除硫效果的影响
温度 除硫后体系中的硫含量/
20 32.3
40 18.15
60 8.69
80 3.27
①3h内,硫含量大幅降低,可能原因为 。
②结合成本考虑,最佳的pH和温度分别为 、 。
(4)对精制盐水通电时发生反应的化学方程式为 ;流程图中可循环利用的物质为 (填名称,写1种即可)。
17.乙酸正丙酯可用作调味剂、食用香料等。某化学兴趣小组欲利用如图所示装置制备乙酸正丙酯。
回答下列问题:
(1)加热可使生成的乙酸正丙酯挥发而方便收集,提高正丙醇、乙酸的转化率,还起到的作用是 。
(2)实验室若没有沸石,可以用 代替。
(3)浓硫酸的作用为吸水剂和 。
(4)装置中的长导管的作用是 ;导管末端不伸入液面下的目的是 。
(5)饱和溶液的作用是 。
(6)乙酸正丙酯的同分异构体中,含有羧基的结构有 种。
18.氮及其化合物在生产、生活中应用广泛。回答下列问题:
(1)氨气是重要的化工原料。
①写出实验室制氨气的化学方程式: 。
②工业上合成氨气的原理为,已知该反应为放热反应。则反应的能量变化可以用图中的 (填标号)表示。
(2)一定温度下,向2L恒容密闭容器中充入和进行合成氨反应。实验测得各物质的物质的量与时间的关系如图所示。
①下列情况表明该反应已达到平衡状态的是 (填标号)。
A.容器内气体的压强保持不变 B.
C.容器内气体的密度保持不变 D.和的百分含量相等
②内, ;反应达到平衡后,体积分数为 。
(3)肼(,又称联氨)-空气碱性燃料电池具有燃料易运输与储存、重量轻、体积小、能量效率高等优点,具有广阔的应用前景,尤其适用于便携式电源。一种肼-空气碱性燃料电池的结构如图所示。
电池工作时,向电极 (填“a”或“b”)移动,负极的电极反应式为 。
19.乙烯是石油化学工业重要的基本原料,可用于合成多种产品,乙烯的某种综合利用路线如图。
(1)的反应类型为 。
(2)B与D反应生成E的化学方程式是 。
(3)G分子中含有的官能团名称是 。
(4)1molH与足量的NaOH溶液反应,消耗NaOH的物质的量为 mol。
(5)上述路线涉及的反应中,原子利用率为的是 (填序号)。
(6)H(丙烯酸乙酯)是合成聚丙烯酸乙酯的单体,写出由H生成聚丙烯酸乙酯反应的化学方程式: ;该高分子的链节为 。
题号 1 2 3 4 5 6 7 8 9 10
答案 D C C A B D B C C A
题号 11 12 13 14 15
答案 D D C A D
16.(1)
(2)防止被空气中的氧气氧化(或其他合理答案)
(3) 盐酸浓度增大,生成的速率增大 1.4
(4) 盐酸或氢氧化钠溶液
17.(1)加快反应速率
(2)碎瓷片
(3)作催化剂
(4) 导气和冷凝 防止倒吸
(5)吸收正丙醇,中和乙酸,降低乙酸正丙酯的溶解度
(6)4
18.(1) 或] a
(2) AD 0.125 50
(3) b
19.(1)加成反应
(2)
(3)碳碳双键、羧基
(4)1
(5)①③
(6) nCH2=CHCOOCH2CH3
一、单选题
1.文物是历史的见证者。下列辽宁省博物馆馆藏文物中,其主要成分为有机物的是
A.白瓷横梁鸡冠壶 B.宋钧窑莲花式钵 C.辽契丹文铜鱼符 D.九霄环佩琴
2.科学、安全、有效和合理利用自然资源,是当今社会的重要课题。下列说法错误的是
A.要根据金属活泼性选择金属冶炼方法 B.蒸馏法淡化海水成本较高,不宜大规模推广
C.煤的干馏和石油的分馏过程中均会发生化学反应 D.合成药物可以促进人类健康,但不能过度使用
3.下列化学用语或表述正确的是
A.中子数为1的氢核素: B.为离子化合物
C.乙烯的空间填充模型: D.的电子式:
4.下列处理方法不合适的是
A.浓硫酸溅到手上,立即用质量分数为的溶液冲洗
B.将实验后剩余的钠块直接放回原试剂瓶
C.不能用手直接触摸实验室药品
D.水银温度计打碎后,立即用硫粉覆盖
5.下列人类活动中,没发生放热反应的是
A.燃烧甲烷做饭 B.用速冷冰袋冷敷伤痛处
C.氧炔焰焊接金属 D.Zn与稀硫酸反应制氢气
6.电池在生活中随处可见,下列装置能将化学能转化成电能的是
A. B. C. D.
7.有机化合物M常用于调配高级香水、护肤品和洗涤剂等,在医疗上具有抗紫外线、减少黑色素生成、抗炎、镇静、抗肿瘤等功效,其分子结构如图。下列有关说法正确的是
A.M的分子式为 B.M含有2种官能团
C.M能与NaOH发生反应 D.M不能发生取代反应
8.X、Y、Z、W是原子序数依次递增的短周期主族元素,已知X与W同主族,W的内层电子总数是其最外层电子数的2倍,常温下,Y的单质是有毒气体,Z元素原子半径在短周期中最大。下列叙述错误的是
A.原子半径: B.为含共价键的离子化合物
C.Y的最高价氧化物对应的水化物为强酸 D.最简单氢化物的稳定性:
9.利用下列实验装置进行的相应实验能达到实验目的的是
A.探究不同金属离子对双氧水分解速率的影响 B.除去中的
C.分离氯仿和水 D.制备无水乙酸
A.A B.B C.C D.D
10.微粒相遇时的色彩变化蕴含化学奥秘。下列对颜色变化的解释错误的是
选项 颜色变化 解释
A 将等体积等物质的量浓度的硫酸铝钾溶液与溶液混合,有白色沉淀产生
B 将铜粉加入含有双氧水的稀硫酸中,溶液变蓝
C 将新制氯水滴入淀粉-KI溶液中,溶液变蓝
D 将KSCN溶液滴入溶液中,溶液变为红色
A.A B.B C.C D.D
11.实验室用NaClO溶液与反应可制备联氨,反应原理为(未配平),设为阿伏加德罗常数的值。下列关于该反应的说法正确的是
A.溶液中含的数目为 B.22.4L氨气中含有分子的数目为
C.中含有中子的数目为 D.每生成,转移电子的数目为
12.白合金是铜钴矿冶炼过程的中间产物,一种从白合金(主要含,还含少量)中分离回收金属的流程如下:
已知:难溶于稀硫酸。
下列说法正确的是
A.“滤液1”中的金属离子只有
B.“氧化”时的反应为
C.“滤渣2”中的为两性氧化物
D.“焙烧2”中发生了反应
13.0.3g有机化合物R在足量氧气中充分燃烧,只生成和。下列说法错误的是
A.R属于烃类 B.光照下,R能与氯气发生取代反应
C.R中含有不饱和键 D.R中碳、氢原子个数比为1:3
14.下列方案、现象和结论均正确的是
选项 方案 现象 结论
A 取少量蔗糖于烧杯中,加入少量水,搅拌均匀,再加入浓硫酸,迅速搅拌 蔗糖变黑,同时膨胀变大 浓硫酸具有脱水性及强氧化性
B 向红色石蕊试液中通入 红色石蕊试液褪色 具有漂白性
C 向溶液中投入金属Na 有红色固体析出 Na的活泼性比Cu强
D 将红热的木炭投入稀硝酸中 产生红棕色气体 木炭与稀硝酸在加热条件下反应生成
A.A B.B C.C D.D
15.某澄清溶液中,可能含有中的几种离子。现取该溶液100mL进行如下实验:
序号 实验内容 实验结果
I 向该溶液中加入足量稀盐酸 产生白色沉淀并放出1.12L(标准状况下)气体
Ⅱ 将I的反应混合液过滤,先对沉淀洗涤,后灼烧至恒重,称量所得固体质量 固体质量为3.0g
Ⅲ 向Ⅱ的滤液中滴加溶液 无明显现象
下列说法错误的是
A.原溶液中一定不存在 B.原溶液中不确定是否含有和
C.原溶液中 D.原溶液中一定含有,且
二、解答题
16.含硫废盐水的主要成分为接近饱和的氯化钠以及硫化钠、硫氢化钠,还含有溶解在水中的硫化氢,硫含量为。将含硫废盐水进行回收和综合利用的流程如图。
回答下列问题:
(1)加入盐酸时,发生的主要反应的离子方程式为 、 。
(2)加入盐酸时,需向含硫高浓度废盐水中通入高纯,代替通入空气的原因是 。
(3)加入盐酸时,3h内,反应液pH变化和温度变化对除硫效果的影响如下。
温度对除硫效果的影响
温度 除硫后体系中的硫含量/
20 32.3
40 18.15
60 8.69
80 3.27
①3h内,硫含量大幅降低,可能原因为 。
②结合成本考虑,最佳的pH和温度分别为 、 。
(4)对精制盐水通电时发生反应的化学方程式为 ;流程图中可循环利用的物质为 (填名称,写1种即可)。
17.乙酸正丙酯可用作调味剂、食用香料等。某化学兴趣小组欲利用如图所示装置制备乙酸正丙酯。
回答下列问题:
(1)加热可使生成的乙酸正丙酯挥发而方便收集,提高正丙醇、乙酸的转化率,还起到的作用是 。
(2)实验室若没有沸石,可以用 代替。
(3)浓硫酸的作用为吸水剂和 。
(4)装置中的长导管的作用是 ;导管末端不伸入液面下的目的是 。
(5)饱和溶液的作用是 。
(6)乙酸正丙酯的同分异构体中,含有羧基的结构有 种。
18.氮及其化合物在生产、生活中应用广泛。回答下列问题:
(1)氨气是重要的化工原料。
①写出实验室制氨气的化学方程式: 。
②工业上合成氨气的原理为,已知该反应为放热反应。则反应的能量变化可以用图中的 (填标号)表示。
(2)一定温度下,向2L恒容密闭容器中充入和进行合成氨反应。实验测得各物质的物质的量与时间的关系如图所示。
①下列情况表明该反应已达到平衡状态的是 (填标号)。
A.容器内气体的压强保持不变 B.
C.容器内气体的密度保持不变 D.和的百分含量相等
②内, ;反应达到平衡后,体积分数为 。
(3)肼(,又称联氨)-空气碱性燃料电池具有燃料易运输与储存、重量轻、体积小、能量效率高等优点,具有广阔的应用前景,尤其适用于便携式电源。一种肼-空气碱性燃料电池的结构如图所示。
电池工作时,向电极 (填“a”或“b”)移动,负极的电极反应式为 。
19.乙烯是石油化学工业重要的基本原料,可用于合成多种产品,乙烯的某种综合利用路线如图。
(1)的反应类型为 。
(2)B与D反应生成E的化学方程式是 。
(3)G分子中含有的官能团名称是 。
(4)1molH与足量的NaOH溶液反应,消耗NaOH的物质的量为 mol。
(5)上述路线涉及的反应中,原子利用率为的是 (填序号)。
(6)H(丙烯酸乙酯)是合成聚丙烯酸乙酯的单体,写出由H生成聚丙烯酸乙酯反应的化学方程式: ;该高分子的链节为 。
题号 1 2 3 4 5 6 7 8 9 10
答案 D C C A B D B C C A
题号 11 12 13 14 15
答案 D D C A D
16.(1)
(2)防止被空气中的氧气氧化(或其他合理答案)
(3) 盐酸浓度增大,生成的速率增大 1.4
(4) 盐酸或氢氧化钠溶液
17.(1)加快反应速率
(2)碎瓷片
(3)作催化剂
(4) 导气和冷凝 防止倒吸
(5)吸收正丙醇,中和乙酸,降低乙酸正丙酯的溶解度
(6)4
18.(1) 或] a
(2) AD 0.125 50
(3) b
19.(1)加成反应
(2)
(3)碳碳双键、羧基
(4)1
(5)①③
(6) nCH2=CHCOOCH2CH3
同课章节目录
