陕西省宝鸡市2024-2025学年高三上学期高考模拟检测(一)化学试卷(含答案)
文档属性
| 名称 | 陕西省宝鸡市2024-2025学年高三上学期高考模拟检测(一)化学试卷(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-19 00:00:00 | ||
图片预览




文档简介
2025年陕西省宝鸡市高考模拟检测(一)化学试卷
一、单选题
1.“研究三秦宝贝,讲好三秦故事”。下列文物的主要材质属于有机高分子的是
A.宝鸡的何尊 B.陕北的羊皮袄 C.陕西的陶俑 D.官帽上的珍珠
A.A B.B C.C D.D
2.中国四大发明之一的黑火药,爆炸时发生反应。下列表示反应中相关微粒的化学用语正确的是
A.基态碳原子的最外层电子轨道表示式:
B.分子中含有2个键、1个键
C.的电子式为
D.的分子结构模型
3.物质的性质决定用途,下列两者对应关系正确的是
物质的性质 物质的用途
A 具有氧化性 可用于纸浆漂白
B 石墨的性质稳定 可用作润滑剂
C 是两性氧化物 可用作耐高温材料
D 维生素C具有还原性 可用作食品抗氧化剂
A.A B.B C.C D.D
4.下列离子方程式书写正确的是
A.向水垢中滴加足量醋酸
B.向AgCl沉淀中加入过量氨水使AgCl溶解:
C.硫化钠溶液和硝酸混合:
D.向溶液中加入过量NaOH溶液:
5.氯及其化合物在生产生活中应用广泛。图示为氯元素的“价-类”二维图,下列叙述错误的是
A.a和e反应可制备b
B.c可用于自来水杀菌消毒
C.d的水溶液在空气中久置,溶液酸性减弱
D.可用浓氨水检测输送b的管道是否发生泄漏
6.2024年6月,我国嫦娥六号首次成功从月球背面采样。研究分析月壤中含有以下几种原子序数不大于20且依次增大的主族元素X、Y、Z、M、W,已知X、Y形成的化合物常用于宇航和潜水作业的供氧剂,Z是地壳中含量最多的金属元素,M的最外层电子数是L层电子数的一半,Y与W同主族。下列说法正确的是
A.最简单氢化物沸点大小:XB.形成的化合物阴阳离子数之比为1∶2
C.M单质常用作光导纤维材料
D.最高价氧化物对应水化物的碱性:W>Y>Z
7.乙酸苯酯在一定条件下可发生如下所示的弗莱斯重排反应,下列说法正确的是
A.X、Y、Z中所有碳原子可能共面 B.在水中的溶解度Z大于Y
C.X、Y、Z都与酸性溶液反应 D.X、Y、Z的苯环上的一溴代物均是4种
8.丙氨酸()分子为手性分子,存在手性异构体,其结构如图所示。下列关于丙氨酸的两种手性异构体(Ⅰ和Ⅱ)的说法正确的是
A.Ⅰ和Ⅱ分子中均存在1个手性碳原子
B.Ⅰ和Ⅱ呈镜面对称,都是非极性分子
C.Ⅰ和Ⅱ含的化学键不同
D.Ⅰ和Ⅱ分子都只含有极性键,不含非极性键
9.丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化图,*表示吸附在催化剂表面的物种,下列有关说法错误的是
A.在该条件下,所得丙烯为混合物
B.该过程中发生了非极性键的断裂与形成
C.由图可知
D.丙烷脱氢制备丙烯的快慢由这一步反应决定
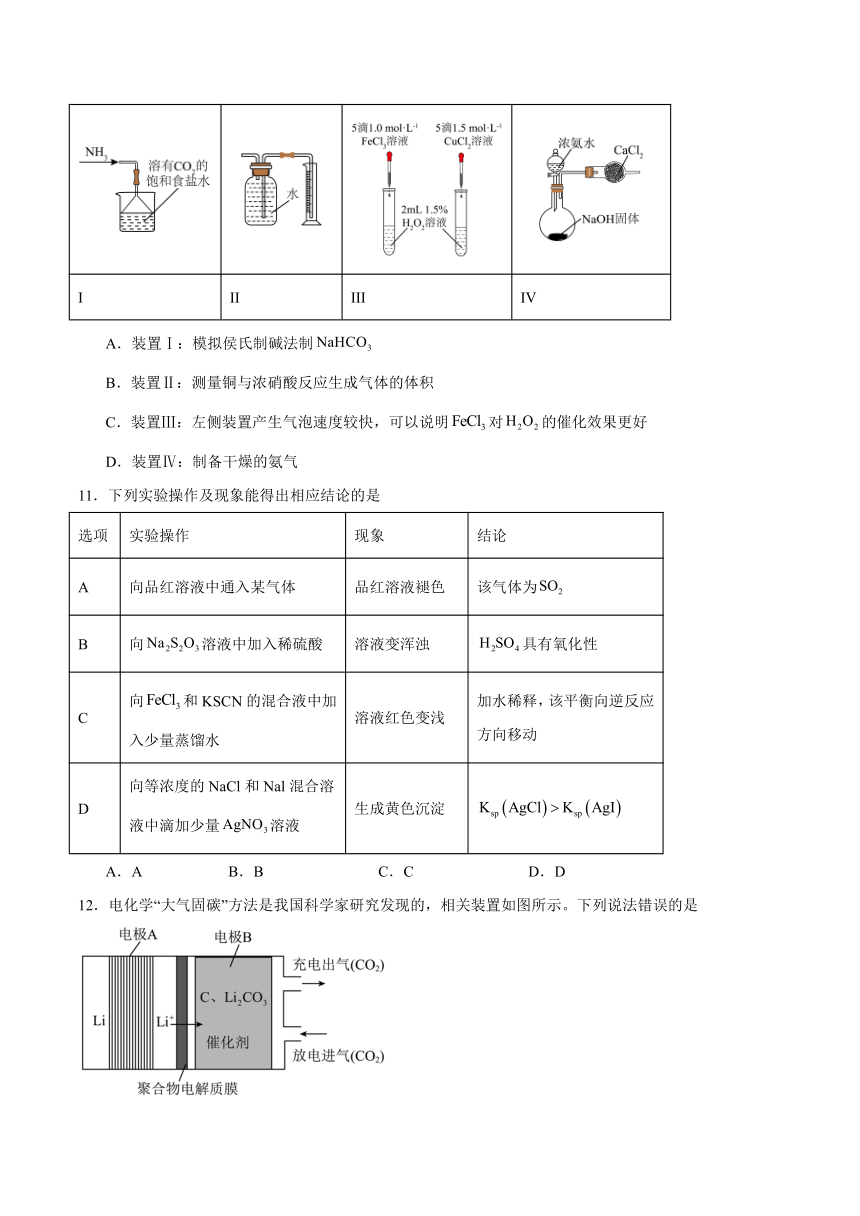
10.用下列仪器或装置(夹持装置略)进行相应实验,能达到实验目的的是
I II III IV
A.装置Ⅰ:模拟侯氏制碱法制
B.装置Ⅱ:测量铜与浓硝酸反应生成气体的体积
C.装置Ⅲ:左侧装置产生气泡速度较快,可以说明对的催化效果更好
D.装置Ⅳ:制备干燥的氨气
11.下列实验操作及现象能得出相应结论的是
选项 实验操作 现象 结论
A 向品红溶液中通入某气体 品红溶液褪色 该气体为
B 向溶液中加入稀硫酸 溶液变浑浊 具有氧化性
C 向和KSCN的混合液中加入少量蒸馏水 溶液红色变浅 加水稀释,该平衡向逆反应方向移动
D 向等浓度的NaCl和Nal混合溶液中滴加少量溶液 生成黄色沉淀
A.A B.B C.C D.D
12.电化学“大气固碳”方法是我国科学家研究发现的,相关装置如图所示。下列说法错误的是
A.放电时,电极A为负极,该电池可选用水溶液做离子导体
B.放电时,电极B上发生的反应是
C.充电时,从电极B移向电极A
D.充电时,外电路中每通过2mol电子,阳极区质量减少80g
13.联氨()可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是
A.键角:
B.含铜的氧化物中,比稳定
C.可处理水中
D.中配体为,配位数为4
14.常温下,向某浓度溶液中逐滴加入已知浓度的NaOH溶液,溶液中[,x为、、]与溶液pH的变化关系如图所示。则下列说法正确的是
A.曲线Ⅱ代表随着pH的变化曲线
B.c点溶液中
C.b点为曲线II与曲线III的交点,b点对应的pH为3.05
D.pH由0.8增大到5.3的过程中,水的电离程度先增大后减小
二、解答题
15.一种废镍催化剂中含有Ni、 Al、Cr。、Cu、FeS及碳粉,以其为原料制备环烷酸镍[(C10H7COO)2Ni,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 Fe3+ Fe2+ Ni2+ Cu2+
开始沉淀的pH 1.9 7.0 6.4 5.4
完全沉淀的pH 3.2 9.0 8.4 6.7
回答下列问题:
(1)充分“灼烧”后,产生废气中的有毒气体的化学式为 。
(2)“灼烧”后Cr转化为Cr2O3已知Cr2O3与Al2O3性质相似,则滤液中阴离子有OH-、 。基态Cr原子的价层电子排布式为 。
(3)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是 。
(4)“调pH”时,溶液pH的范围为 。
(5)常温下,CuS的Ksp极小,用S2-可将Cu2+完全沉淀。CuS晶胞中S2-的位置如图1所示,Cu2+位于S2-所构成的四面体中心,晶胞侧视图如图2所示。
①与S2-距离最近的S2-数目为 。
②CuS的晶胞参数为a pm,阿伏加德罗常数的值为NA,则CuS晶体的密度为 g·cm-3。
(6)环烷酸的化学式为C10H7COOH,写出“合成”反应的化学方程式: 。
(7)测定样品纯度:已知环烷酸镍样品中含有环烷酸杂质。取1.000g环烷酸镍样品,加入足量稀硫酸[发生反应:(C10H7COO)2Ni+H2SO4=2C10H7COOH+ NiSO4]后,用氨水调节溶液pH为9~10时,加入紫脲酸胺作指示剂,用0.1000mol· L-1 EDTA标准溶液滴定(Ni2+与EDTA反应的化学计量数之比为1:1),消耗EDTA标准溶液20.00mL。则环烷酸镍样品纯度为 %。
16.研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。某化学兴趣小组,设计如图实验装置(夹持装置已省略)模拟实现不同价态含硫物质的转化。
(1)仪器b的名称为 。
(2)装置B的作用是贮存多余的气体,B中应放置的液体是 (填标号)。
a.水 b.饱和NaHSO3溶液 c.酸性KMnO4溶液 d.NaOH溶液
(3)若C中只含一种含Ba2+的溶质,实验过程中观察到有白色沉淀产生,则白色沉淀可能为 (填化学式)。
(4)D中可观察到的现象是 ,对应的离子方程式为 (SO2过量)。
(5)检验E中S元素价态发生变化后所形成的阴离子的实验方法是 。
(6)F装置的作用是 。
(7)工业上用Fe2(SO4)3酸性溶液处理SO2尾气的工艺流程如图所示:
反应②中通入空气的目的是 。
17.三氧化钼()是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为)通过一定条件来制备。回答下列相关问题:
(1)已知:①
②
③
则的 (用含、、的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应
①下列说法正确的是 (填序号)
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加的量,平衡正向移动
②达到平衡时的浓度为,充入一定量的,反应再次达到平衡,浓度 (选填“>”、“<”或“=”)
(3)在2L恒容密闭容器中充入和,若仅发生反应:,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,的反应速率为 。
(4)在恒容密闭容器中,加入足量和,仅发生反应:。测得氧气的平衡转化率与起始压强、温度的关系如图1所示,试比较、、的大小 。
(5)可采用“电解法”制备,装置如图所示。
①写出电解时阳极的电极反应式: 。
②电解过程中通过阳离子交换膜的离子主要为 。
18.丹皮酚(G)具有抗心律失常、增强免疫力等多种药理作用,一种合成丹皮酚及其衍生物H的合成路线如下:
(1)B的化学名称为 ,D中的官能团名称 。
(2)B生成C的反应类型为 。
(3)请用*标记出D分子结构中所有的手性碳原子 。
(4)E转变为F的化学方程式为 。
(5)F生成G的过程中可能生成另一种与G具有相同官能团的有机物副产物,这种副产物的结构简式为 。
(6)在G的同分异构体中,同时满足下列条件的共有 种(不考虑立体异构);①与溶液反应放出;②与溶液显色;③苯环上有两个取代基。其中核磁共振氢谱显示为6组峰,且峰面积比为的同分异构体的结构简式为 。
参考答案
1.B
2.D
3.D
4.B
5.C
6.D
7.A
8.A
9.B
10.C
11.D
12.A
13.A
14.C
15.(1)SO2
(2) 、 3d54s1
(3)浓H2SO4稀释放热,可节约能耗、加快反应速率
(4)3. 2≤pH<5.4
(5) 12
(6)2C10H8COOH+ Ni2(OH)2 SO4= (C10H8COO)2Ni+NiSO4+2H2O
(7)80.20
16.(1)分液漏斗
(2)b
(3)或
(4) 生成淡黄色沉淀
(5)取适量反应后的溶液于试管中,先加稀盐酸无现象,再加溶液,有白色沉淀生成
(6)吸收多余的,防止污染空气
(7)将氧化为,实现原料循环利用
17.(1)
(2) ab
(3)0.05
(4)
(5)
18.(1) 苯甲醛 羟基、氨基
(2)加成反应
(3)
(4)
(5)
(6) 6
一、单选题
1.“研究三秦宝贝,讲好三秦故事”。下列文物的主要材质属于有机高分子的是
A.宝鸡的何尊 B.陕北的羊皮袄 C.陕西的陶俑 D.官帽上的珍珠
A.A B.B C.C D.D
2.中国四大发明之一的黑火药,爆炸时发生反应。下列表示反应中相关微粒的化学用语正确的是
A.基态碳原子的最外层电子轨道表示式:
B.分子中含有2个键、1个键
C.的电子式为
D.的分子结构模型
3.物质的性质决定用途,下列两者对应关系正确的是
物质的性质 物质的用途
A 具有氧化性 可用于纸浆漂白
B 石墨的性质稳定 可用作润滑剂
C 是两性氧化物 可用作耐高温材料
D 维生素C具有还原性 可用作食品抗氧化剂
A.A B.B C.C D.D
4.下列离子方程式书写正确的是
A.向水垢中滴加足量醋酸
B.向AgCl沉淀中加入过量氨水使AgCl溶解:
C.硫化钠溶液和硝酸混合:
D.向溶液中加入过量NaOH溶液:
5.氯及其化合物在生产生活中应用广泛。图示为氯元素的“价-类”二维图,下列叙述错误的是
A.a和e反应可制备b
B.c可用于自来水杀菌消毒
C.d的水溶液在空气中久置,溶液酸性减弱
D.可用浓氨水检测输送b的管道是否发生泄漏
6.2024年6月,我国嫦娥六号首次成功从月球背面采样。研究分析月壤中含有以下几种原子序数不大于20且依次增大的主族元素X、Y、Z、M、W,已知X、Y形成的化合物常用于宇航和潜水作业的供氧剂,Z是地壳中含量最多的金属元素,M的最外层电子数是L层电子数的一半,Y与W同主族。下列说法正确的是
A.最简单氢化物沸点大小:X
C.M单质常用作光导纤维材料
D.最高价氧化物对应水化物的碱性:W>Y>Z
7.乙酸苯酯在一定条件下可发生如下所示的弗莱斯重排反应,下列说法正确的是
A.X、Y、Z中所有碳原子可能共面 B.在水中的溶解度Z大于Y
C.X、Y、Z都与酸性溶液反应 D.X、Y、Z的苯环上的一溴代物均是4种
8.丙氨酸()分子为手性分子,存在手性异构体,其结构如图所示。下列关于丙氨酸的两种手性异构体(Ⅰ和Ⅱ)的说法正确的是
A.Ⅰ和Ⅱ分子中均存在1个手性碳原子
B.Ⅰ和Ⅱ呈镜面对称,都是非极性分子
C.Ⅰ和Ⅱ含的化学键不同
D.Ⅰ和Ⅱ分子都只含有极性键,不含非极性键
9.丙烷脱氢是制备丙烯的一种常见方法,下图是某催化剂催化该过程的能量变化图,*表示吸附在催化剂表面的物种,下列有关说法错误的是
A.在该条件下,所得丙烯为混合物
B.该过程中发生了非极性键的断裂与形成
C.由图可知
D.丙烷脱氢制备丙烯的快慢由这一步反应决定
10.用下列仪器或装置(夹持装置略)进行相应实验,能达到实验目的的是
I II III IV
A.装置Ⅰ:模拟侯氏制碱法制
B.装置Ⅱ:测量铜与浓硝酸反应生成气体的体积
C.装置Ⅲ:左侧装置产生气泡速度较快,可以说明对的催化效果更好
D.装置Ⅳ:制备干燥的氨气
11.下列实验操作及现象能得出相应结论的是
选项 实验操作 现象 结论
A 向品红溶液中通入某气体 品红溶液褪色 该气体为
B 向溶液中加入稀硫酸 溶液变浑浊 具有氧化性
C 向和KSCN的混合液中加入少量蒸馏水 溶液红色变浅 加水稀释,该平衡向逆反应方向移动
D 向等浓度的NaCl和Nal混合溶液中滴加少量溶液 生成黄色沉淀
A.A B.B C.C D.D
12.电化学“大气固碳”方法是我国科学家研究发现的,相关装置如图所示。下列说法错误的是
A.放电时,电极A为负极,该电池可选用水溶液做离子导体
B.放电时,电极B上发生的反应是
C.充电时,从电极B移向电极A
D.充电时,外电路中每通过2mol电子,阳极区质量减少80g
13.联氨()可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是
A.键角:
B.含铜的氧化物中,比稳定
C.可处理水中
D.中配体为,配位数为4
14.常温下,向某浓度溶液中逐滴加入已知浓度的NaOH溶液,溶液中[,x为、、]与溶液pH的变化关系如图所示。则下列说法正确的是
A.曲线Ⅱ代表随着pH的变化曲线
B.c点溶液中
C.b点为曲线II与曲线III的交点,b点对应的pH为3.05
D.pH由0.8增大到5.3的过程中,水的电离程度先增大后减小
二、解答题
15.一种废镍催化剂中含有Ni、 Al、Cr。、Cu、FeS及碳粉,以其为原料制备环烷酸镍[(C10H7COO)2Ni,常温下为难溶于水的液体]的工艺流程如图所示:
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 Fe3+ Fe2+ Ni2+ Cu2+
开始沉淀的pH 1.9 7.0 6.4 5.4
完全沉淀的pH 3.2 9.0 8.4 6.7
回答下列问题:
(1)充分“灼烧”后,产生废气中的有毒气体的化学式为 。
(2)“灼烧”后Cr转化为Cr2O3已知Cr2O3与Al2O3性质相似,则滤液中阴离子有OH-、 。基态Cr原子的价层电子排布式为 。
(3)“酸溶”时,先加入一定量的水,然后分次加入浓硫酸,与直接用稀硫酸溶解相比,其优点是 。
(4)“调pH”时,溶液pH的范围为 。
(5)常温下,CuS的Ksp极小,用S2-可将Cu2+完全沉淀。CuS晶胞中S2-的位置如图1所示,Cu2+位于S2-所构成的四面体中心,晶胞侧视图如图2所示。
①与S2-距离最近的S2-数目为 。
②CuS的晶胞参数为a pm,阿伏加德罗常数的值为NA,则CuS晶体的密度为 g·cm-3。
(6)环烷酸的化学式为C10H7COOH,写出“合成”反应的化学方程式: 。
(7)测定样品纯度:已知环烷酸镍样品中含有环烷酸杂质。取1.000g环烷酸镍样品,加入足量稀硫酸[发生反应:(C10H7COO)2Ni+H2SO4=2C10H7COOH+ NiSO4]后,用氨水调节溶液pH为9~10时,加入紫脲酸胺作指示剂,用0.1000mol· L-1 EDTA标准溶液滴定(Ni2+与EDTA反应的化学计量数之比为1:1),消耗EDTA标准溶液20.00mL。则环烷酸镍样品纯度为 %。
16.研究不同价态硫元素之间的转化是合理利用硫元素的基本途径。某化学兴趣小组,设计如图实验装置(夹持装置已省略)模拟实现不同价态含硫物质的转化。
(1)仪器b的名称为 。
(2)装置B的作用是贮存多余的气体,B中应放置的液体是 (填标号)。
a.水 b.饱和NaHSO3溶液 c.酸性KMnO4溶液 d.NaOH溶液
(3)若C中只含一种含Ba2+的溶质,实验过程中观察到有白色沉淀产生,则白色沉淀可能为 (填化学式)。
(4)D中可观察到的现象是 ,对应的离子方程式为 (SO2过量)。
(5)检验E中S元素价态发生变化后所形成的阴离子的实验方法是 。
(6)F装置的作用是 。
(7)工业上用Fe2(SO4)3酸性溶液处理SO2尾气的工艺流程如图所示:
反应②中通入空气的目的是 。
17.三氧化钼()是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为)通过一定条件来制备。回答下列相关问题:
(1)已知:①
②
③
则的 (用含、、的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应
①下列说法正确的是 (填序号)
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加的量,平衡正向移动
②达到平衡时的浓度为,充入一定量的,反应再次达到平衡,浓度 (选填“>”、“<”或“=”)
(3)在2L恒容密闭容器中充入和,若仅发生反应:,5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,的反应速率为 。
(4)在恒容密闭容器中,加入足量和,仅发生反应:。测得氧气的平衡转化率与起始压强、温度的关系如图1所示,试比较、、的大小 。
(5)可采用“电解法”制备,装置如图所示。
①写出电解时阳极的电极反应式: 。
②电解过程中通过阳离子交换膜的离子主要为 。
18.丹皮酚(G)具有抗心律失常、增强免疫力等多种药理作用,一种合成丹皮酚及其衍生物H的合成路线如下:
(1)B的化学名称为 ,D中的官能团名称 。
(2)B生成C的反应类型为 。
(3)请用*标记出D分子结构中所有的手性碳原子 。
(4)E转变为F的化学方程式为 。
(5)F生成G的过程中可能生成另一种与G具有相同官能团的有机物副产物,这种副产物的结构简式为 。
(6)在G的同分异构体中,同时满足下列条件的共有 种(不考虑立体异构);①与溶液反应放出;②与溶液显色;③苯环上有两个取代基。其中核磁共振氢谱显示为6组峰,且峰面积比为的同分异构体的结构简式为 。
参考答案
1.B
2.D
3.D
4.B
5.C
6.D
7.A
8.A
9.B
10.C
11.D
12.A
13.A
14.C
15.(1)SO2
(2) 、 3d54s1
(3)浓H2SO4稀释放热,可节约能耗、加快反应速率
(4)3. 2≤pH<5.4
(5) 12
(6)2C10H8COOH+ Ni2(OH)2 SO4= (C10H8COO)2Ni+NiSO4+2H2O
(7)80.20
16.(1)分液漏斗
(2)b
(3)或
(4) 生成淡黄色沉淀
(5)取适量反应后的溶液于试管中,先加稀盐酸无现象,再加溶液,有白色沉淀生成
(6)吸收多余的,防止污染空气
(7)将氧化为,实现原料循环利用
17.(1)
(2) ab
(3)0.05
(4)
(5)
18.(1) 苯甲醛 羟基、氨基
(2)加成反应
(3)
(4)
(5)
(6) 6
同课章节目录
