黑龙江省哈尔滨市六校2024-2025学年高一上学期期末联考化学试卷(含答案)
文档属性
| 名称 | 黑龙江省哈尔滨市六校2024-2025学年高一上学期期末联考化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 532.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-20 22:00:01 | ||
图片预览



文档简介
黑龙江省哈尔滨市六校联考2024-2025学年高一上学期1月期末化学试题
一、单选题
1.在物质分类中,前者包括后者的是
A.混合物、纯净物 B.化合物、电解质 C.盐、化合物 D.溶液、分散系
2.中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。下列常见古诗文对应化学知识错误的是
选项 古诗文 化学知识
A “慈石()治肾家诸病,而通耳明目。” “慈石”属于金属氧化物
B 《本草经集注》中记载鉴别硝石()和朴硝()的方法:“以火烧之,紫青烟起,乃真硝石也。” 鉴别硝石和朴硝利用了焰色试验
C “墨滴无声入水惊,如烟袅袅幻形生”,“远上寒山石径斜,白云深处有人家” “白云”、“墨滴”均是胶体
D 《吕氏春秋·别关》中关于青铜的记载“金(铜)柔锡柔,合两柔则为刚” 合金的硬度通常小于各组分金属的硬度
A.A B.B C.C D.D
3.下列化学用语正确的是
A.中子数为46的硒原子: B.的电子式:
C.钠离子的结构示意图: D.的结构式:
4.下列有关物质的性质与用途均正确,且具有对应关系的是
A.维生素C具有氧化性,可用作食品抗氧化剂
B.属于碱性氧化物,可用于涂料的红色颜料
C.小苏打受热易分解,可用作治疗胃酸过多的药物
D.具有强氧化性,可用作棉、麻和纸张的漂白剂
5.类推是化学学习和研究常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否。根据你所掌握的知识,判断下列类推结论中正确的是
A.通入溶液产生白色沉淀,所以通入溶液也产生白色沉淀
B.已知溶解度:,推测溶解度:
C.溶于水发生的化学方程式为,则溶于水发生的化学方程式为
D.铝表面的氧化膜可以保护内层铝不被继续氧化,所以铁锈也可以保护内层铁不被继续氧化
6.设NA为阿伏加德罗常数的值。下列说法正确的是
A.在25℃时,的溶液中含有数且为0.02NA
B.过氧化钠与水反应,生成氧气时,转移的电子数为0.4NA
C.常温常压下,的和混合气体含有的原子数为6NA
D.与足量反应失去的电子数为2NA
7.部分含铁物质的分类与相应化合价关系如下图甲所示。下列推断不合理的是
A.X在高温下可与反应生成
B.N在空气中不稳定,利用图乙装置制取N并可减缓其被氧化
C.N在氧气中被氧化为M所发生的化学方程式中氧化剂与还原剂的物质的量之比为1∶4
D.若P为盐酸盐,可将其饱和溶液逐滴滴入氨水中制备胶体
8.下列反应的离子方程式错误的是
A.溶液与过量 溶液反应:
B.利用覆铜板制作印刷电路板:
C.与稀盐酸混合:
D.向酸性溶液中滴入少量的稀溶液
9.下列除去杂质(括号中的物质为杂质)的方法中,错误的是
A.固体:在纯氧中加热
B.溶液():加入过量铁粉,过滤
C.固体():加入足量的溶液,过滤
D.固体():加热至恒重
10.下列关于元素周期律和元素周期表的说法正确的是
A.从F到Ⅰ的得电子能力和简单氢化物的稳定性均逐渐减弱
B.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
C.第二周期非金属元素气态氢化物溶于水后,溶液都呈酸性
D.从到的原子半径和熔点均逐渐增大
11.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图,则下列说法正确的是
A.单质X与Z的反应产物中,有一种可用于呼吸面具中的供氧剂
B.Z的单质很活泼,能将铁从其盐溶液中置换出来
C.W与R的氢化物稳定性:
D.W的单质有毒,不能用于自来水的消毒
12.在给定条件下,下列物质转化不能实现的是
A.
B.溶液
C.
D.
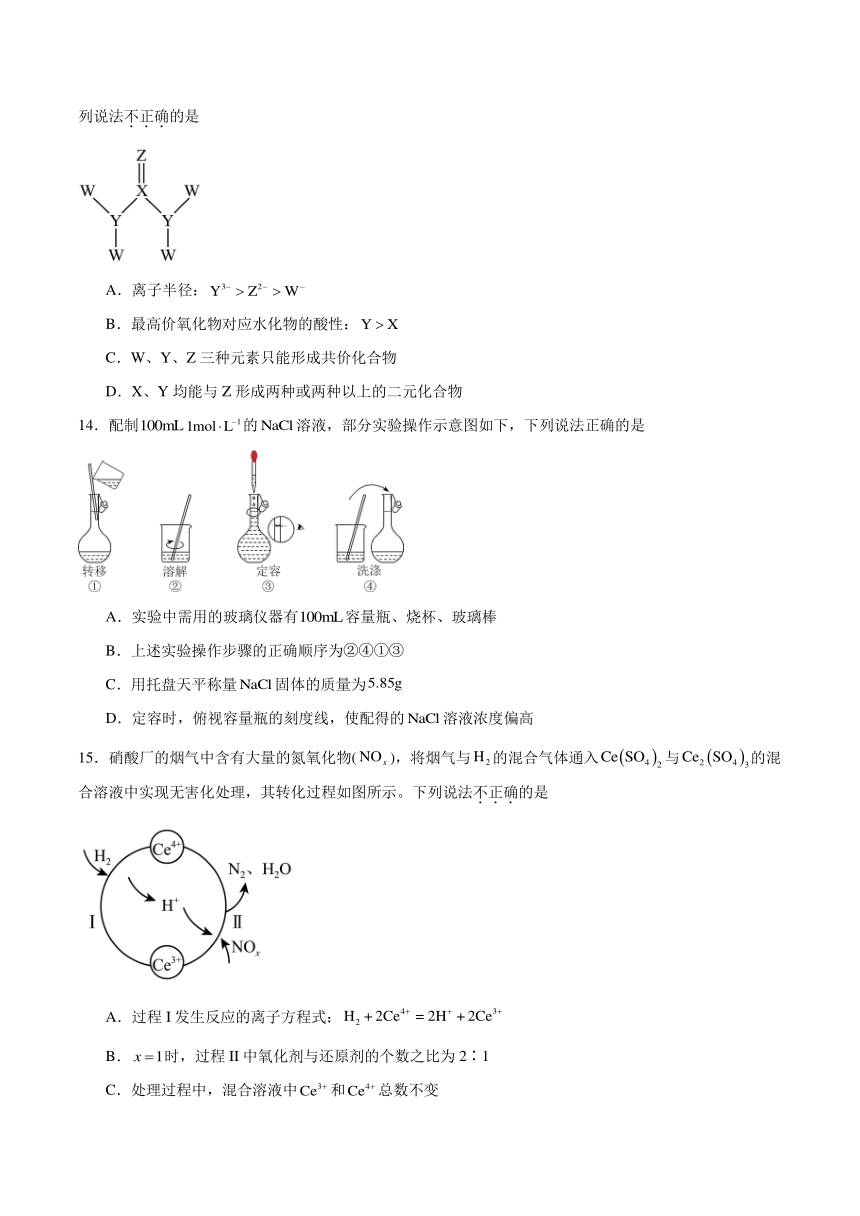
13.一种动物代谢产物的分子结构式如图所示。其中 W、X、Y、Z为原子序数依次增大的短周期主族元素,且核电荷数之和为22,Z原子的L层电子数是电子层数的3倍,Ⅹ最高正价与最低负价的绝对值相等。下列说法不正确的是
A.离子半径:
B.最高价氧化物对应水化物的酸性:
C.W、Y、Z三种元素只能形成共价化合物
D.X、Y均能与Z形成两种或两种以上的二元化合物
14.配制的溶液,部分实验操作示意图如下,下列说法正确的是
A.实验中需用的玻璃仪器有容量瓶、烧杯、玻璃棒
B.上述实验操作步骤的正确顺序为②④①③
C.用托盘天平称量固体的质量为
D.定容时,俯视容量瓶的刻度线,使配得的溶液浓度偏高
15.硝酸厂的烟气中含有大量的氮氧化物(),将烟气与的混合气体通入与的混合溶液中实现无害化处理,其转化过程如图所示。下列说法不正确的是
A.过程I发生反应的离子方程式:
B.时,过程II中氧化剂与还原剂的个数之比为2∶1
C.处理过程中,混合溶液中和总数不变
D.该转化过程的总反应为
二、填空题
16.现有中学化学常见的几种物质:①稀硫酸;②氢氧化铁胶体;③二氧化碳;④熔融氯化钠;⑤铁;⑥乙醇;⑦氢氧化钡粉末;⑧碳酸氢钠溶液。请回答下列问题。
(1)属于电解质的是 (填序号,下同);能导电的是 。
(2)碳酸氢钠在水中的电离方程式是 。
(3)向碳酸氢钠溶液中滴加过量氢氧化钡溶液,发生反应的离子方程式 。
(4)区分①和②的简单方法是 。
(5)用如图装置测定电解质溶液的导电性,若向氢氧化钡溶液中逐滴加入稀硫酸,则灯泡亮度变化是 。
三、解答题
17.针对表中10种元素及由这些元素形成的单质和化合物,完成以下问题。
族 周期 IA IIA IIIA IVA VA VIA VIIA
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
4
(1)非金属性最强的是 (填元素符号),碱性最强的最高价氧化物对应水化物是 (填化学式)。
(2)写出⑥和⑩两种元素组成的化合物电子式的形成过程 ,③和⑤按原子个数比1∶1形成的化合物中含有的化学键为 。
(3)④⑤⑥⑨的简单离子半径由大到小的顺序为 (填离子符号)。
(4)写出元素⑦的单质与元素⑤最高价氧化物对应水化物反应的化学方程式 。
(5)能够比较元素⑨与⑩的非金属性强弱的依据是 (填序号)。
a.氢化物酸性:⑨弱于⑩
b. ⑩单质能与⑨氢化物反应得到⑨单质
c.单质与反应:⑩比⑨容易
d.含氧酸的酸性:⑩强于⑨
18.纳米铁是一种黑色粉末,可用于制作高密度磁性材料。以铁屑(含少量杂质)为原料制备纳米铁粉流程如下:
已知:草酸()是一种二元弱酸。
(1)写出与少量 溶液反应的离子方程式 。
(2)写出“酸溶”时氧化还原反应的离子方程式: 、。
(3)固体灼烧操作所需的硅酸盐质仪器包括:玻璃棒、酒精灯、泥三角、 ;经灼烧后得到红棕色固体和、混合气体,若产物中,则“灼烧”过程中发生反应的化学方程式为 。
(4)纳米铁粉可用于处理含氧酸性废水中的,反应原理如图所示。
①该过程中体现了纳米铁粉的 性(填“氧化”或“还原”)。
②该过程中生成的离子方程式为 ,在铁粉总量一定的条件下,废水中的溶解氧过多不利于的去除,原因是 。
19.亚氯酸钠()是一种高效漂白剂,可由、、反应制取。有类似的性质,在酸性条件下可生成并放出。某化学兴趣小组探究的制备与性质,装置如图所示。回答下列问题。(已知:遇淀粉溶液变蓝色)
I.制备亚氯酸钠。
关闭止水夹②,打开止水夹①,从进气口通入足量,充分反应(反应放出大量热)。
(1)仪器a的名称为 ,仪器b的作用是 。
(2)装置A中生成,反应的离子方程式为 。
(3)实际反应中发现消耗的比理论值偏少,原因可能是 。
Ⅱ.探究亚氯酸钠的性质。
停止通入气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)已知反应物浓度、温度或催化剂等会影响化学反应的速率。开始时A中反应缓慢,稍后产生气体的速率急剧加快。反应急剧加快的可能原因是 。
(5)实验过程中,B中酸化的 淀粉溶液变蓝色,产生该现象的离子方程式为 。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是 ,C中发生反应的化学方程式 。
题号 1 2 3 4 5 6 7 8 9 10
答案 B D D D A C D B B A
题号 11 12 13 14 15
答案 A C C D B
16.(1) ④⑦ ①②④⑤⑧
(2)
(3)
(4)利用丁达尔效应
(5)由亮变暗至熄灭,后又逐渐变亮
17.(1) F
(2) 离子键和(非极性)共价键
(3)
(4)
(5)bc
18.(1)
(2)
(3) 坩埚
(4) 还原 若氧气过多,会将氧化为;过少,不利于还原
19.(1) 圆底烧瓶 防止倒吸
(2)
(3)该反应放热,导致部分分解
(4)与反应生成的对反应起催化作用(或反应放热,温度升高,反应速率加快)
(5)
(6) 再次打开止水夹①,在进气口通入一段时间的空气,让有毒气体完全被吸收
一、单选题
1.在物质分类中,前者包括后者的是
A.混合物、纯净物 B.化合物、电解质 C.盐、化合物 D.溶液、分散系
2.中国传统文化对人类文明贡献巨大,古代文献中记载了很多化学研究成果。下列常见古诗文对应化学知识错误的是
选项 古诗文 化学知识
A “慈石()治肾家诸病,而通耳明目。” “慈石”属于金属氧化物
B 《本草经集注》中记载鉴别硝石()和朴硝()的方法:“以火烧之,紫青烟起,乃真硝石也。” 鉴别硝石和朴硝利用了焰色试验
C “墨滴无声入水惊,如烟袅袅幻形生”,“远上寒山石径斜,白云深处有人家” “白云”、“墨滴”均是胶体
D 《吕氏春秋·别关》中关于青铜的记载“金(铜)柔锡柔,合两柔则为刚” 合金的硬度通常小于各组分金属的硬度
A.A B.B C.C D.D
3.下列化学用语正确的是
A.中子数为46的硒原子: B.的电子式:
C.钠离子的结构示意图: D.的结构式:
4.下列有关物质的性质与用途均正确,且具有对应关系的是
A.维生素C具有氧化性,可用作食品抗氧化剂
B.属于碱性氧化物,可用于涂料的红色颜料
C.小苏打受热易分解,可用作治疗胃酸过多的药物
D.具有强氧化性,可用作棉、麻和纸张的漂白剂
5.类推是化学学习和研究常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否。根据你所掌握的知识,判断下列类推结论中正确的是
A.通入溶液产生白色沉淀,所以通入溶液也产生白色沉淀
B.已知溶解度:,推测溶解度:
C.溶于水发生的化学方程式为,则溶于水发生的化学方程式为
D.铝表面的氧化膜可以保护内层铝不被继续氧化,所以铁锈也可以保护内层铁不被继续氧化
6.设NA为阿伏加德罗常数的值。下列说法正确的是
A.在25℃时,的溶液中含有数且为0.02NA
B.过氧化钠与水反应,生成氧气时,转移的电子数为0.4NA
C.常温常压下,的和混合气体含有的原子数为6NA
D.与足量反应失去的电子数为2NA
7.部分含铁物质的分类与相应化合价关系如下图甲所示。下列推断不合理的是
A.X在高温下可与反应生成
B.N在空气中不稳定,利用图乙装置制取N并可减缓其被氧化
C.N在氧气中被氧化为M所发生的化学方程式中氧化剂与还原剂的物质的量之比为1∶4
D.若P为盐酸盐,可将其饱和溶液逐滴滴入氨水中制备胶体
8.下列反应的离子方程式错误的是
A.溶液与过量 溶液反应:
B.利用覆铜板制作印刷电路板:
C.与稀盐酸混合:
D.向酸性溶液中滴入少量的稀溶液
9.下列除去杂质(括号中的物质为杂质)的方法中,错误的是
A.固体:在纯氧中加热
B.溶液():加入过量铁粉,过滤
C.固体():加入足量的溶液,过滤
D.固体():加热至恒重
10.下列关于元素周期律和元素周期表的说法正确的是
A.从F到Ⅰ的得电子能力和简单氢化物的稳定性均逐渐减弱
B.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
C.第二周期非金属元素气态氢化物溶于水后,溶液都呈酸性
D.从到的原子半径和熔点均逐渐增大
11.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图,则下列说法正确的是
A.单质X与Z的反应产物中,有一种可用于呼吸面具中的供氧剂
B.Z的单质很活泼,能将铁从其盐溶液中置换出来
C.W与R的氢化物稳定性:
D.W的单质有毒,不能用于自来水的消毒
12.在给定条件下,下列物质转化不能实现的是
A.
B.溶液
C.
D.
13.一种动物代谢产物的分子结构式如图所示。其中 W、X、Y、Z为原子序数依次增大的短周期主族元素,且核电荷数之和为22,Z原子的L层电子数是电子层数的3倍,Ⅹ最高正价与最低负价的绝对值相等。下列说法不正确的是
A.离子半径:
B.最高价氧化物对应水化物的酸性:
C.W、Y、Z三种元素只能形成共价化合物
D.X、Y均能与Z形成两种或两种以上的二元化合物
14.配制的溶液,部分实验操作示意图如下,下列说法正确的是
A.实验中需用的玻璃仪器有容量瓶、烧杯、玻璃棒
B.上述实验操作步骤的正确顺序为②④①③
C.用托盘天平称量固体的质量为
D.定容时,俯视容量瓶的刻度线,使配得的溶液浓度偏高
15.硝酸厂的烟气中含有大量的氮氧化物(),将烟气与的混合气体通入与的混合溶液中实现无害化处理,其转化过程如图所示。下列说法不正确的是
A.过程I发生反应的离子方程式:
B.时,过程II中氧化剂与还原剂的个数之比为2∶1
C.处理过程中,混合溶液中和总数不变
D.该转化过程的总反应为
二、填空题
16.现有中学化学常见的几种物质:①稀硫酸;②氢氧化铁胶体;③二氧化碳;④熔融氯化钠;⑤铁;⑥乙醇;⑦氢氧化钡粉末;⑧碳酸氢钠溶液。请回答下列问题。
(1)属于电解质的是 (填序号,下同);能导电的是 。
(2)碳酸氢钠在水中的电离方程式是 。
(3)向碳酸氢钠溶液中滴加过量氢氧化钡溶液,发生反应的离子方程式 。
(4)区分①和②的简单方法是 。
(5)用如图装置测定电解质溶液的导电性,若向氢氧化钡溶液中逐滴加入稀硫酸,则灯泡亮度变化是 。
三、解答题
17.针对表中10种元素及由这些元素形成的单质和化合物,完成以下问题。
族 周期 IA IIA IIIA IVA VA VIA VIIA
2 ① ② ③ ④
3 ⑤ ⑥ ⑦ ⑧ ⑨ ⑩
4
(1)非金属性最强的是 (填元素符号),碱性最强的最高价氧化物对应水化物是 (填化学式)。
(2)写出⑥和⑩两种元素组成的化合物电子式的形成过程 ,③和⑤按原子个数比1∶1形成的化合物中含有的化学键为 。
(3)④⑤⑥⑨的简单离子半径由大到小的顺序为 (填离子符号)。
(4)写出元素⑦的单质与元素⑤最高价氧化物对应水化物反应的化学方程式 。
(5)能够比较元素⑨与⑩的非金属性强弱的依据是 (填序号)。
a.氢化物酸性:⑨弱于⑩
b. ⑩单质能与⑨氢化物反应得到⑨单质
c.单质与反应:⑩比⑨容易
d.含氧酸的酸性:⑩强于⑨
18.纳米铁是一种黑色粉末,可用于制作高密度磁性材料。以铁屑(含少量杂质)为原料制备纳米铁粉流程如下:
已知:草酸()是一种二元弱酸。
(1)写出与少量 溶液反应的离子方程式 。
(2)写出“酸溶”时氧化还原反应的离子方程式: 、。
(3)固体灼烧操作所需的硅酸盐质仪器包括:玻璃棒、酒精灯、泥三角、 ;经灼烧后得到红棕色固体和、混合气体,若产物中,则“灼烧”过程中发生反应的化学方程式为 。
(4)纳米铁粉可用于处理含氧酸性废水中的,反应原理如图所示。
①该过程中体现了纳米铁粉的 性(填“氧化”或“还原”)。
②该过程中生成的离子方程式为 ,在铁粉总量一定的条件下,废水中的溶解氧过多不利于的去除,原因是 。
19.亚氯酸钠()是一种高效漂白剂,可由、、反应制取。有类似的性质,在酸性条件下可生成并放出。某化学兴趣小组探究的制备与性质,装置如图所示。回答下列问题。(已知:遇淀粉溶液变蓝色)
I.制备亚氯酸钠。
关闭止水夹②,打开止水夹①,从进气口通入足量,充分反应(反应放出大量热)。
(1)仪器a的名称为 ,仪器b的作用是 。
(2)装置A中生成,反应的离子方程式为 。
(3)实际反应中发现消耗的比理论值偏少,原因可能是 。
Ⅱ.探究亚氯酸钠的性质。
停止通入气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)已知反应物浓度、温度或催化剂等会影响化学反应的速率。开始时A中反应缓慢,稍后产生气体的速率急剧加快。反应急剧加快的可能原因是 。
(5)实验过程中,B中酸化的 淀粉溶液变蓝色,产生该现象的离子方程式为 。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是 ,C中发生反应的化学方程式 。
题号 1 2 3 4 5 6 7 8 9 10
答案 B D D D A C D B B A
题号 11 12 13 14 15
答案 A C C D B
16.(1) ④⑦ ①②④⑤⑧
(2)
(3)
(4)利用丁达尔效应
(5)由亮变暗至熄灭,后又逐渐变亮
17.(1) F
(2) 离子键和(非极性)共价键
(3)
(4)
(5)bc
18.(1)
(2)
(3) 坩埚
(4) 还原 若氧气过多,会将氧化为;过少,不利于还原
19.(1) 圆底烧瓶 防止倒吸
(2)
(3)该反应放热,导致部分分解
(4)与反应生成的对反应起催化作用(或反应放热,温度升高,反应速率加快)
(5)
(6) 再次打开止水夹①,在进气口通入一段时间的空气,让有毒气体完全被吸收
同课章节目录
