涟水县第一中学2024-2025学年高二上学期期末调研测试化学试卷(含答案)
文档属性
| 名称 | 涟水县第一中学2024-2025学年高二上学期期末调研测试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 350.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-21 20:57:00 | ||
图片预览



文档简介
江苏省淮安市涟水县第一中学2024-2025学年高二上学期 期末调研测试化学试题
一、单选题
1.从有利于实现“碳中和”的角度考虑,下列燃料中较理想的是
A.煤 B.汽油 C.天然气 D.氢气
2.下列物质中,含有共价键的离子化合物是
A.H2O B.MgCl2 C.KOH D.CO2
3.下列属于物理变化的是
A.煤的干馏 B.煤的气化 C.石油分馏 D.煤的液化
4.下列物质属于电解质的是
A.铁 B.冰 C.蔗糖 D.氯化钠溶液
5.当光束通过下列分散系时,能观察到丁达尔效应的是
A.稀硫酸 B.胶体 C.蔗糖溶液 D.溶液
6.既可用排水法又可用向上排空气法收集的气体是( )
A.O2 B.NO C.NH3 D.NO2
7.硅酸钠又名泡花碱,其水溶液俗称“水玻璃”,“水玻璃”属于
A.碱 B.盐 C.化合物 D.混合物
8.下列物质互为同分异构体的是
A.金刚石和石墨 B.和
C.乙醇和乙酸 D.和
9.下列各组离子在给定条件下一定能大量共存的是
A.无色溶液:Na+、、Cl-、
B.酸性溶液:、Fe3+、SCN-、
C.碱性溶液:K+、Al3+、、
D.遇酚酞变红的溶液:Na+、K+、、
10.是重要的核工业原料。下列有关U说法错误的是
A.质量数为235 B.核外有92个电子
C.含有143个中子 D.与互为同素异形体
阅读下列材料,完成下列小题。
N2是合成氨工业的重要原料,NH3可制造化肥,可与NaCl、H2O、CO2制得NaHCO3,NaHCO3分解可得到Na2CO3。NH3还能通过催化氧化生产HNO3;HNO3能溶解Cu、Ag等金属。在高温或放电条件下,N2与O2反应生成NO。在催化剂和加热条件下,CO、NH3等可将烟气和机动车尾气中的NO还原为N2。
11.在元素周期表中,C、N、O位于同一周期,它们具有相同的
A.核电荷数 B.核外电子数 C.电子层数 D.最外层电子数
12.下列关于C、N、O元素及其化合物的说法正确的是
A.原子半径:r(O)>r(N)>r(C) B.酸性:HNO3>H2CO3
C.稳定性:NH3>H2O D.还原性:NO>CO
13.下列有关化学用语表示正确的是
A.甲烷的结构式:CH4 B.钠原子的结构示意图:
C.HCl的电子式: D.NaHCO3的电离方程式:NaHCO3=Na++HCO
14.下列离子方程式正确的是
A.NO2与水反应:2NO2+H2O=2H++NO+NO
B.铜溶于稀硝酸:Cu+2H+=Cu2++H2↑
C.将Cl2通入NaOH溶液中:Cl2+2OH-=Cl-+ClO-+H2O
D.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓
15.下列实验方案能达到目的的是
A.用品红溶液鉴别SO2和CO2
B.用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
C.用焰色试验鉴别NaCl溶液和Na2SO4溶液
D.用灼烧闻气味的方法可以区分羊毛和蚕丝
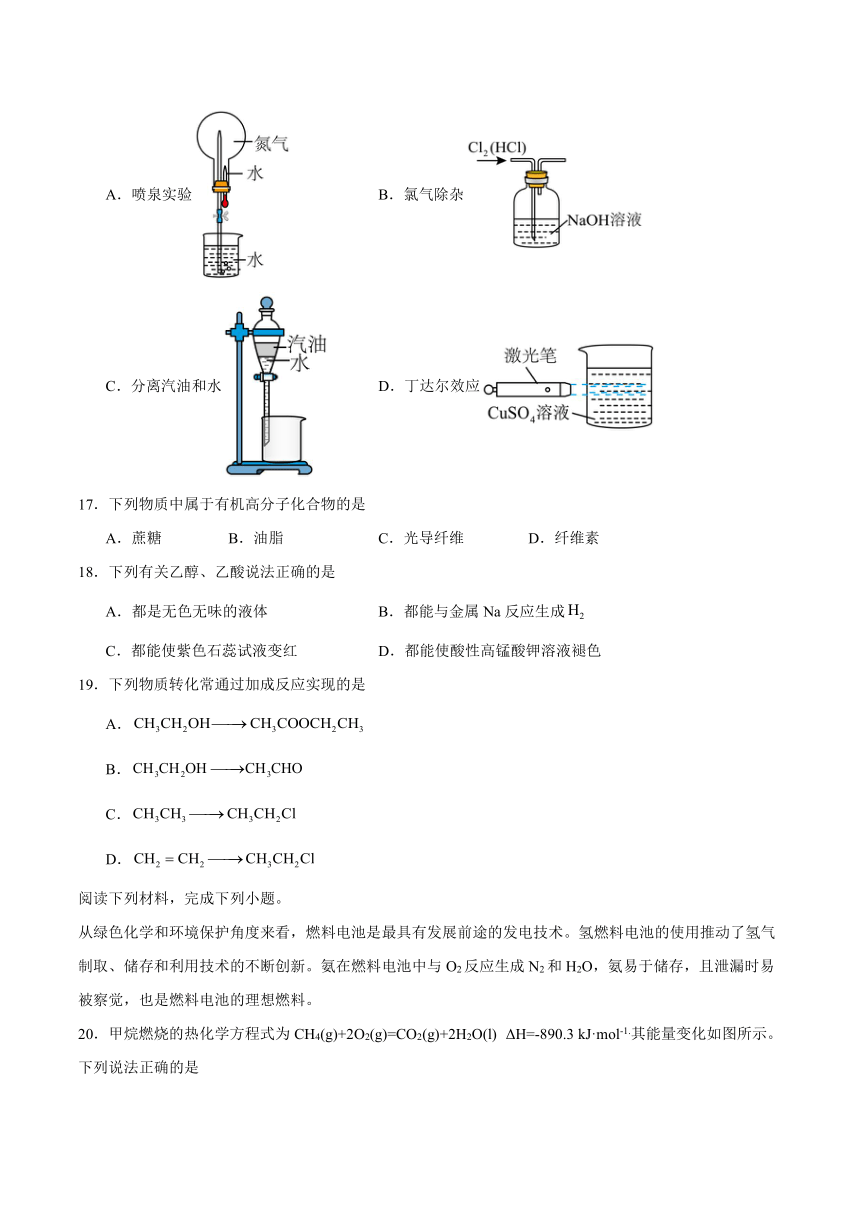
16.下列有关实验方法或操作正确的是
A.喷泉实验 B.氯气除杂
C.分离汽油和水 D.丁达尔效应
17.下列物质中属于有机高分子化合物的是
A.蔗糖 B.油脂 C.光导纤维 D.纤维素
18.下列有关乙醇、乙酸说法正确的是
A.都是无色无味的液体 B.都能与金属Na反应生成
C.都能使紫色石蕊试液变红 D.都能使酸性高锰酸钾溶液褪色
19.下列物质转化常通过加成反应实现的是
A.
B.
C.
D.
阅读下列材料,完成下列小题。
从绿色化学和环境保护角度来看,燃料电池是最具有发展前途的发电技术。氢燃料电池的使用推动了氢气制取、储存和利用技术的不断创新。氨在燃料电池中与O2反应生成N2和H2O,氨易于储存,且泄漏时易被察觉,也是燃料电池的理想燃料。
20.甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1.其能量变化如图所示。下列说法正确的是
A.反应物的总能量低于生成物的总能量 B.反应的能量变化与化学键的断裂和形成有关
C.断开C—H键放出能量 D.该反应是吸热反应
21.NH3—O2燃料电池装置如图所示,下列说法错误的是
A.该NH3—O2燃料电池是将化学能转化为电能的装置 B.电极a是负极
C.NH3发生还原反应 D.电极b上的电极反应式为O2+2H2O+4e-=4OH-
22.氨的下列性质中,与其成为燃料电池的理想燃料不相关的是
A.无色 B.有刺激性气味 C.易液化 D.在电池中与O2反应的产物无污染
23.在演唱会上,我们能看到“星光闪烁”。荧光棒的发光原理是:化学物质相互反应过程中,能量以光的形式释放出来。把荧光棒放在热水中,荧光棒会迅速变亮。原因之一是
A.压强变大,反应速率变快 B.反应物浓度增大,反应速率增大
C.温度升高,反应速率增大 D.热水作为催化剂,从而加快了反应速率
24.工业合成硫酸关键一步是将转化为。对于体积恒定的密闭容器中发生的放热反应,下列说法正确的是
A.增大的浓度可以加快反应速率 B.反应达到平衡后,反应就停止了
C.升高温度该反应速率减慢 D.使用过量的可以使完全转化为
25.关于反应6NO+4NH35N2+6H2O,下列说法正确的是
A.NO被氧化 B.NO失去电子 C.NH3发生还原反应 D.NH3是还原剂
26.纳米级Fe3O4可用于以太阳能为热源分解水制H2,其过程如图所示。下列说法不正确的是'
A.过程I的反应:2Fe3O46FeO+O2 B.过程Ⅱ的反应:
C.两个转化过程都发生了氧化还原反应 D.Fe3O4为整个过程的催化剂
27.下列有关浓硫酸和浓硝酸的叙述中,正确的是
A.都具有强氧化性 B.都可用于制取
C.都能在常温下与Cu反应 D.都具有吸水性
28.下列有关物质的性质与用途不具有对应关系的是
A.NaClO有氧化性,可用于消毒杀菌
B.NaHCO3受热易分解,可用于制胃酸中和剂
C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu
D.Fe粉能与O2反应,可用作食品保存的吸氧剂
二、解答题
29.为实现“碳中和”的目标,资源化利用成为研究热点。将转化为甲酸的一种流程如下:
(1)该流程还得到少量乙酸等副产物,甲酸与乙酸具有相同的官能团是 (写官能团名称)。
(2)被捕集后生成,理论上溶液捕集的在标准状况下的体积约为 L。
(3)在催化剂加热条件下,还原得到,反应的化学方程式为 。
30.过氧化钙晶体(CaO2·8H2O)在常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用作鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用下图制取装置制备过氧化钙晶体:
①装置A中发生反应的化学方程式为 。
②仪器X的名称为 。
③为提高CaO2·8H2O的产率,装置B的温度需控制在0 ℃,可采取的方法是 。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取0.500 0 g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴淀粉溶液,逐滴加入浓度为0.200 mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,消耗Na2S2O3溶液的体积为20.00 mL。
求产品中CaO2·8H2O的质量分数 。(写出计算过程)
已知:CaO2·8H2O +2KI+2H2SO4=CaSO4+K2SO4+I2+10H2O;I2+2S2O=2I-+S4O。
参考答案
1.D
2.C
3.C
4.B
5.B
6.A
7.D
8.D
9.D
10.D
11.C 12.B 13.D 14.C
15.A
16.C
17.D
18.B
19.D
20.B 21.C 22.A
23.C
24.A
25.D
26.B
27.A
28.B
29.(1)羧基
(2)11.2
(3)H2+NaHCO3HCOONa+H2O
30.(1) 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 分液漏斗 将装置B置于冰水浴中
(2)n(Na2S2O3)=0.200 mol·L-1×20.00×10-3 L=0.004 mol
由关系式“CaO2·8H2O~I2~2S2O”可知,n(CaO2·8H2O)=×0.004 mol=0.002 mol,
m(CaO2·8H2O)=0.002 mol×216 g·mol-1=0.432 g
则样品中CaO2·8H2O的质量分数为w(CaO2·8H2O)=×100%=86.4%
一、单选题
1.从有利于实现“碳中和”的角度考虑,下列燃料中较理想的是
A.煤 B.汽油 C.天然气 D.氢气
2.下列物质中,含有共价键的离子化合物是
A.H2O B.MgCl2 C.KOH D.CO2
3.下列属于物理变化的是
A.煤的干馏 B.煤的气化 C.石油分馏 D.煤的液化
4.下列物质属于电解质的是
A.铁 B.冰 C.蔗糖 D.氯化钠溶液
5.当光束通过下列分散系时,能观察到丁达尔效应的是
A.稀硫酸 B.胶体 C.蔗糖溶液 D.溶液
6.既可用排水法又可用向上排空气法收集的气体是( )
A.O2 B.NO C.NH3 D.NO2
7.硅酸钠又名泡花碱,其水溶液俗称“水玻璃”,“水玻璃”属于
A.碱 B.盐 C.化合物 D.混合物
8.下列物质互为同分异构体的是
A.金刚石和石墨 B.和
C.乙醇和乙酸 D.和
9.下列各组离子在给定条件下一定能大量共存的是
A.无色溶液:Na+、、Cl-、
B.酸性溶液:、Fe3+、SCN-、
C.碱性溶液:K+、Al3+、、
D.遇酚酞变红的溶液:Na+、K+、、
10.是重要的核工业原料。下列有关U说法错误的是
A.质量数为235 B.核外有92个电子
C.含有143个中子 D.与互为同素异形体
阅读下列材料,完成下列小题。
N2是合成氨工业的重要原料,NH3可制造化肥,可与NaCl、H2O、CO2制得NaHCO3,NaHCO3分解可得到Na2CO3。NH3还能通过催化氧化生产HNO3;HNO3能溶解Cu、Ag等金属。在高温或放电条件下,N2与O2反应生成NO。在催化剂和加热条件下,CO、NH3等可将烟气和机动车尾气中的NO还原为N2。
11.在元素周期表中,C、N、O位于同一周期,它们具有相同的
A.核电荷数 B.核外电子数 C.电子层数 D.最外层电子数
12.下列关于C、N、O元素及其化合物的说法正确的是
A.原子半径:r(O)>r(N)>r(C) B.酸性:HNO3>H2CO3
C.稳定性:NH3>H2O D.还原性:NO>CO
13.下列有关化学用语表示正确的是
A.甲烷的结构式:CH4 B.钠原子的结构示意图:
C.HCl的电子式: D.NaHCO3的电离方程式:NaHCO3=Na++HCO
14.下列离子方程式正确的是
A.NO2与水反应:2NO2+H2O=2H++NO+NO
B.铜溶于稀硝酸:Cu+2H+=Cu2++H2↑
C.将Cl2通入NaOH溶液中:Cl2+2OH-=Cl-+ClO-+H2O
D.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓
15.下列实验方案能达到目的的是
A.用品红溶液鉴别SO2和CO2
B.用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
C.用焰色试验鉴别NaCl溶液和Na2SO4溶液
D.用灼烧闻气味的方法可以区分羊毛和蚕丝
16.下列有关实验方法或操作正确的是
A.喷泉实验 B.氯气除杂
C.分离汽油和水 D.丁达尔效应
17.下列物质中属于有机高分子化合物的是
A.蔗糖 B.油脂 C.光导纤维 D.纤维素
18.下列有关乙醇、乙酸说法正确的是
A.都是无色无味的液体 B.都能与金属Na反应生成
C.都能使紫色石蕊试液变红 D.都能使酸性高锰酸钾溶液褪色
19.下列物质转化常通过加成反应实现的是
A.
B.
C.
D.
阅读下列材料,完成下列小题。
从绿色化学和环境保护角度来看,燃料电池是最具有发展前途的发电技术。氢燃料电池的使用推动了氢气制取、储存和利用技术的不断创新。氨在燃料电池中与O2反应生成N2和H2O,氨易于储存,且泄漏时易被察觉,也是燃料电池的理想燃料。
20.甲烷燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1.其能量变化如图所示。下列说法正确的是
A.反应物的总能量低于生成物的总能量 B.反应的能量变化与化学键的断裂和形成有关
C.断开C—H键放出能量 D.该反应是吸热反应
21.NH3—O2燃料电池装置如图所示,下列说法错误的是
A.该NH3—O2燃料电池是将化学能转化为电能的装置 B.电极a是负极
C.NH3发生还原反应 D.电极b上的电极反应式为O2+2H2O+4e-=4OH-
22.氨的下列性质中,与其成为燃料电池的理想燃料不相关的是
A.无色 B.有刺激性气味 C.易液化 D.在电池中与O2反应的产物无污染
23.在演唱会上,我们能看到“星光闪烁”。荧光棒的发光原理是:化学物质相互反应过程中,能量以光的形式释放出来。把荧光棒放在热水中,荧光棒会迅速变亮。原因之一是
A.压强变大,反应速率变快 B.反应物浓度增大,反应速率增大
C.温度升高,反应速率增大 D.热水作为催化剂,从而加快了反应速率
24.工业合成硫酸关键一步是将转化为。对于体积恒定的密闭容器中发生的放热反应,下列说法正确的是
A.增大的浓度可以加快反应速率 B.反应达到平衡后,反应就停止了
C.升高温度该反应速率减慢 D.使用过量的可以使完全转化为
25.关于反应6NO+4NH35N2+6H2O,下列说法正确的是
A.NO被氧化 B.NO失去电子 C.NH3发生还原反应 D.NH3是还原剂
26.纳米级Fe3O4可用于以太阳能为热源分解水制H2,其过程如图所示。下列说法不正确的是'
A.过程I的反应:2Fe3O46FeO+O2 B.过程Ⅱ的反应:
C.两个转化过程都发生了氧化还原反应 D.Fe3O4为整个过程的催化剂
27.下列有关浓硫酸和浓硝酸的叙述中,正确的是
A.都具有强氧化性 B.都可用于制取
C.都能在常温下与Cu反应 D.都具有吸水性
28.下列有关物质的性质与用途不具有对应关系的是
A.NaClO有氧化性,可用于消毒杀菌
B.NaHCO3受热易分解,可用于制胃酸中和剂
C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu
D.Fe粉能与O2反应,可用作食品保存的吸氧剂
二、解答题
29.为实现“碳中和”的目标,资源化利用成为研究热点。将转化为甲酸的一种流程如下:
(1)该流程还得到少量乙酸等副产物,甲酸与乙酸具有相同的官能团是 (写官能团名称)。
(2)被捕集后生成,理论上溶液捕集的在标准状况下的体积约为 L。
(3)在催化剂加热条件下,还原得到,反应的化学方程式为 。
30.过氧化钙晶体(CaO2·8H2O)在常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用作鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用下图制取装置制备过氧化钙晶体:
①装置A中发生反应的化学方程式为 。
②仪器X的名称为 。
③为提高CaO2·8H2O的产率,装置B的温度需控制在0 ℃,可采取的方法是 。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取0.500 0 g产品于有塞锥形瓶中,加入适量蒸馏水和过量的KI晶体,再滴入2 mol·L-1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴淀粉溶液,逐滴加入浓度为0.200 mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,消耗Na2S2O3溶液的体积为20.00 mL。
求产品中CaO2·8H2O的质量分数 。(写出计算过程)
已知:CaO2·8H2O +2KI+2H2SO4=CaSO4+K2SO4+I2+10H2O;I2+2S2O=2I-+S4O。
参考答案
1.D
2.C
3.C
4.B
5.B
6.A
7.D
8.D
9.D
10.D
11.C 12.B 13.D 14.C
15.A
16.C
17.D
18.B
19.D
20.B 21.C 22.A
23.C
24.A
25.D
26.B
27.A
28.B
29.(1)羧基
(2)11.2
(3)H2+NaHCO3HCOONa+H2O
30.(1) 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O 分液漏斗 将装置B置于冰水浴中
(2)n(Na2S2O3)=0.200 mol·L-1×20.00×10-3 L=0.004 mol
由关系式“CaO2·8H2O~I2~2S2O”可知,n(CaO2·8H2O)=×0.004 mol=0.002 mol,
m(CaO2·8H2O)=0.002 mol×216 g·mol-1=0.432 g
则样品中CaO2·8H2O的质量分数为w(CaO2·8H2O)=×100%=86.4%
同课章节目录
