2026届高考化学一轮复习周测卷 第12周 化学能与电能(含解析)
文档属性
| 名称 | 2026届高考化学一轮复习周测卷 第12周 化学能与电能(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 268.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 09:41:21 | ||
图片预览

文档简介
第12周 化学能与电能
时间:35分钟 总分:50分
单项选择题(每小题3分,共24分。每小题只有一个选项符合题目要求)
1.(2024 凉州区开学)钢铁锈蚀会造成金属资源的浪费及引发安全事故,下列铁制品的防锈原理与其他三项不同的是( )
用不锈钢制餐具 B.自行车链条涂油
C.水龙头表面镀铬 D.给金属栏杆刷漆
2.(2024春 丰台区期中)图是使LED灯发光的化学电源。下列说法不正确的是( )
A.负极发生氧化反应:Zn-2e-═Zn2+
B.氢离子移向铜片,铜片表面有气泡生成
C.溶液中有电子移向锌片
D.如果将锌片换成铁片,电路中的电流方向不变
3.根据化学反应设计原电池(选用相同的盐桥)时,下列各项中合理的是 ( )
选项 正极(金属/电解质溶液) 负极(金属/电解质溶液)
A Zn/ZnSO4溶液 Fe/稀H2SO4溶液
B Fe/FeCl2溶液 Zn/ZnSO4溶液
C Zn/稀H2SO4溶液 Fe/FeCl2溶液
D Fe/ZnSO4溶液 Zn/FeCl2溶液
4.下列有关电化学的图示,完全正确的是 ( )
A B
C D
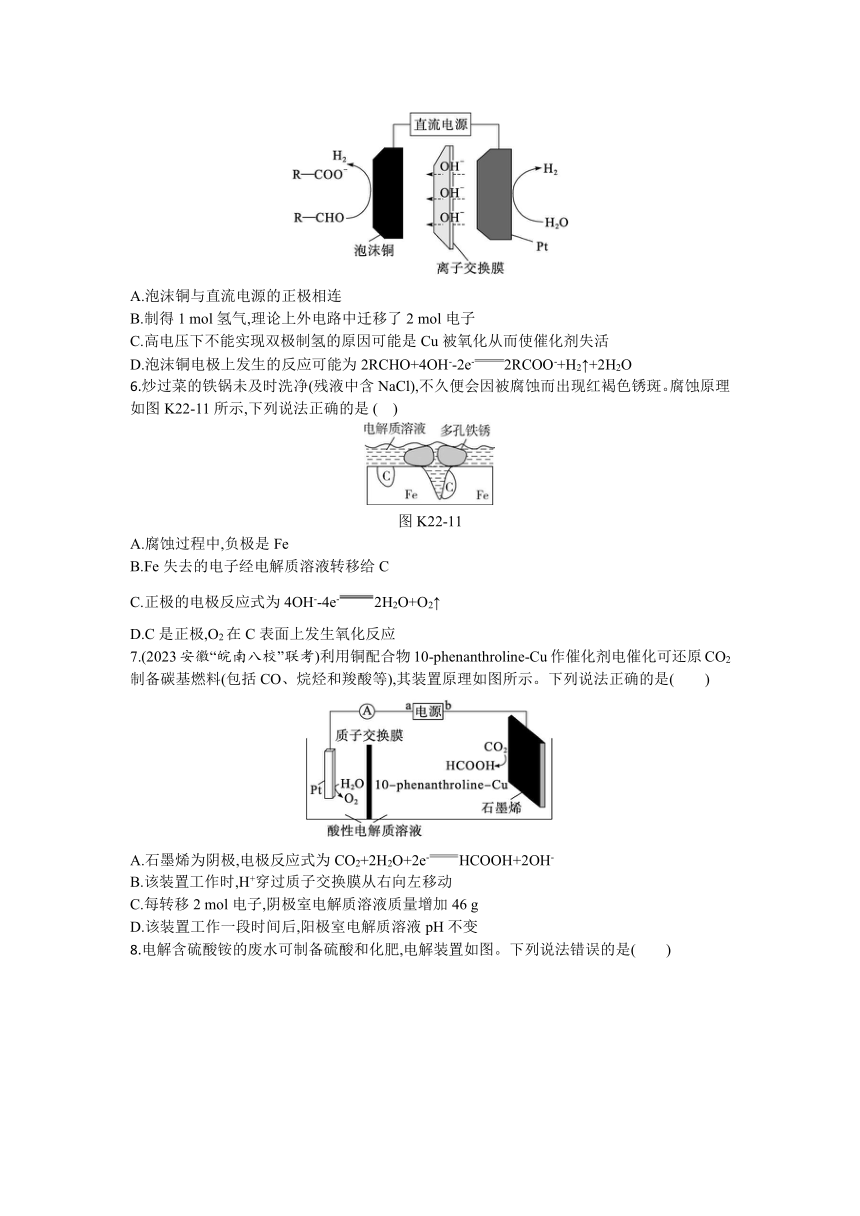
5.(2023河北邯郸十校联考)我国科学家开发出一种双极制氢系统,在低电池电压下的KOH介质中,可将醛类物质电催化转化为相应的羧酸盐和氢气,其工作原理如图所示。下列说法不正确的是( )
A.泡沫铜与直流电源的正极相连
B.制得1 mol氢气,理论上外电路中迁移了2 mol电子
C.高电压下不能实现双极制氢的原因可能是Cu被氧化从而使催化剂失活
D.泡沫铜电极上发生的反应可能为2RCHO+4OH--2e-2RCOO-+H2↑+2H2O
6.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图K22-11所示,下列说法正确的是 ( )
图K22-11
A.腐蚀过程中,负极是Fe
B.Fe失去的电子经电解质溶液转移给C
C.正极的电极反应式为4OH--4e-2H2O+O2↑
D.C是正极,O2在C表面上发生氧化反应
7.(2023安徽“皖南八校”联考)利用铜配合物10-phenanthroline-Cu作催化剂电催化可还原CO2制备碳基燃料(包括CO、烷烃和羧酸等),其装置原理如图所示。下列说法正确的是( )
A.石墨烯为阴极,电极反应式为CO2+2H2O+2e-HCOOH+2OH-
B.该装置工作时,H+穿过质子交换膜从右向左移动
C.每转移2 mol电子,阴极室电解质溶液质量增加46 g
D.该装置工作一段时间后,阳极室电解质溶液pH不变
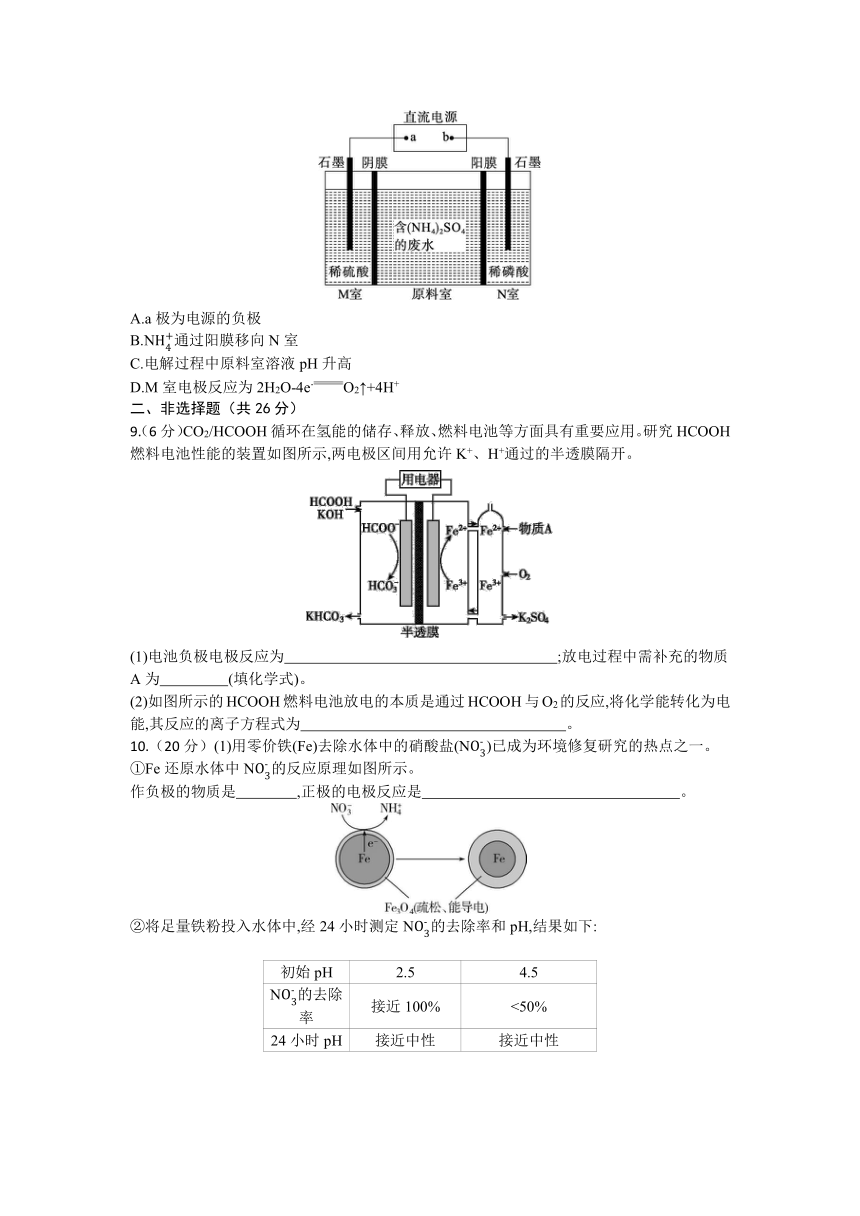
8.电解含硫酸铵的废水可制备硫酸和化肥,电解装置如图。下列说法错误的是( )
A.a极为电源的负极
B.N通过阳膜移向N室
C.电解过程中原料室溶液pH升高
D.M室电极反应为2H2O-4e-O2↑+4H+
二、非选择题(共26分)
9.(6分)CO2/HCOOH循环在氢能的储存、释放、燃料电池等方面具有重要应用。研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
(1)电池负极电极反应为 ;放电过程中需补充的物质A为 (填化学式)。
(2)如图所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
10.(20分)(1)用零价铁(Fe)去除水体中的硝酸盐(N)已成为环境修复研究的热点之一。
①Fe还原水体中N的反应原理如图所示。
作负极的物质是 ,正极的电极反应是 。
②将足量铁粉投入水体中,经24小时测定N的去除率和pH,结果如下:
初始pH 2.5 4.5
N的去除率 接近100% <50%
24小时pH 接近中性 接近中性
铁的最终 物质形态
初始pH=4.5时,N的去除率低,其原因是 。
(2)锂空气电池比锂离子电池具有更高的能量密度,因为其正极(以多孔碳为主)很轻,且氧气从环境中获取而不用保存在电池里。其工作原理如图所示,电池总反应为4Li+O2+2H2O4LiOH。
请回答下列问题:
①该电池的正极反应是 。
②在负极的有机电解液和正极的水性电解液之间,用只能通过锂离子的固体电解质隔开,使用该固体电解质的优点有 。
③正极使用水性电解液的优点是 。
第12周 参考答案
1.A 不锈钢为铁合金,将铁制成合金可达到防腐的目的,故A正确;自行车链条涂油,该防锈原理为隔绝空气从而防锈,故B错误;水龙头表面镀铬,该防锈原理为隔绝空气从而防锈,故C错误;给金属栏杆刷漆,该防锈原理为隔绝空气从而防锈,故D错误。
2.C 铜锌原电池中锌为负极,Zn发生失去电子的氧化反应生成Zn2+,负极反应式为Zn-2e-═Zn2+,故A正确;铜锌原电池中锌为负极,铜为正极,氢离子移向正极铜片,并在铜片表面得电子生成氢气,所以铜片表面有气泡生成,故B正确;电子不能进入溶液中,故C错误;锌、铁均比铜活泼,如果将锌片换成铁片,铁片作负极,铜片作正极,电路中的电流方向不变,故D正确。
3.B 原电池中,负极金属的活动性一般强于正极金属,Zn比Fe活泼,形成原电池时Zn作负极,A、C均错误;使用盐桥,形成双液原电池时,为得到稳定电流,正极、负极半电池中电解质溶液一般是电极金属材料形成的盐溶液,D错误,B正确。
4.D 由于金属活动性:Zn>Cu,所以活动性强的Zn为负极,活动性弱的Cu为正极,A错误;粗铜精炼时,粗铜应该连接电源正极,作阳极,精铜应该连接电源的负极,作阴极,B错误;要在铁片上镀锌,镀件铁片应该连接电源的负极作阴极,镀层金属Zn应该连接电源的正极作阳极,含有镀层金属Zn2+的溶液如ZnCl2溶液为电解质溶液,C错误;电解饱和NaCl溶液,要验证电解产物,应该铁棒连接电源的负极作阴极,石墨棒连接的正极作阳极,用淀粉KI溶液检验阳极产生的Cl2,用酚酞溶液检验阴极产生的NaOH溶液,D正确。
5.B 由图中OH-的移动方向可知,泡沫铜是阳极,与直流电源的正极相连,A正确;阴极反应式为2H2O+2e-2OH-+H2↑,阳极反应式为2RCHO+4OH--2e-2RCOO-+H2↑+2H2O,转移2 mol电子时两极上共生成2 mol H2,B错误,D正确;铜是活性电极,高压电可能使Cu放电生成Cu2+,引起催化剂失活,C正确。
6.A A项,铁锅中含有的Fe、C和电解质溶液构成原电池,活泼金属作负极,Fe易失电子,故腐蚀过程中,负极是Fe,正确;B项,电子不能在电解质溶液中移动,在电解质溶液中依靠离子的移动导电,错误;C项,该原电池中,C作正极,正极上氧气得电子发生还原反应,电极反应为O2+2H2O+4e-4OH-,错误;D项,C是正极,O2在C表面上发生还原反应,错误。
7.C 石墨烯为阴极,交换膜为质子交换膜,阴极电极反应为CO2+2H++2e-HCOOH,A错误;根据电解原理,H+应从左向右移动,B错误;转移2 mol电子,有44 g CO2参加反应,同时有2 mol H+从阳极移向阴极,阴极室电解质溶液质量增加44 g+2 g=46 g,C正确;阳极电极反应为2H2O-4e-O2↑+4H+,溶剂水减少,c(H+)增大,pH减小,D错误。
8.A 电解含硫酸铵的废水可制备硫酸和化肥,则N通过阳膜移向N室,所以右边石墨电极为阴极,左边石墨电极为阳极,则a极为电源的正极,A错误,B正确;电解过程中原料室溶液中N通过阳膜移向N室,S通过阴膜移向M室,原料室中(NH4)2SO4浓度降低,则溶液的pH升高,C正确;左边M室中水电离产生的OH-发生氧化反应,M室电极反应式为2H2O-4e-O2↑+4H+,D正确。
9.【答案】(1)HCOO-+2OH--2e-HC+H2O H2SO4
(2)2HCOOH+2OH-+O22HC+2H2O或2HCOO-+O22HC
【解析】(1)该装置为原电池,负极失去电子,HCOO-中的C元素为+2价,转化为HC中的C元素为+4价,化合价升高失去电子,则1 mol HCOO-转化为1 mol HC ,转移2 mol e-,电解质为KOH,故用OH-平衡电荷。正极处为Fe3+得电子生成Fe2+,Fe2+又被O2氧化生成Fe3+,此反应为酸性条件,若为碱性条件,则生成Fe(OH)3,据装置中右侧流出K2SO4,K+从负极区经半透膜移向正极区,则物质A应为H2SO4,发生反应:4Fe2++O2+4H+4Fe3++2H2O。(2)HCOOH被O2氧化生成HC ,根据C、O得失电子守恒配平反应,用OH-平衡电荷。
10.【答案】(1)①Fe N+8e-+10H+N+3H2O
②pH越大,Fe3+越易水解成FeO(OH),FeO(OH)不导电,阻碍电子转移
(2)①O2+2H2O+4e-4OH-
②既可防止两种电解液混合,又可防止水和氧气等和负极的金属锂发生反应 ③可防止正极的碳孔堵塞
【解析】 (1)①根据题图可知,Fe失电子,使N被还原为N,故Fe作负极,结合电荷守恒和元素守恒写出正极的电极反应式:N+8e-+10H+N+3H2O。②pH越大,Fe3+越容易水解生成不导电的FeO(OH),阻碍反应进行,所以N去除率低。(2)③该电池正极若使用非水性电解液,则生成的是固体氧化锂(Li2O),而使用水性电解液时,生成的氢氧化锂(LiOH)溶于水,这样就不会引起空气极的碳孔堵塞。
时间:35分钟 总分:50分
单项选择题(每小题3分,共24分。每小题只有一个选项符合题目要求)
1.(2024 凉州区开学)钢铁锈蚀会造成金属资源的浪费及引发安全事故,下列铁制品的防锈原理与其他三项不同的是( )
用不锈钢制餐具 B.自行车链条涂油
C.水龙头表面镀铬 D.给金属栏杆刷漆
2.(2024春 丰台区期中)图是使LED灯发光的化学电源。下列说法不正确的是( )
A.负极发生氧化反应:Zn-2e-═Zn2+
B.氢离子移向铜片,铜片表面有气泡生成
C.溶液中有电子移向锌片
D.如果将锌片换成铁片,电路中的电流方向不变
3.根据化学反应设计原电池(选用相同的盐桥)时,下列各项中合理的是 ( )
选项 正极(金属/电解质溶液) 负极(金属/电解质溶液)
A Zn/ZnSO4溶液 Fe/稀H2SO4溶液
B Fe/FeCl2溶液 Zn/ZnSO4溶液
C Zn/稀H2SO4溶液 Fe/FeCl2溶液
D Fe/ZnSO4溶液 Zn/FeCl2溶液
4.下列有关电化学的图示,完全正确的是 ( )
A B
C D
5.(2023河北邯郸十校联考)我国科学家开发出一种双极制氢系统,在低电池电压下的KOH介质中,可将醛类物质电催化转化为相应的羧酸盐和氢气,其工作原理如图所示。下列说法不正确的是( )
A.泡沫铜与直流电源的正极相连
B.制得1 mol氢气,理论上外电路中迁移了2 mol电子
C.高电压下不能实现双极制氢的原因可能是Cu被氧化从而使催化剂失活
D.泡沫铜电极上发生的反应可能为2RCHO+4OH--2e-2RCOO-+H2↑+2H2O
6.炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图K22-11所示,下列说法正确的是 ( )
图K22-11
A.腐蚀过程中,负极是Fe
B.Fe失去的电子经电解质溶液转移给C
C.正极的电极反应式为4OH--4e-2H2O+O2↑
D.C是正极,O2在C表面上发生氧化反应
7.(2023安徽“皖南八校”联考)利用铜配合物10-phenanthroline-Cu作催化剂电催化可还原CO2制备碳基燃料(包括CO、烷烃和羧酸等),其装置原理如图所示。下列说法正确的是( )
A.石墨烯为阴极,电极反应式为CO2+2H2O+2e-HCOOH+2OH-
B.该装置工作时,H+穿过质子交换膜从右向左移动
C.每转移2 mol电子,阴极室电解质溶液质量增加46 g
D.该装置工作一段时间后,阳极室电解质溶液pH不变
8.电解含硫酸铵的废水可制备硫酸和化肥,电解装置如图。下列说法错误的是( )
A.a极为电源的负极
B.N通过阳膜移向N室
C.电解过程中原料室溶液pH升高
D.M室电极反应为2H2O-4e-O2↑+4H+
二、非选择题(共26分)
9.(6分)CO2/HCOOH循环在氢能的储存、释放、燃料电池等方面具有重要应用。研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
(1)电池负极电极反应为 ;放电过程中需补充的物质A为 (填化学式)。
(2)如图所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为 。
10.(20分)(1)用零价铁(Fe)去除水体中的硝酸盐(N)已成为环境修复研究的热点之一。
①Fe还原水体中N的反应原理如图所示。
作负极的物质是 ,正极的电极反应是 。
②将足量铁粉投入水体中,经24小时测定N的去除率和pH,结果如下:
初始pH 2.5 4.5
N的去除率 接近100% <50%
24小时pH 接近中性 接近中性
铁的最终 物质形态
初始pH=4.5时,N的去除率低,其原因是 。
(2)锂空气电池比锂离子电池具有更高的能量密度,因为其正极(以多孔碳为主)很轻,且氧气从环境中获取而不用保存在电池里。其工作原理如图所示,电池总反应为4Li+O2+2H2O4LiOH。
请回答下列问题:
①该电池的正极反应是 。
②在负极的有机电解液和正极的水性电解液之间,用只能通过锂离子的固体电解质隔开,使用该固体电解质的优点有 。
③正极使用水性电解液的优点是 。
第12周 参考答案
1.A 不锈钢为铁合金,将铁制成合金可达到防腐的目的,故A正确;自行车链条涂油,该防锈原理为隔绝空气从而防锈,故B错误;水龙头表面镀铬,该防锈原理为隔绝空气从而防锈,故C错误;给金属栏杆刷漆,该防锈原理为隔绝空气从而防锈,故D错误。
2.C 铜锌原电池中锌为负极,Zn发生失去电子的氧化反应生成Zn2+,负极反应式为Zn-2e-═Zn2+,故A正确;铜锌原电池中锌为负极,铜为正极,氢离子移向正极铜片,并在铜片表面得电子生成氢气,所以铜片表面有气泡生成,故B正确;电子不能进入溶液中,故C错误;锌、铁均比铜活泼,如果将锌片换成铁片,铁片作负极,铜片作正极,电路中的电流方向不变,故D正确。
3.B 原电池中,负极金属的活动性一般强于正极金属,Zn比Fe活泼,形成原电池时Zn作负极,A、C均错误;使用盐桥,形成双液原电池时,为得到稳定电流,正极、负极半电池中电解质溶液一般是电极金属材料形成的盐溶液,D错误,B正确。
4.D 由于金属活动性:Zn>Cu,所以活动性强的Zn为负极,活动性弱的Cu为正极,A错误;粗铜精炼时,粗铜应该连接电源正极,作阳极,精铜应该连接电源的负极,作阴极,B错误;要在铁片上镀锌,镀件铁片应该连接电源的负极作阴极,镀层金属Zn应该连接电源的正极作阳极,含有镀层金属Zn2+的溶液如ZnCl2溶液为电解质溶液,C错误;电解饱和NaCl溶液,要验证电解产物,应该铁棒连接电源的负极作阴极,石墨棒连接的正极作阳极,用淀粉KI溶液检验阳极产生的Cl2,用酚酞溶液检验阴极产生的NaOH溶液,D正确。
5.B 由图中OH-的移动方向可知,泡沫铜是阳极,与直流电源的正极相连,A正确;阴极反应式为2H2O+2e-2OH-+H2↑,阳极反应式为2RCHO+4OH--2e-2RCOO-+H2↑+2H2O,转移2 mol电子时两极上共生成2 mol H2,B错误,D正确;铜是活性电极,高压电可能使Cu放电生成Cu2+,引起催化剂失活,C正确。
6.A A项,铁锅中含有的Fe、C和电解质溶液构成原电池,活泼金属作负极,Fe易失电子,故腐蚀过程中,负极是Fe,正确;B项,电子不能在电解质溶液中移动,在电解质溶液中依靠离子的移动导电,错误;C项,该原电池中,C作正极,正极上氧气得电子发生还原反应,电极反应为O2+2H2O+4e-4OH-,错误;D项,C是正极,O2在C表面上发生还原反应,错误。
7.C 石墨烯为阴极,交换膜为质子交换膜,阴极电极反应为CO2+2H++2e-HCOOH,A错误;根据电解原理,H+应从左向右移动,B错误;转移2 mol电子,有44 g CO2参加反应,同时有2 mol H+从阳极移向阴极,阴极室电解质溶液质量增加44 g+2 g=46 g,C正确;阳极电极反应为2H2O-4e-O2↑+4H+,溶剂水减少,c(H+)增大,pH减小,D错误。
8.A 电解含硫酸铵的废水可制备硫酸和化肥,则N通过阳膜移向N室,所以右边石墨电极为阴极,左边石墨电极为阳极,则a极为电源的正极,A错误,B正确;电解过程中原料室溶液中N通过阳膜移向N室,S通过阴膜移向M室,原料室中(NH4)2SO4浓度降低,则溶液的pH升高,C正确;左边M室中水电离产生的OH-发生氧化反应,M室电极反应式为2H2O-4e-O2↑+4H+,D正确。
9.【答案】(1)HCOO-+2OH--2e-HC+H2O H2SO4
(2)2HCOOH+2OH-+O22HC+2H2O或2HCOO-+O22HC
【解析】(1)该装置为原电池,负极失去电子,HCOO-中的C元素为+2价,转化为HC中的C元素为+4价,化合价升高失去电子,则1 mol HCOO-转化为1 mol HC ,转移2 mol e-,电解质为KOH,故用OH-平衡电荷。正极处为Fe3+得电子生成Fe2+,Fe2+又被O2氧化生成Fe3+,此反应为酸性条件,若为碱性条件,则生成Fe(OH)3,据装置中右侧流出K2SO4,K+从负极区经半透膜移向正极区,则物质A应为H2SO4,发生反应:4Fe2++O2+4H+4Fe3++2H2O。(2)HCOOH被O2氧化生成HC ,根据C、O得失电子守恒配平反应,用OH-平衡电荷。
10.【答案】(1)①Fe N+8e-+10H+N+3H2O
②pH越大,Fe3+越易水解成FeO(OH),FeO(OH)不导电,阻碍电子转移
(2)①O2+2H2O+4e-4OH-
②既可防止两种电解液混合,又可防止水和氧气等和负极的金属锂发生反应 ③可防止正极的碳孔堵塞
【解析】 (1)①根据题图可知,Fe失电子,使N被还原为N,故Fe作负极,结合电荷守恒和元素守恒写出正极的电极反应式:N+8e-+10H+N+3H2O。②pH越大,Fe3+越容易水解生成不导电的FeO(OH),阻碍反应进行,所以N去除率低。(2)③该电池正极若使用非水性电解液,则生成的是固体氧化锂(Li2O),而使用水性电解液时,生成的氢氧化锂(LiOH)溶于水,这样就不会引起空气极的碳孔堵塞。
同课章节目录
