福建省厦门市2024-2025学年高一下学期期末质量检测化学试卷(含答案)
文档属性
| 名称 | 福建省厦门市2024-2025学年高一下学期期末质量检测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 21:07:13 | ||
图片预览



文档简介
福建省厦门市2024-2025学年高一下学期7月期末化学试题
满分:100分 考试时间:75分钟
注意事项:
1.考生将自己的姓名、准考证号、答案填写在答题卡上。考试结束后,须将“答题卡”交回。
2.答题要求见答题卡上的“填涂样例”和“注意事项”。
3.可能用到的相对原子质量:H 1 C N 14 O 16 Si 28 Cl 35.5
一、选择题:本题共10小题,每小题4分,共40分。每小题只有一个选项符合题目要求。
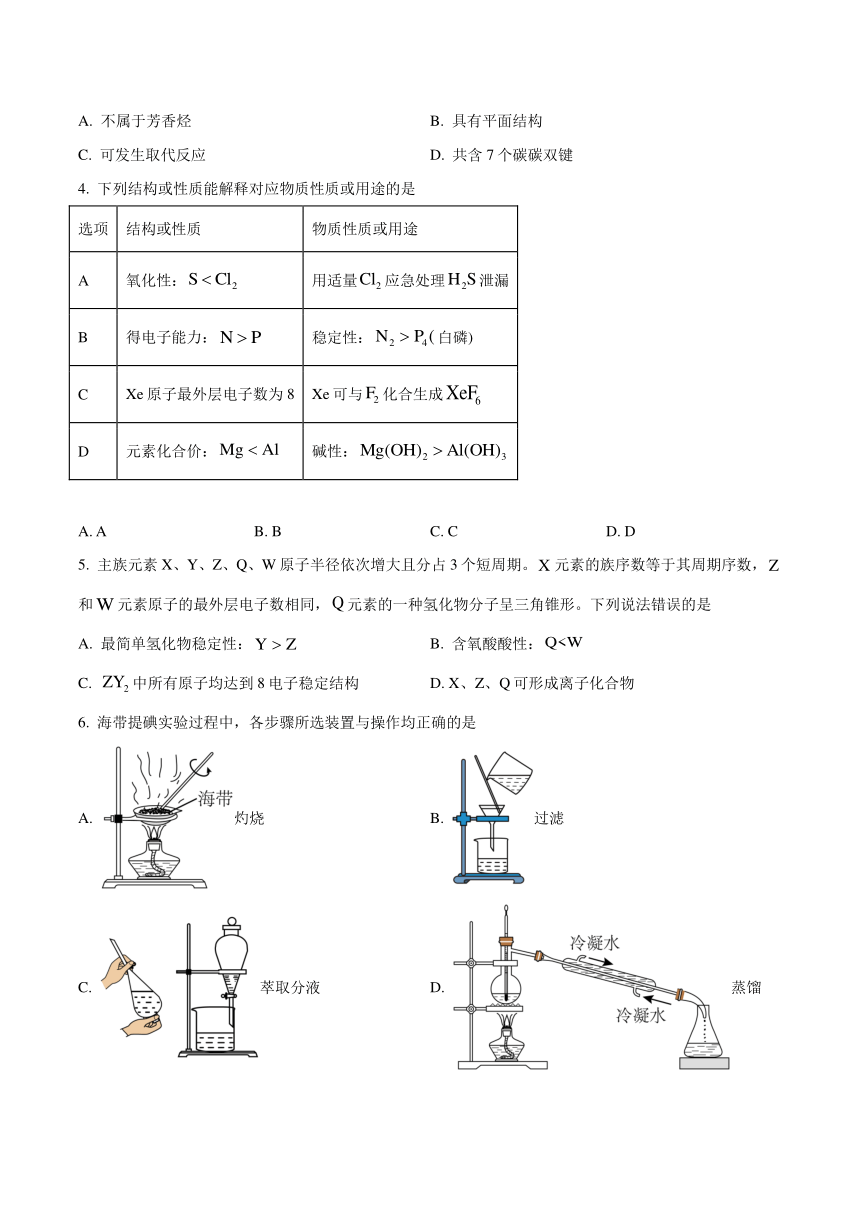
1. 某健康奶茶含有蛋白质、果葡糖浆、油脂、等。下列说法正确的是
A. 蛋白质水解能得到氨基酸 B. 果糖、葡萄糖可以水解
C. 油脂属于天然高分子 D. 属于有机物
2. 一种烘焙发酵的原理为。下列化学用语正确的是
A. 溶液中水合钠离子示意图:
B. 的球棍模型:
C. 中原子结构示意图:
D. 的电子式:
3. 我国科学家制备出与苯分子具有相似结构的以金属为中心的金属[15]轮烯(如图)。下列有关该物质说法错误的是
A. 不属于芳香烃 B. 具有平面结构
C. 可发生取代反应 D. 共含7个碳碳双键
4. 下列结构或性质能解释对应物质性质或用途的是
选项 结构或性质 物质性质或用途
A 氧化性: 用适量应急处理泄漏
B 得电子能力: 稳定性:白磷)
C Xe原子最外层电子数为8 Xe可与化合生成
D 元素化合价: 碱性:
A. A B. B C. C D. D
5. 主族元素X、Y、Z、Q、W原子半径依次增大且分占3个短周期。元素的族序数等于其周期序数,和元素原子的最外层电子数相同,元素的一种氢化物分子呈三角锥形。下列说法错误的是
A. 最简单氢化物稳定性: B. 含氧酸酸性:
C. 中所有原子均达到8电子稳定结构 D. X、Z、Q可形成离子化合物
6. 海带提碘实验过程中,各步骤所选装置与操作均正确的是
A. 灼烧 B. 过滤
C. 萃取分液 D. 蒸馏
7. “北斗系统芯片”的主要成分是高纯硅,其制备流程如图,其中中H为-1价。设为阿伏加德罗常数的值。下列说法正确的是
A. 反应①生成的气体,每4.48L(折合成标准状况)含原子的数目为
B. 反应②中2.8gSi完全转化生成的产物中,含共价键数目为
C. 含有的质子数和中子数均为
D. 反应③中与足量反应,转移电子的数目为2
8. 用不锈钢酸洗污泥(主要含)生产的工业流程如下:
已知:与性质相似。下列说法正确的是
A. 滤渣1为SiO2 B. 除杂的目的是除去元素
C. 滤渣3为 D. 若用NaOH替换效果更好
9. 利用铝-空气电池驱动风扇的工作原理如图。下列说法正确的是
A. 风扇转动时,电流从a极流向b极
B. 电池工作时b极附近的pH不断上升
C. a极的电极反应式为
D. 每转移0.6 mol电子,消耗空气3.36 L(折合成标准状况)
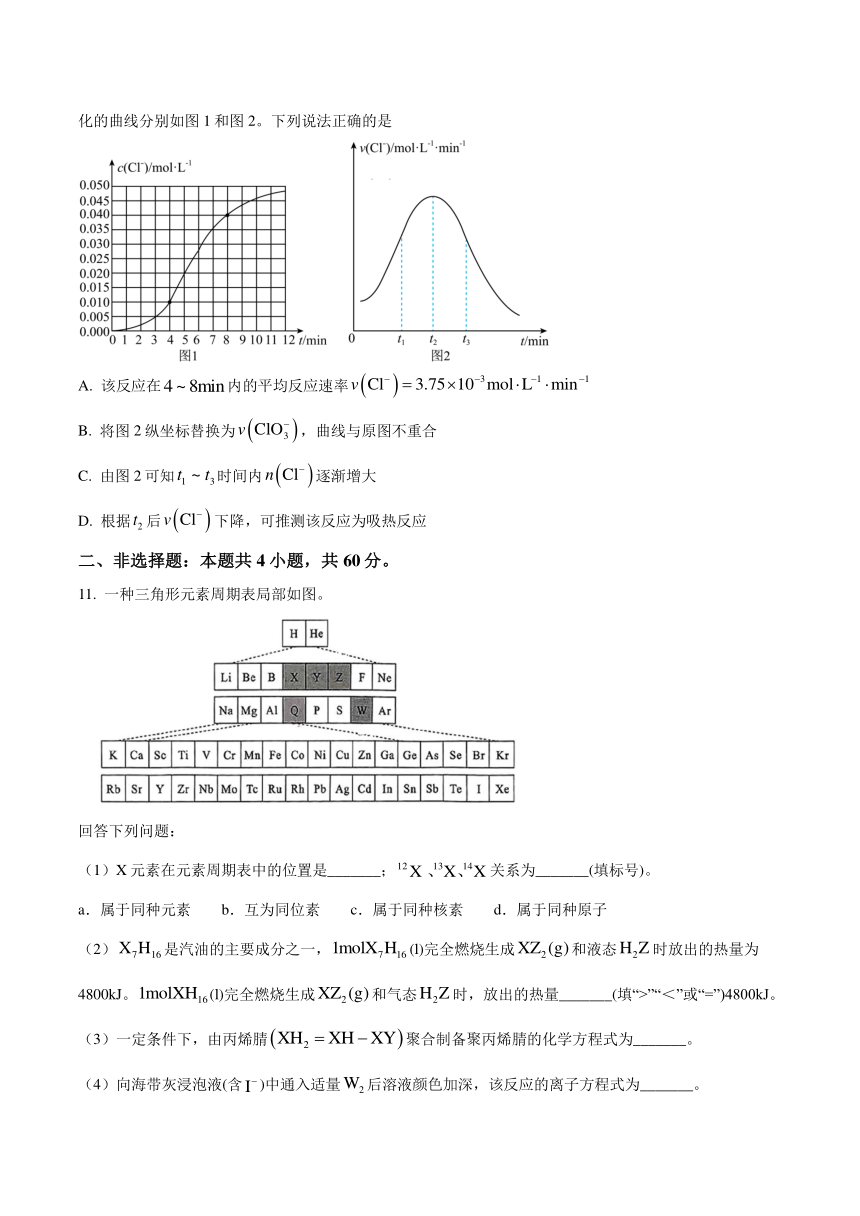
10. 某化学小组欲测定酸性条件下:溶液与溶液反应的化学反应速率,实验试剂为溶液和溶液,所得溶液中和随时间变化的曲线分别如图1和图2。下列说法正确的是
A. 该反应在内的平均反应速率
B. 将图2纵坐标替换为,曲线与原图不重合
C. 由图2可知时间内逐渐增大
D. 根据后下降,可推测该反应为吸热反应
二、非选择题:本题共4小题,共60分。
11. 一种三角形元素周期表局部如图。
回答下列问题:
(1)X元素在元素周期表中的位置是_______;关系为_______(填标号)。
a.属于同种元素 b.互为同位素 c.属于同种核素 d.属于同种原子
(2)是汽油的主要成分之一,(l)完全燃烧生成和液态时放出的热量为4800kJ。(l)完全燃烧生成和气态时,放出的热量_______(填“>”“<”或“=”)4800kJ。
(3)一定条件下,由丙烯腈聚合制备聚丙烯腈的化学方程式为_______。
(4)向海带灰浸泡液(含)中通入适量后溶液颜色加深,该反应的离子方程式为_______。
(5)与在一定条件下反应生成液态清洁燃料甲醇和的化学方程式为_______。
(6)元素最简单氢化物的化学式为_______,以该氢化物代替与合成甲醇可大大降低反应所需温度。已知原子半径越大键能越小,从化学键角度解释其原因_______。
12. 一种利用化学—生物酶级联反应合成高苯丙氨酸()的路线如下。
回答下列问题:
(1)A属于_______(填“烃”或“烃的衍生物”)。
(2)①B中苯环上的一氯代物有_______种。
②1molB与足量Na反应,可生成的体积为_______L(折合成标准状况)。
(3)在一定条件下,ii中物质和能量变化如图。
①上图表示的反应_______(填“吸收”或“放出”)的能量为_______kJ。
②反应一段时间后,存在于B、_______(填“C”或“”)中。
③用溴的四氯化碳溶液可鉴别B和C,相关的化学方程式为_______,反应类型为_______。
(4)下列关于过程iii说法正确的是_______(填标号)。
a.升高温度一定能加快反应速率
b.酶可以提高反应的限度
c.反应体系中D的浓度恒定时,说明该反应已达平衡
d.减小体系中D的浓度,可以加快反应速率
(5)iv中“”可设计为燃料电池,工作原理如图。
①正极的电极反应式为_______。
②的移动方向为_______(填“”或“”)。
③理论上每生成,消耗的体积为_______L(折合成标准状况)。
13. 利用沾有油污废铁屑和含有难溶于水的海藻酸盐(MgA2、CaA2)的海带为原料协同制备具有吸水性的催化剂海藻酸铁(FeA3)凝胶球的流程如下。
回答下列问题:
(1)“碱洗”的目的为_______。
(2)“氧化”中可选择的试剂X为_______(填标号,选一种即可),该反应的离子方程式_______。结合工业实际说明选择的理由_______。
a.H2O2 b.Cl2 c.HNO3
(3)若略去“钙析脱钙溶解”步骤,NaA纯度______(填“偏大”“偏小”或“不变”)
(4)FeCl3溶液与NaA反应的化学方程式为_______。
(5)为循环利用“滤液3”中的乙醇,应采用的操作名称为_______。
(6)用上述流程制得的无水FeCl3和海藻酸铁(FeA3)凝胶球为催化剂分别制备乙酸乙酯并探究催化效果,实验装置如图。
①以FeA3为催化剂制备乙酸乙酯化学方程式为_______。
②仪器Y的名称为_______,其作用有_______。
③其他条件均相同时,测得实验数据如下表。
实验编号 催化剂 乙醇/mL 乙酸/mL 乙酸乙酯/g 产率/%
1 FeA3 3.0 1.5 1.76 76.9
2 FeCl3 3.0 1.5 1.61 70.6
FeA3作催化剂产率更高的原因为_______。
14. 牛仔面料的染料靛蓝(R)难溶于水,在碱性条件下用Na2S2O4对其进行还原,使其在水中的溶解性增强后渗透附着于待染布料上,再氧化复色,过程如下。
已知:①pH越大靛蓝(R)溶解性越大。
②温度越高Na2S2O4分解率越大。
某学习小组探究染料靛蓝的还原过程和在布料上的渗透附着效果,回答下列问题:
(1)染料靛蓝中:溶解性H2R>R,这与H2R中所含的_______官能团有关。
(2)待染布料中的纤维素在NaOH作用下会被“离子化”,转化示意如图:+nNaOH +nH2O
该转化过程中形成的化学键类型有_______。
(3)在足量Na2S2O4作用下,的分布系数δ[比如:分布系数]及待染布料中离子化的纤维索含量与染液pH的关系分别如图1和图2。
影响待染布料染色效果的主要因素如下:
i.染料中的靛蓝(R)溶解性越大,越有利于染料的渗透。
ii.待染布料中离子化纤维素含量越大,越不利于染色。
①布料染色效果最佳时,应选择的pH为_______,分析其理由_______。
②将“调配最佳染液”过程中发生反应的离子方程式补充完整:_______。
□R+□+□=□_______=□_______+□+□H2O
(4)为探究温度对靛蓝(R)还原反应速率的影响,设计实验测定靛蓝(R)由蓝色褪为黄绿色的时间,数据如下。
实验编号 温度/℃ 褪色时间/s
1 x y 25 t1
2 x y T t2
①实验1中,t1 s时,染液中的c(Na2S2O4)=z mol/L,该反应在0-t1 s内的平均反应速率v(Na2S2O4)=_______。(用含y、z和t1的代数式表示)
②实验2中,若T>25℃,则t1_______t2(填“>”“<”“=”或“不能确定”),说明理由_______。
福建省厦门市2024-2025学年高一下学期7月期末化学试题
满分:100分 考试时间:75分钟
注意事项:
1.考生将自己的姓名、准考证号、答案填写在答题卡上。考试结束后,须将“答题卡”交回。
2.答题要求见答题卡上的“填涂样例”和“注意事项”。
3.可能用到的相对原子质量:H 1 C N 14 O 16 Si 28 Cl 35.5
一、选择题:本题共10小题,每小题4分,共40分。每小题只有一个选项符合题目要求。
【1题答案】
【答案】A
【2题答案】
【答案】B
【3题答案】
【答案】D
【4题答案】
【答案】A
【5题答案】
【答案】B
【6题答案】
【答案】C
【7题答案】
【答案】C
【8题答案】
【答案】C
【9题答案】
【答案】B
【10题答案】
【答案】C
二、非选择题:本题共4小题,共60分。
【11题答案】
【答案】(1) ①. 第2周期IVA族 ②. ab
(2)< (3)nCH2=CH-CN
(4)Cl2+2I-=2Cl-+I2
(5)CO2+3H2CH3OH+H2O
(6) ①. SiH4 ②. 原子半径:Si>H,键能:Si-H<H-H,用SiH4代替H2反应断键所需的能量更小,可降低反应温度
【12题答案】
【答案】(1)烃的衍生物
(2) ①. 3 ②. 22.4
(3) ①. 吸收 ②. ③. H2O ④. + ⑤. 加成反应
(4)c (5) ①. ②. a→b ③. 11.2
【13题答案】
【答案】(1)去除铁屑表面的油污
(2) ①. a(或b) ②. H2O2+2H++2Fe2+=2Fe3++2H2O (或2Fe2++Cl2=2Fe3++2Cl-) ③. H2O2作氧化剂还原产物是H2O无污染;使用Cl2有毒会污染;若用HNO3产物中会引入且产生NOx污染(或无副产物;若用H2O2会被Fe3+催化分解而损耗;若用HNO3产物中会引入且产生NOx污染)
(3)偏小 (4)FeCl3+3NaA=FeA3↓+3NaCl
(5)蒸馏 (6) ①. ②. 球形干燥管 ③. 冷凝和防倒吸 ④. FeCl3只作催化剂;FeA3既作催化剂加快反应速率,又作吸水剂利于酯化反应正向进行
【14题答案】
【答案】(1)羟基(或-OH)
(2)离子键、(极性)共价键
(3) ①. 11 ②. pH越大,R溶解性越大,越有利于染料的渗透;但pH>11后纤维素开始离子化,不利于染色 ③. 3R++5OH-=3HR-+2+H2O
(4) ①. ②. 不能确定 ③. 因为温度升高使靛蓝还原速率加快的同时Na2S2O4分解使靛蓝还原速率减慢。在温度较低时以前者的影响为主,而温度较高时以后者的影响为主
满分:100分 考试时间:75分钟
注意事项:
1.考生将自己的姓名、准考证号、答案填写在答题卡上。考试结束后,须将“答题卡”交回。
2.答题要求见答题卡上的“填涂样例”和“注意事项”。
3.可能用到的相对原子质量:H 1 C N 14 O 16 Si 28 Cl 35.5
一、选择题:本题共10小题,每小题4分,共40分。每小题只有一个选项符合题目要求。
1. 某健康奶茶含有蛋白质、果葡糖浆、油脂、等。下列说法正确的是
A. 蛋白质水解能得到氨基酸 B. 果糖、葡萄糖可以水解
C. 油脂属于天然高分子 D. 属于有机物
2. 一种烘焙发酵的原理为。下列化学用语正确的是
A. 溶液中水合钠离子示意图:
B. 的球棍模型:
C. 中原子结构示意图:
D. 的电子式:
3. 我国科学家制备出与苯分子具有相似结构的以金属为中心的金属[15]轮烯(如图)。下列有关该物质说法错误的是
A. 不属于芳香烃 B. 具有平面结构
C. 可发生取代反应 D. 共含7个碳碳双键
4. 下列结构或性质能解释对应物质性质或用途的是
选项 结构或性质 物质性质或用途
A 氧化性: 用适量应急处理泄漏
B 得电子能力: 稳定性:白磷)
C Xe原子最外层电子数为8 Xe可与化合生成
D 元素化合价: 碱性:
A. A B. B C. C D. D
5. 主族元素X、Y、Z、Q、W原子半径依次增大且分占3个短周期。元素的族序数等于其周期序数,和元素原子的最外层电子数相同,元素的一种氢化物分子呈三角锥形。下列说法错误的是
A. 最简单氢化物稳定性: B. 含氧酸酸性:
C. 中所有原子均达到8电子稳定结构 D. X、Z、Q可形成离子化合物
6. 海带提碘实验过程中,各步骤所选装置与操作均正确的是
A. 灼烧 B. 过滤
C. 萃取分液 D. 蒸馏
7. “北斗系统芯片”的主要成分是高纯硅,其制备流程如图,其中中H为-1价。设为阿伏加德罗常数的值。下列说法正确的是
A. 反应①生成的气体,每4.48L(折合成标准状况)含原子的数目为
B. 反应②中2.8gSi完全转化生成的产物中,含共价键数目为
C. 含有的质子数和中子数均为
D. 反应③中与足量反应,转移电子的数目为2
8. 用不锈钢酸洗污泥(主要含)生产的工业流程如下:
已知:与性质相似。下列说法正确的是
A. 滤渣1为SiO2 B. 除杂的目的是除去元素
C. 滤渣3为 D. 若用NaOH替换效果更好
9. 利用铝-空气电池驱动风扇的工作原理如图。下列说法正确的是
A. 风扇转动时,电流从a极流向b极
B. 电池工作时b极附近的pH不断上升
C. a极的电极反应式为
D. 每转移0.6 mol电子,消耗空气3.36 L(折合成标准状况)
10. 某化学小组欲测定酸性条件下:溶液与溶液反应的化学反应速率,实验试剂为溶液和溶液,所得溶液中和随时间变化的曲线分别如图1和图2。下列说法正确的是
A. 该反应在内的平均反应速率
B. 将图2纵坐标替换为,曲线与原图不重合
C. 由图2可知时间内逐渐增大
D. 根据后下降,可推测该反应为吸热反应
二、非选择题:本题共4小题,共60分。
11. 一种三角形元素周期表局部如图。
回答下列问题:
(1)X元素在元素周期表中的位置是_______;关系为_______(填标号)。
a.属于同种元素 b.互为同位素 c.属于同种核素 d.属于同种原子
(2)是汽油的主要成分之一,(l)完全燃烧生成和液态时放出的热量为4800kJ。(l)完全燃烧生成和气态时,放出的热量_______(填“>”“<”或“=”)4800kJ。
(3)一定条件下,由丙烯腈聚合制备聚丙烯腈的化学方程式为_______。
(4)向海带灰浸泡液(含)中通入适量后溶液颜色加深,该反应的离子方程式为_______。
(5)与在一定条件下反应生成液态清洁燃料甲醇和的化学方程式为_______。
(6)元素最简单氢化物的化学式为_______,以该氢化物代替与合成甲醇可大大降低反应所需温度。已知原子半径越大键能越小,从化学键角度解释其原因_______。
12. 一种利用化学—生物酶级联反应合成高苯丙氨酸()的路线如下。
回答下列问题:
(1)A属于_______(填“烃”或“烃的衍生物”)。
(2)①B中苯环上的一氯代物有_______种。
②1molB与足量Na反应,可生成的体积为_______L(折合成标准状况)。
(3)在一定条件下,ii中物质和能量变化如图。
①上图表示的反应_______(填“吸收”或“放出”)的能量为_______kJ。
②反应一段时间后,存在于B、_______(填“C”或“”)中。
③用溴的四氯化碳溶液可鉴别B和C,相关的化学方程式为_______,反应类型为_______。
(4)下列关于过程iii说法正确的是_______(填标号)。
a.升高温度一定能加快反应速率
b.酶可以提高反应的限度
c.反应体系中D的浓度恒定时,说明该反应已达平衡
d.减小体系中D的浓度,可以加快反应速率
(5)iv中“”可设计为燃料电池,工作原理如图。
①正极的电极反应式为_______。
②的移动方向为_______(填“”或“”)。
③理论上每生成,消耗的体积为_______L(折合成标准状况)。
13. 利用沾有油污废铁屑和含有难溶于水的海藻酸盐(MgA2、CaA2)的海带为原料协同制备具有吸水性的催化剂海藻酸铁(FeA3)凝胶球的流程如下。
回答下列问题:
(1)“碱洗”的目的为_______。
(2)“氧化”中可选择的试剂X为_______(填标号,选一种即可),该反应的离子方程式_______。结合工业实际说明选择的理由_______。
a.H2O2 b.Cl2 c.HNO3
(3)若略去“钙析脱钙溶解”步骤,NaA纯度______(填“偏大”“偏小”或“不变”)
(4)FeCl3溶液与NaA反应的化学方程式为_______。
(5)为循环利用“滤液3”中的乙醇,应采用的操作名称为_______。
(6)用上述流程制得的无水FeCl3和海藻酸铁(FeA3)凝胶球为催化剂分别制备乙酸乙酯并探究催化效果,实验装置如图。
①以FeA3为催化剂制备乙酸乙酯化学方程式为_______。
②仪器Y的名称为_______,其作用有_______。
③其他条件均相同时,测得实验数据如下表。
实验编号 催化剂 乙醇/mL 乙酸/mL 乙酸乙酯/g 产率/%
1 FeA3 3.0 1.5 1.76 76.9
2 FeCl3 3.0 1.5 1.61 70.6
FeA3作催化剂产率更高的原因为_______。
14. 牛仔面料的染料靛蓝(R)难溶于水,在碱性条件下用Na2S2O4对其进行还原,使其在水中的溶解性增强后渗透附着于待染布料上,再氧化复色,过程如下。
已知:①pH越大靛蓝(R)溶解性越大。
②温度越高Na2S2O4分解率越大。
某学习小组探究染料靛蓝的还原过程和在布料上的渗透附着效果,回答下列问题:
(1)染料靛蓝中:溶解性H2R>R,这与H2R中所含的_______官能团有关。
(2)待染布料中的纤维素在NaOH作用下会被“离子化”,转化示意如图:+nNaOH +nH2O
该转化过程中形成的化学键类型有_______。
(3)在足量Na2S2O4作用下,的分布系数δ[比如:分布系数]及待染布料中离子化的纤维索含量与染液pH的关系分别如图1和图2。
影响待染布料染色效果的主要因素如下:
i.染料中的靛蓝(R)溶解性越大,越有利于染料的渗透。
ii.待染布料中离子化纤维素含量越大,越不利于染色。
①布料染色效果最佳时,应选择的pH为_______,分析其理由_______。
②将“调配最佳染液”过程中发生反应的离子方程式补充完整:_______。
□R+□+□=□_______=□_______+□+□H2O
(4)为探究温度对靛蓝(R)还原反应速率的影响,设计实验测定靛蓝(R)由蓝色褪为黄绿色的时间,数据如下。
实验编号 温度/℃ 褪色时间/s
1 x y 25 t1
2 x y T t2
①实验1中,t1 s时,染液中的c(Na2S2O4)=z mol/L,该反应在0-t1 s内的平均反应速率v(Na2S2O4)=_______。(用含y、z和t1的代数式表示)
②实验2中,若T>25℃,则t1_______t2(填“>”“<”“=”或“不能确定”),说明理由_______。
福建省厦门市2024-2025学年高一下学期7月期末化学试题
满分:100分 考试时间:75分钟
注意事项:
1.考生将自己的姓名、准考证号、答案填写在答题卡上。考试结束后,须将“答题卡”交回。
2.答题要求见答题卡上的“填涂样例”和“注意事项”。
3.可能用到的相对原子质量:H 1 C N 14 O 16 Si 28 Cl 35.5
一、选择题:本题共10小题,每小题4分,共40分。每小题只有一个选项符合题目要求。
【1题答案】
【答案】A
【2题答案】
【答案】B
【3题答案】
【答案】D
【4题答案】
【答案】A
【5题答案】
【答案】B
【6题答案】
【答案】C
【7题答案】
【答案】C
【8题答案】
【答案】C
【9题答案】
【答案】B
【10题答案】
【答案】C
二、非选择题:本题共4小题,共60分。
【11题答案】
【答案】(1) ①. 第2周期IVA族 ②. ab
(2)< (3)nCH2=CH-CN
(4)Cl2+2I-=2Cl-+I2
(5)CO2+3H2CH3OH+H2O
(6) ①. SiH4 ②. 原子半径:Si>H,键能:Si-H<H-H,用SiH4代替H2反应断键所需的能量更小,可降低反应温度
【12题答案】
【答案】(1)烃的衍生物
(2) ①. 3 ②. 22.4
(3) ①. 吸收 ②. ③. H2O ④. + ⑤. 加成反应
(4)c (5) ①. ②. a→b ③. 11.2
【13题答案】
【答案】(1)去除铁屑表面的油污
(2) ①. a(或b) ②. H2O2+2H++2Fe2+=2Fe3++2H2O (或2Fe2++Cl2=2Fe3++2Cl-) ③. H2O2作氧化剂还原产物是H2O无污染;使用Cl2有毒会污染;若用HNO3产物中会引入且产生NOx污染(或无副产物;若用H2O2会被Fe3+催化分解而损耗;若用HNO3产物中会引入且产生NOx污染)
(3)偏小 (4)FeCl3+3NaA=FeA3↓+3NaCl
(5)蒸馏 (6) ①. ②. 球形干燥管 ③. 冷凝和防倒吸 ④. FeCl3只作催化剂;FeA3既作催化剂加快反应速率,又作吸水剂利于酯化反应正向进行
【14题答案】
【答案】(1)羟基(或-OH)
(2)离子键、(极性)共价键
(3) ①. 11 ②. pH越大,R溶解性越大,越有利于染料的渗透;但pH>11后纤维素开始离子化,不利于染色 ③. 3R++5OH-=3HR-+2+H2O
(4) ①. ②. 不能确定 ③. 因为温度升高使靛蓝还原速率加快的同时Na2S2O4分解使靛蓝还原速率减慢。在温度较低时以前者的影响为主,而温度较高时以后者的影响为主
同课章节目录
