甘肃省天水市2024-2025学年高二下学期期末阶段性检测化学试卷(含答案)
文档属性
| 名称 | 甘肃省天水市2024-2025学年高二下学期期末阶段性检测化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 21:20:56 | ||
图片预览

文档简介
甘肃省天水市2024-2025学年高二下学期期末阶段性检测化学试题
一、单选题
1.化学与生产、生活密切相关,下列物质的主要成分属于有机物的是
A.兵马俑 B.后母戊鼎 C.玉玺 D.塑料周转箱
A.A B.B C.C D.D
2.马家窑文化遗址出土了大量新石器时代陶制文物,陶制文物的主要成分为硅酸盐,下列有关表述错误的是
A.为酸性氧化物
B.和互为同位素
C.属于共价化合物
D.基态Si原子中,电子占据的最高能层符号为M
3.苦水玫瑰是中国国家地理标志产品,可从中提取高品质的玫瑰精油。玫瑰精油成分之—(R)的结构简式如图所示,下列有关R的说法错误的是
A.分子之间存在氢键
B.不存在芳香族的同分异构体
C.能与溶液发生显色反应
D.与HBr的加成产物有2种(不考虑立体异构和开环加成)
4.CO2加氢转化成甲烷,是综合利用CO2实现“碳中和”和“碳达峰”的重要方式。525℃、101kPa下,,反应达到平衡时,下列措施能使平衡向逆反应方向移动的是
A.升高温度 B.增大压强
C.加入适宜的催化剂 D.恒容时充入少量He(g)
5.X、Y、Z、W、Q为原子序数依次增大的短周期主族元素。Y、Q基态原子的价电子数相同,均为其K层电子数的3倍,X与Z同族,W为金属元素,其原子序数等于X与Z的原子序数之和。下列说法错误的是
A.的水溶液显碱性
B.Y与Z可形成或
C.常温下,能溶解在ZYX溶液中
D.与的浓溶液能发生氧化还原反应
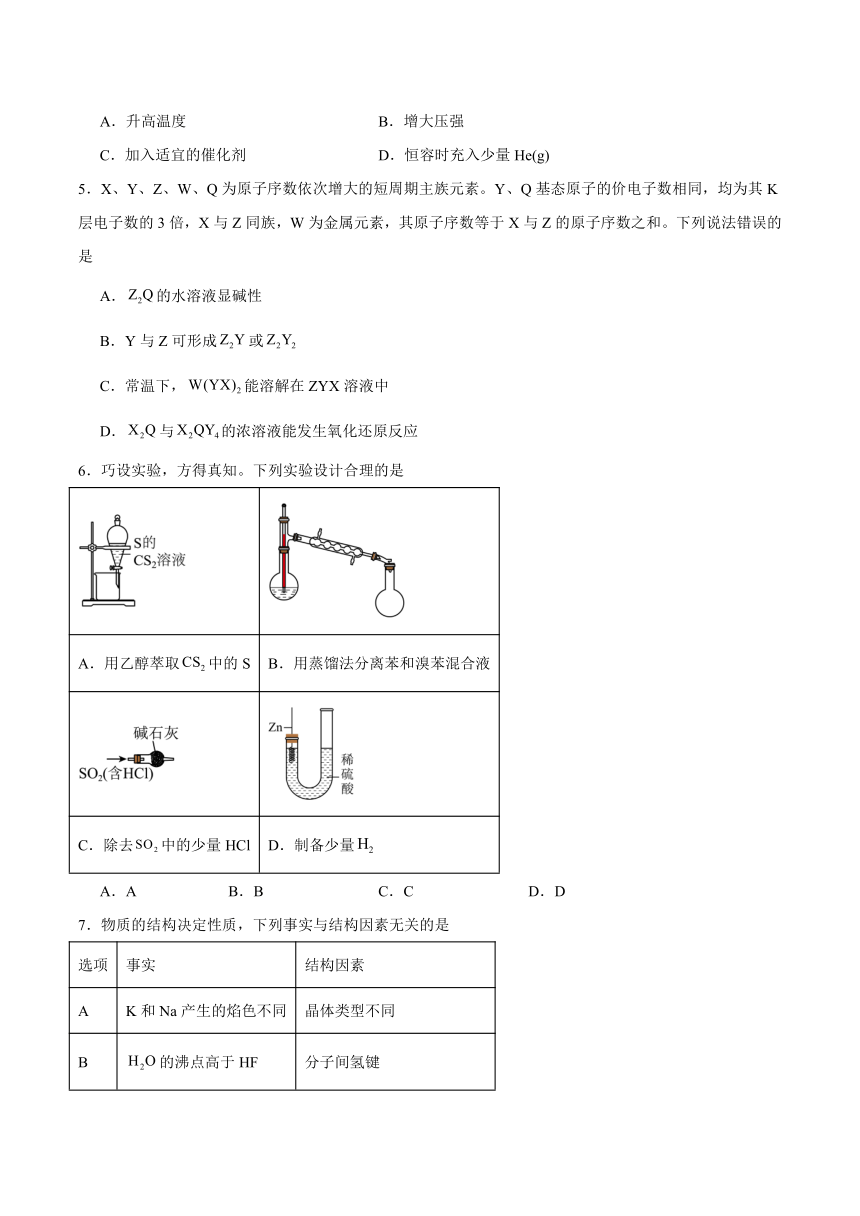
6.巧设实验,方得真知。下列实验设计合理的是
A.用乙醇萃取中的S B.用蒸馏法分离苯和溴苯混合液
C.除去中的少量HCl D.制备少量
A.A B.B C.C D.D
7.物质的结构决定性质,下列事实与结构因素无关的是
选项 事实 结构因素
A K和Na产生的焰色不同 晶体类型不同
B 的沸点高于HF 分子间氢键
C 金属具有良好的导热性 金属具有可自由移动的电子
D BN的硬度大,熔点高 BN属于共价晶体
A.A B.B C.C D.D
8.物质的性质决定用途,下列物质的性质与用途的对应关系不成立的是
选项 物质的性质 用途
A Na2CO3溶液显碱性 Na2CO3作家用洗涤剂
B 氢气具有还原性 作氢气球的填充剂
C 离子液体具有导电性 作原电池的电解质
D CO2无可燃性 作气体灭火器材料
A.A B.B C.C D.D
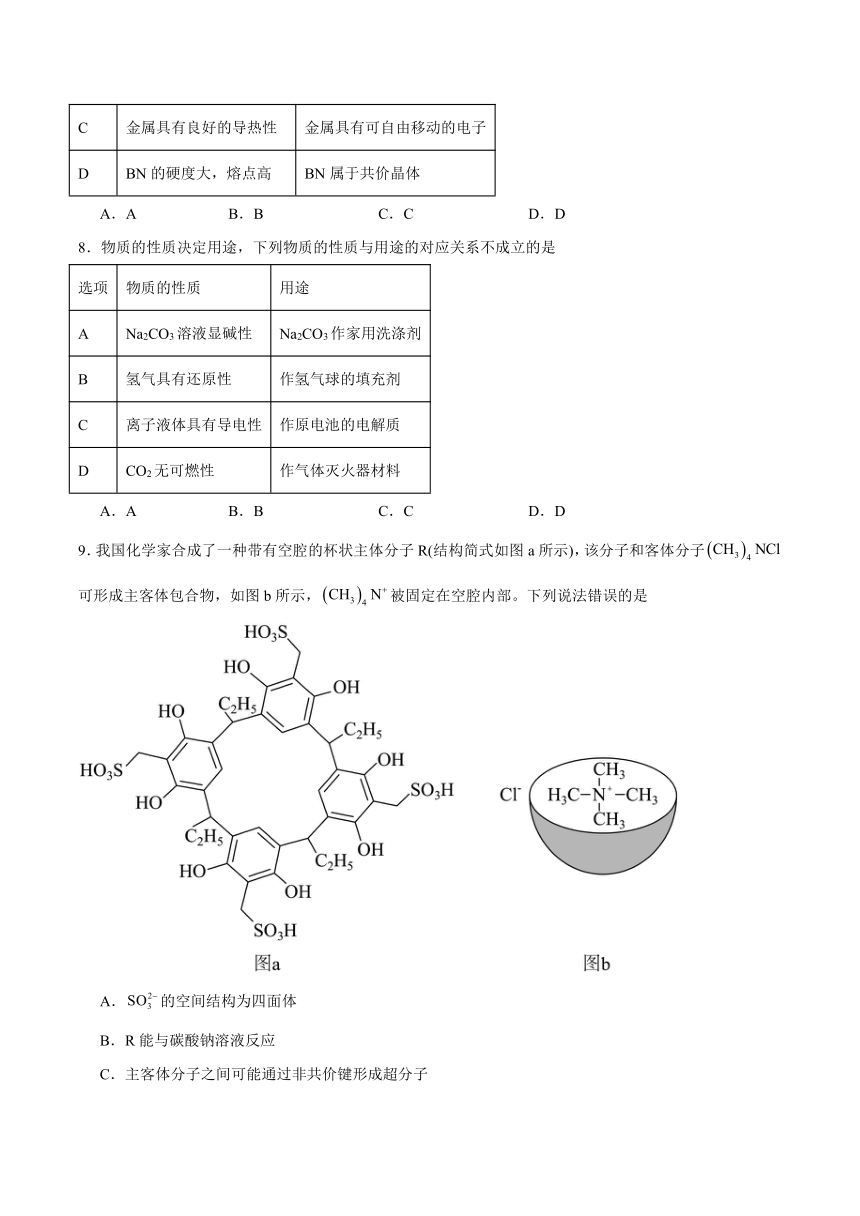
9.我国化学家合成了一种带有空腔的杯状主体分子R(结构简式如图a所示),该分子和客体分子可形成主客体包合物,如图b所示,被固定在空腔内部。下列说法错误的是
A.的空间结构为四面体
B.R能与碳酸钠溶液反应
C.主客体分子之间可能通过非共价键形成超分子
D.中元素电负性最小的是H
10.我国科学家制备了具有优良双折射性能的材料。下列说法错误的是
A.极性
B.第一电离能:N>C>H
C.基态氮原子中占据最高能级的电子云轮廓图为哑铃形
D.一定条件下,能与发生加成反应
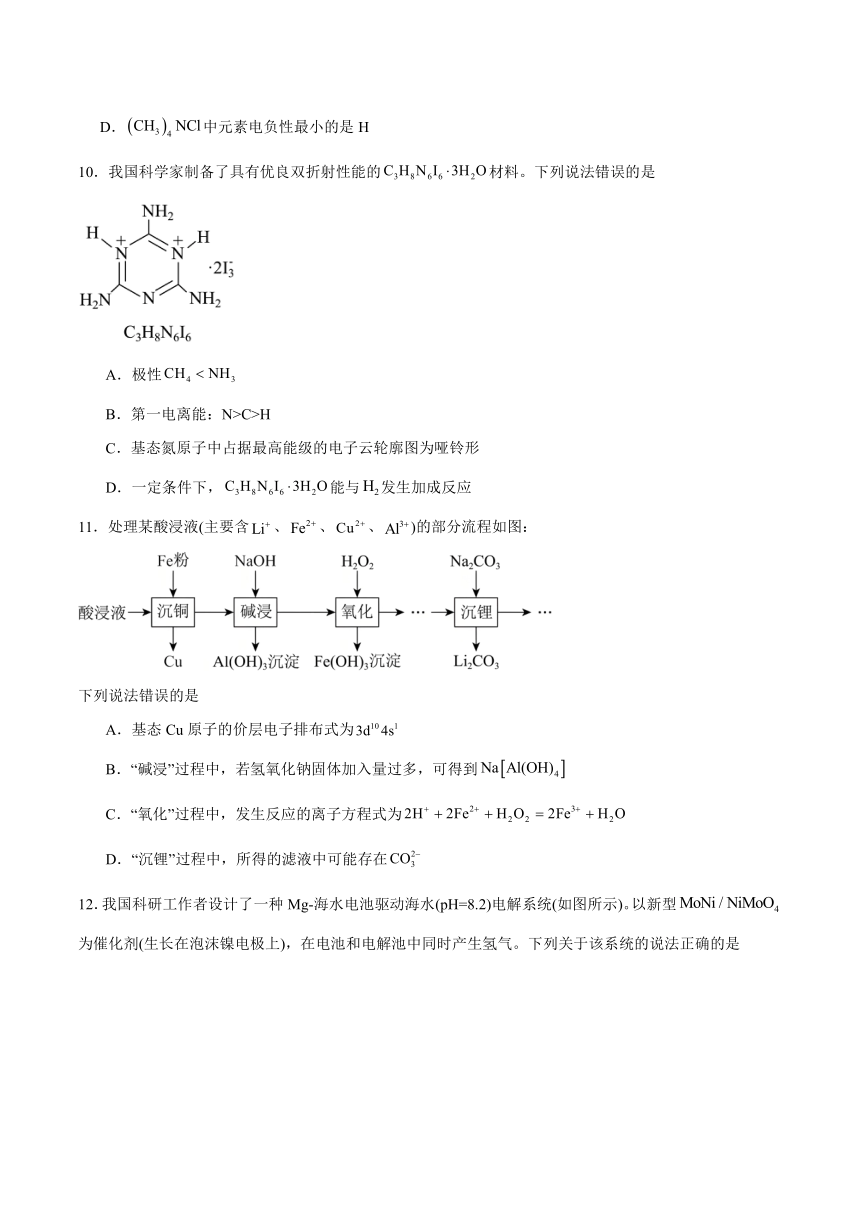
11.处理某酸浸液(主要含、、、)的部分流程如图:
下列说法错误的是
A.基态Cu原子的价层电子排布式为
B.“碱浸”过程中,若氢氧化钠固体加入量过多,可得到
C.“氧化”过程中,发生反应的离子方程式为
D.“沉锂”过程中,所得的滤液中可能存在
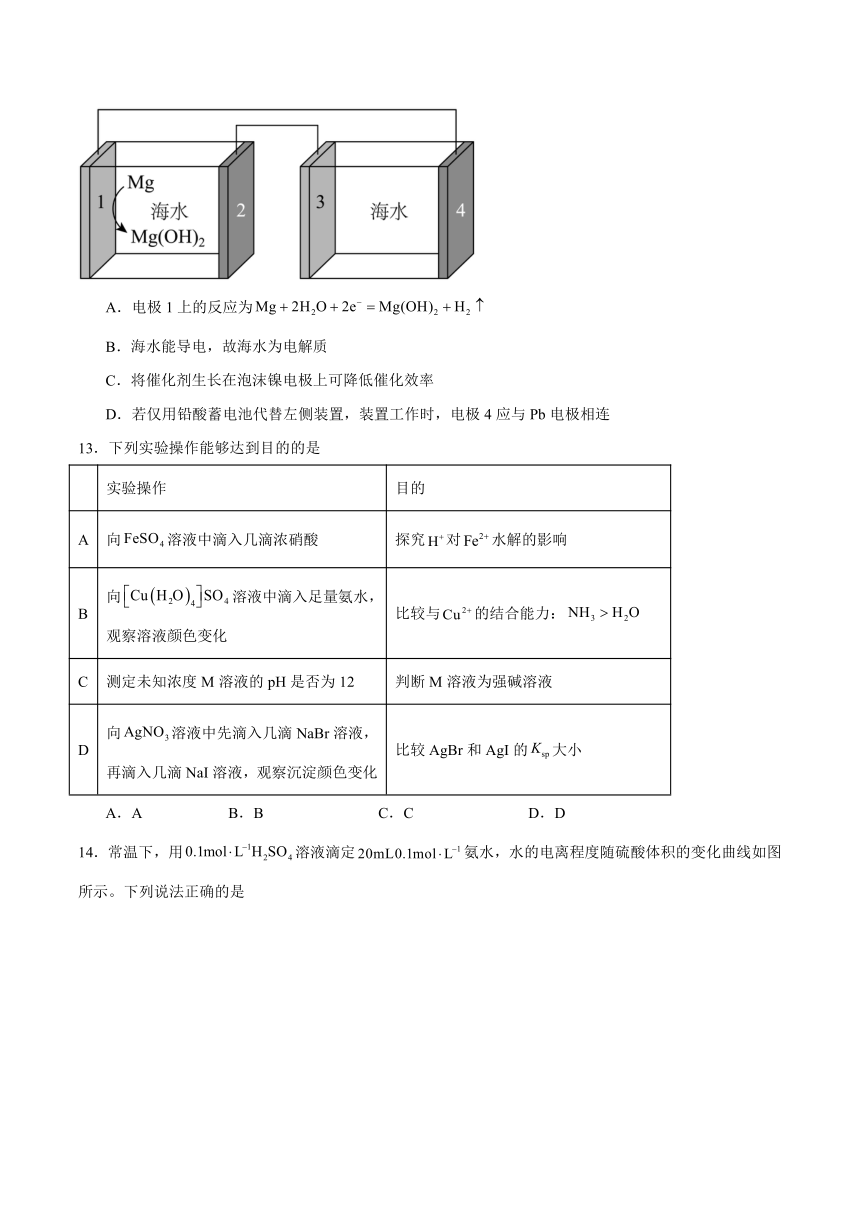
12.我国科研工作者设计了一种Mg-海水电池驱动海水(pH=8.2)电解系统(如图所示)。以新型为催化剂(生长在泡沫镍电极上),在电池和电解池中同时产生氢气。下列关于该系统的说法正确的是
A.电极1上的反应为
B.海水能导电,故海水为电解质
C.将催化剂生长在泡沫镍电极上可降低催化效率
D.若仅用铅酸蓄电池代替左侧装置,装置工作时,电极4应与Pb电极相连
13.下列实验操作能够达到目的的是
实验操作 目的
A 向溶液中滴入几滴浓硝酸 探究对水解的影响
B 向溶液中滴入足量氨水,观察溶液颜色变化 比较与的结合能力:
C 测定未知浓度M溶液的pH是否为12 判断M溶液为强碱溶液
D 向溶液中先滴入几滴NaBr溶液,再滴入几滴NaI溶液,观察沉淀颜色变化 比较AgBr和AgI的大小
A.A B.B C.C D.D
14.常温下,用溶液滴定氨水,水的电离程度随硫酸体积的变化曲线如图所示。下列说法正确的是
A.
B.a点溶液中,可能存在
C.b点溶液中,
D.往c点溶液中滴几滴紫色石蕊试液,可观察到溶液由无色变为蓝色
二、解答题
15.某校化学实验兴趣小组按如下流程由稀土氧化物和苯甲酸钠制备配合物。
已知:I.在碱性溶液中易形成沉淀;在空气中易吸潮,加强热时分解生成。
II.上述流程步骤②中,调节溶液pH时搅拌并缓慢滴加NaOH溶液,目的是防止生成;pH接近6时,为了防止pH变化过大,边滴加边测定溶液的pH。
回答下列问题:
(1)Eu与Sc位于同一族,则Eu是第 族元素。
(2)为了加快步骤①的反应速率,可采取的方法为 (填1种即可)。
(3)下列玻璃仪器中,配制一定物质的量浓度的苯甲酸钠溶液所需的仪器为 (填标号)。
A.胶头滴管 B.三通管 C.冷凝器 D.玻璃棒
(4)准确称取一定量产品,溶解于稀硝酸中后,加入有机溶剂萃取生成的苯甲酸,蒸去有机溶剂后,冷却至室温并转移至锥形瓶中,加入一定量的NaOH标准溶液,滴入1~2滴指示剂,用HCl标准溶液滴定剩余的NaOH。
①滴定时,HCl标准溶液应盛装在 (填“酸”或“碱”)式滴定管中。
②滴定过程中眼睛应注视 的变化。
③该实验所需的最佳指示剂为 (填“甲基橙”或“酚酞溶液”)。
(5)配合物中含有的化学键为 (填标号)。
a.氢键 b.共价键 c.金属键
(6)若的质量为5.33g,则x= 。
16.研究人员设计了一种从铜冶炼烟尘(主要含S、及Cu、Zn、Pb的硫酸盐)中高效回收砷、铜、锌和铅的绿色工艺流程,部分流程如下:
已知:①的熔点为314℃,沸点为460℃;
②物质分解温度:CuO1100℃、560℃、680℃、1000℃;
③。
回答下列问题:
(1)中心原子的杂化方式为 。
(2)若“焙烧”时的温度为560℃,则发生分解反应的化学方程式为 。
(3)“制酸系统”中,为了不引入其他杂质,吸收最好使用 (填“溶液”或“浓硝酸”)。
(4)“浸出液”中所含的主要阳离子为 (填离子符号)。
(5)是一种被广泛应用于太阳能电池领域的晶体材料,室温下该化合物晶胞如图所示,,该晶体的密度为,设为阿伏加德罗常数的值。
①●表示 (填“Cs”“Pb”或“Br”)原子。
②该晶胞的体积V, (用含ρ、的代数式表示)。
③若高ed为hcm,边长ab和边长bc之和为xcm,则bd的长为 (用含ρ、h、、x的代数式表示)cm。
17.硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
(1)已知下列热化学方程式:
;
;
。
则 (用含m、n、c的代数式表示)。
(2)将置于抽空的刚性容器中,升高温度发生分解反应:。平衡时与温度T的关系如图所示。
①属于 (填“酸”或“碱”)性氧化物。
②该反应的ΔS (填“>”或“<”)0。
③时,该反应的平衡总压 kPa,平衡常数 。
④升高温度,容器中进一步发生反应:,平衡时 [用含,的代数式表示]。在时,,,则 (用含a、b的代数式表示,下同)kPa, kPa。
18.秸秆(含多糖类物质)的综合利用具有重要意义。以秸秆为原料合成聚酯类高分子的路线如图。
回答下列问题:
(1)下列有关A的说法正确的是 (填标号)。
a.无顺反异构体 b.实验式为
c.不能发生氧化反应 d.能与金属Na、NaOH和反应
(2)B中所含官能团的名称为 ,0.1molB最多可与 L(标准状况下)发生加成反应。
(3)C→D的反应类型为 。
(4)乙二醇的结构简式为 。
(5)F→G的反应方程式为 。
(6)J是E的同分异构体,符合下列条件的J的结构有 种(不考虑立体异构)。
①不含;
②除苯环外不含其他环;
③能与发生反应且0.1molJ最多可消耗0.2mol。
其中核磁共振氢谱显示只有三组峰且峰面积之比为1∶2∶2的结构简式为 。
(7)结合所学知识并参考上述合成路线,设计仅以为碳源合成的路线 (无机试剂任选)。
参考答案
1.D
2.B
3.C
4.A
5.C
6.D
7.A
8.B
9.A
10.B
11.C
12.D
13.B
14.C
15.(1)IIIB
(2)搅拌或适当升高温度
(3)AD
(4) 酸 锥形瓶内溶液颜色 酚酞溶液
(5)b
(6)1
16.(1)
(2)
(3)溶液
(4)、和
(5) Br
17.(1)
(2) 酸 > 5 6.25
18.(1)bd
(2) 碳碳双键和羧基 4.48
(3)加成反应
(4)
(5)(2n-1)H2O
(6) 8
(7)
一、单选题
1.化学与生产、生活密切相关,下列物质的主要成分属于有机物的是
A.兵马俑 B.后母戊鼎 C.玉玺 D.塑料周转箱
A.A B.B C.C D.D
2.马家窑文化遗址出土了大量新石器时代陶制文物,陶制文物的主要成分为硅酸盐,下列有关表述错误的是
A.为酸性氧化物
B.和互为同位素
C.属于共价化合物
D.基态Si原子中,电子占据的最高能层符号为M
3.苦水玫瑰是中国国家地理标志产品,可从中提取高品质的玫瑰精油。玫瑰精油成分之—(R)的结构简式如图所示,下列有关R的说法错误的是
A.分子之间存在氢键
B.不存在芳香族的同分异构体
C.能与溶液发生显色反应
D.与HBr的加成产物有2种(不考虑立体异构和开环加成)
4.CO2加氢转化成甲烷,是综合利用CO2实现“碳中和”和“碳达峰”的重要方式。525℃、101kPa下,,反应达到平衡时,下列措施能使平衡向逆反应方向移动的是
A.升高温度 B.增大压强
C.加入适宜的催化剂 D.恒容时充入少量He(g)
5.X、Y、Z、W、Q为原子序数依次增大的短周期主族元素。Y、Q基态原子的价电子数相同,均为其K层电子数的3倍,X与Z同族,W为金属元素,其原子序数等于X与Z的原子序数之和。下列说法错误的是
A.的水溶液显碱性
B.Y与Z可形成或
C.常温下,能溶解在ZYX溶液中
D.与的浓溶液能发生氧化还原反应
6.巧设实验,方得真知。下列实验设计合理的是
A.用乙醇萃取中的S B.用蒸馏法分离苯和溴苯混合液
C.除去中的少量HCl D.制备少量
A.A B.B C.C D.D
7.物质的结构决定性质,下列事实与结构因素无关的是
选项 事实 结构因素
A K和Na产生的焰色不同 晶体类型不同
B 的沸点高于HF 分子间氢键
C 金属具有良好的导热性 金属具有可自由移动的电子
D BN的硬度大,熔点高 BN属于共价晶体
A.A B.B C.C D.D
8.物质的性质决定用途,下列物质的性质与用途的对应关系不成立的是
选项 物质的性质 用途
A Na2CO3溶液显碱性 Na2CO3作家用洗涤剂
B 氢气具有还原性 作氢气球的填充剂
C 离子液体具有导电性 作原电池的电解质
D CO2无可燃性 作气体灭火器材料
A.A B.B C.C D.D
9.我国化学家合成了一种带有空腔的杯状主体分子R(结构简式如图a所示),该分子和客体分子可形成主客体包合物,如图b所示,被固定在空腔内部。下列说法错误的是
A.的空间结构为四面体
B.R能与碳酸钠溶液反应
C.主客体分子之间可能通过非共价键形成超分子
D.中元素电负性最小的是H
10.我国科学家制备了具有优良双折射性能的材料。下列说法错误的是
A.极性
B.第一电离能:N>C>H
C.基态氮原子中占据最高能级的电子云轮廓图为哑铃形
D.一定条件下,能与发生加成反应
11.处理某酸浸液(主要含、、、)的部分流程如图:
下列说法错误的是
A.基态Cu原子的价层电子排布式为
B.“碱浸”过程中,若氢氧化钠固体加入量过多,可得到
C.“氧化”过程中,发生反应的离子方程式为
D.“沉锂”过程中,所得的滤液中可能存在
12.我国科研工作者设计了一种Mg-海水电池驱动海水(pH=8.2)电解系统(如图所示)。以新型为催化剂(生长在泡沫镍电极上),在电池和电解池中同时产生氢气。下列关于该系统的说法正确的是
A.电极1上的反应为
B.海水能导电,故海水为电解质
C.将催化剂生长在泡沫镍电极上可降低催化效率
D.若仅用铅酸蓄电池代替左侧装置,装置工作时,电极4应与Pb电极相连
13.下列实验操作能够达到目的的是
实验操作 目的
A 向溶液中滴入几滴浓硝酸 探究对水解的影响
B 向溶液中滴入足量氨水,观察溶液颜色变化 比较与的结合能力:
C 测定未知浓度M溶液的pH是否为12 判断M溶液为强碱溶液
D 向溶液中先滴入几滴NaBr溶液,再滴入几滴NaI溶液,观察沉淀颜色变化 比较AgBr和AgI的大小
A.A B.B C.C D.D
14.常温下,用溶液滴定氨水,水的电离程度随硫酸体积的变化曲线如图所示。下列说法正确的是
A.
B.a点溶液中,可能存在
C.b点溶液中,
D.往c点溶液中滴几滴紫色石蕊试液,可观察到溶液由无色变为蓝色
二、解答题
15.某校化学实验兴趣小组按如下流程由稀土氧化物和苯甲酸钠制备配合物。
已知:I.在碱性溶液中易形成沉淀;在空气中易吸潮,加强热时分解生成。
II.上述流程步骤②中,调节溶液pH时搅拌并缓慢滴加NaOH溶液,目的是防止生成;pH接近6时,为了防止pH变化过大,边滴加边测定溶液的pH。
回答下列问题:
(1)Eu与Sc位于同一族,则Eu是第 族元素。
(2)为了加快步骤①的反应速率,可采取的方法为 (填1种即可)。
(3)下列玻璃仪器中,配制一定物质的量浓度的苯甲酸钠溶液所需的仪器为 (填标号)。
A.胶头滴管 B.三通管 C.冷凝器 D.玻璃棒
(4)准确称取一定量产品,溶解于稀硝酸中后,加入有机溶剂萃取生成的苯甲酸,蒸去有机溶剂后,冷却至室温并转移至锥形瓶中,加入一定量的NaOH标准溶液,滴入1~2滴指示剂,用HCl标准溶液滴定剩余的NaOH。
①滴定时,HCl标准溶液应盛装在 (填“酸”或“碱”)式滴定管中。
②滴定过程中眼睛应注视 的变化。
③该实验所需的最佳指示剂为 (填“甲基橙”或“酚酞溶液”)。
(5)配合物中含有的化学键为 (填标号)。
a.氢键 b.共价键 c.金属键
(6)若的质量为5.33g,则x= 。
16.研究人员设计了一种从铜冶炼烟尘(主要含S、及Cu、Zn、Pb的硫酸盐)中高效回收砷、铜、锌和铅的绿色工艺流程,部分流程如下:
已知:①的熔点为314℃,沸点为460℃;
②物质分解温度:CuO1100℃、560℃、680℃、1000℃;
③。
回答下列问题:
(1)中心原子的杂化方式为 。
(2)若“焙烧”时的温度为560℃,则发生分解反应的化学方程式为 。
(3)“制酸系统”中,为了不引入其他杂质,吸收最好使用 (填“溶液”或“浓硝酸”)。
(4)“浸出液”中所含的主要阳离子为 (填离子符号)。
(5)是一种被广泛应用于太阳能电池领域的晶体材料,室温下该化合物晶胞如图所示,,该晶体的密度为,设为阿伏加德罗常数的值。
①●表示 (填“Cs”“Pb”或“Br”)原子。
②该晶胞的体积V, (用含ρ、的代数式表示)。
③若高ed为hcm,边长ab和边长bc之和为xcm,则bd的长为 (用含ρ、h、、x的代数式表示)cm。
17.硫酸亚铁在工农业生产中有许多用途,如可用作农药防治小麦黑穗病,制造磁性氧化铁、铁催化剂等。回答下列问题:
(1)已知下列热化学方程式:
;
;
。
则 (用含m、n、c的代数式表示)。
(2)将置于抽空的刚性容器中,升高温度发生分解反应:。平衡时与温度T的关系如图所示。
①属于 (填“酸”或“碱”)性氧化物。
②该反应的ΔS (填“>”或“<”)0。
③时,该反应的平衡总压 kPa,平衡常数 。
④升高温度,容器中进一步发生反应:,平衡时 [用含,的代数式表示]。在时,,,则 (用含a、b的代数式表示,下同)kPa, kPa。
18.秸秆(含多糖类物质)的综合利用具有重要意义。以秸秆为原料合成聚酯类高分子的路线如图。
回答下列问题:
(1)下列有关A的说法正确的是 (填标号)。
a.无顺反异构体 b.实验式为
c.不能发生氧化反应 d.能与金属Na、NaOH和反应
(2)B中所含官能团的名称为 ,0.1molB最多可与 L(标准状况下)发生加成反应。
(3)C→D的反应类型为 。
(4)乙二醇的结构简式为 。
(5)F→G的反应方程式为 。
(6)J是E的同分异构体,符合下列条件的J的结构有 种(不考虑立体异构)。
①不含;
②除苯环外不含其他环;
③能与发生反应且0.1molJ最多可消耗0.2mol。
其中核磁共振氢谱显示只有三组峰且峰面积之比为1∶2∶2的结构简式为 。
(7)结合所学知识并参考上述合成路线,设计仅以为碳源合成的路线 (无机试剂任选)。
参考答案
1.D
2.B
3.C
4.A
5.C
6.D
7.A
8.B
9.A
10.B
11.C
12.D
13.B
14.C
15.(1)IIIB
(2)搅拌或适当升高温度
(3)AD
(4) 酸 锥形瓶内溶液颜色 酚酞溶液
(5)b
(6)1
16.(1)
(2)
(3)溶液
(4)、和
(5) Br
17.(1)
(2) 酸 > 5 6.25
18.(1)bd
(2) 碳碳双键和羧基 4.48
(3)加成反应
(4)
(5)(2n-1)H2O
(6) 8
(7)
同课章节目录
