河北省秦皇岛市昌黎第一中学2024-2025学年高二下学期期末考试化学试卷(含答案)
文档属性
| 名称 | 河北省秦皇岛市昌黎第一中学2024-2025学年高二下学期期末考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 21:32:23 | ||
图片预览


文档简介
河北省秦皇岛市昌黎第一中学2024-2025学年高二下学期期末考试 化学试卷
一、单选题
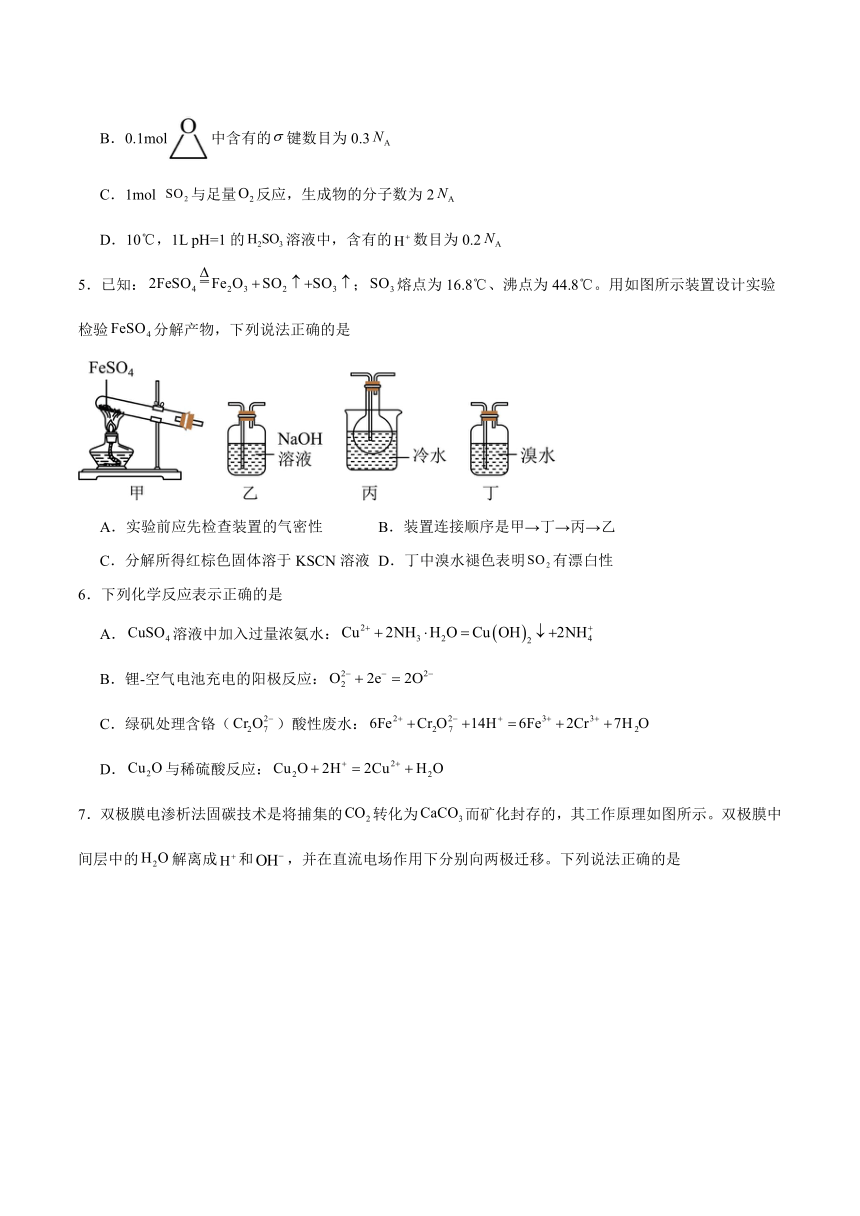
1.中国文物凝结着中华上下五千年的文化精华。下列文物的制作材料属于金属材料的是
A.唐三彩陪葬俑 B.北宋木雕罗汉像 C.元白玉镂雕龙穿牡丹盖钮 D.青铜人首柱
A.A B.B C.C D.D
2.下列说法正确的是
A.分子的电子式为
B.甲醛分子的空间填充模型:
C.卤素第一电离能与核电荷数关系:
D.NaClO中Cl的化合价为-1
3.化学与生产、生活密切相关。下列过程中不涉及化学变化的是
A.锂离子电池工作 B.石油的裂化
C.在钢铁部件表面进行钝化处理 D.制作博古梁架时,在木材上雕刻花纹
4.用表示阿伏加德罗常数的值。下列说法正确的是
A.28g 中含中子数为16
B.0.1mol中含有的键数目为0.3
C.1mol 与足量反应,生成物的分子数为2
D.10℃,1L pH=1的溶液中,含有的数目为0.2
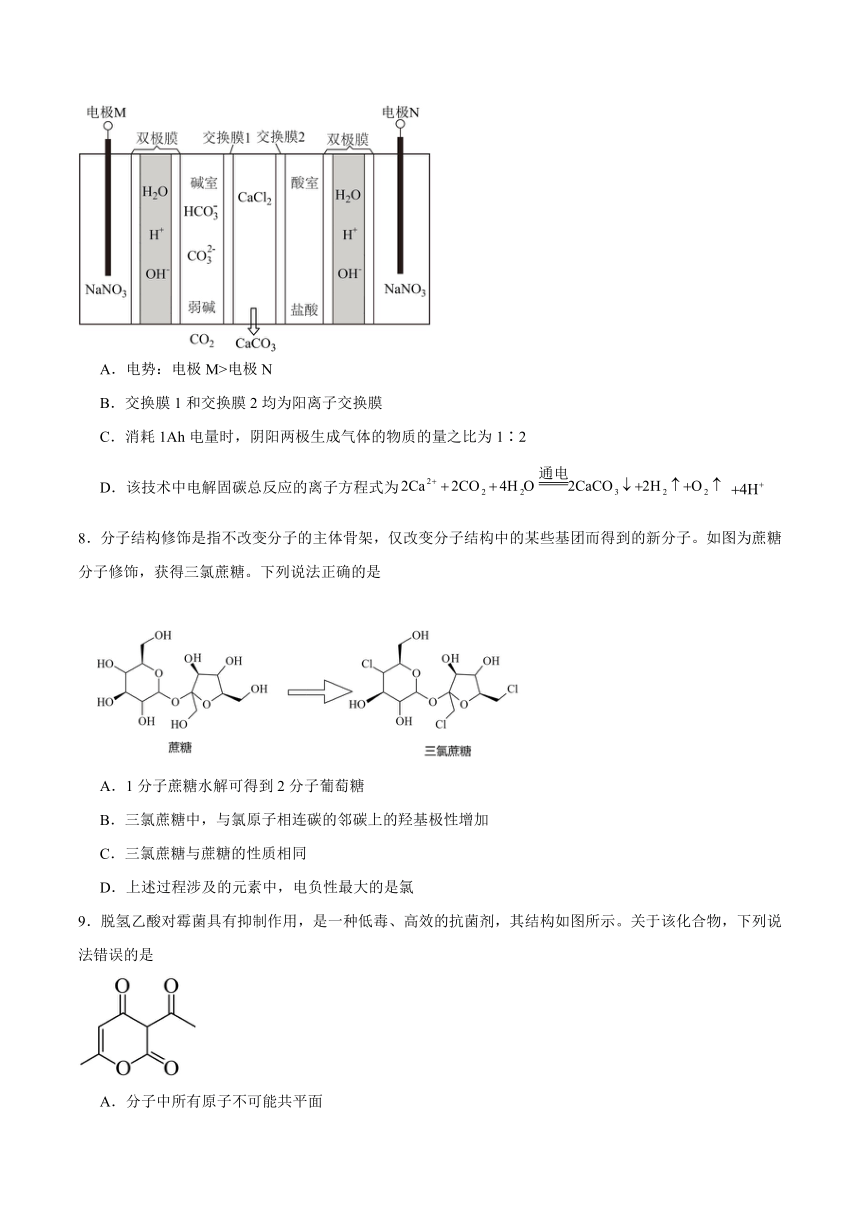
5.已知:;熔点为16.8℃、沸点为44.8℃。用如图所示装置设计实验检验分解产物,下列说法正确的是
A.实验前应先检查装置的气密性 B.装置连接顺序是甲→丁→丙→乙
C.分解所得红棕色固体溶于KSCN溶液 D.丁中溴水褪色表明有漂白性
6.下列化学反应表示正确的是
A.溶液中加入过量浓氨水:
B.锂-空气电池充电的阳极反应:
C.绿矾处理含铬()酸性废水:
D.与稀硫酸反应:
7.双极膜电渗析法固碳技术是将捕集的转化为而矿化封存的,其工作原理如图所示。双极膜中间层中的解离成和,并在直流电场作用下分别向两极迁移。下列说法正确的是
A.电势:电极M>电极N
B.交换膜1和交换膜2均为阳离子交换膜
C.消耗1Ah电量时,阴阳两极生成气体的物质的量之比为1∶2
D.该技术中电解固碳总反应的离子方程式为
8.分子结构修饰是指不改变分子的主体骨架,仅改变分子结构中的某些基团而得到的新分子。如图为蔗糖分子修饰,获得三氯蔗糖。下列说法正确的是
A.1分子蔗糖水解可得到2分子葡萄糖
B.三氯蔗糖中,与氯原子相连碳的邻碳上的羟基极性增加
C.三氯蔗糖与蔗糖的性质相同
D.上述过程涉及的元素中,电负性最大的是氯
9.脱氢乙酸对霉菌具有抑制作用,是一种低毒、高效的抗菌剂,其结构如图所示。关于该化合物,下列说法错误的是
A.分子中所有原子不可能共平面
B.在强酸、强碱环境中不能稳定存在
C.不存在分子中含有苯环的同分异构体
D.与足量加成后所得产物分子中有4个手性碳原子
10.在一定温度下,向一恒容密闭容器中充入M和N,发生反应,使用不同的催化剂,其反应历程如图所示。下列说法错误的是
A.混合气体密度不变,可说明该反应达到平衡
B.使用催化剂1时体系更快达到平衡状态,从而获得更高的平衡产率
C.升高温度不利于提高反应物的平衡转化率
D.达到平衡后向容器中加入一定量的Q,再次平衡后M和N的浓度均不变
11.W、X、Y、Z为原子序数依次增大的短周期元素。其中W原子中无中子,基态X原子价层电子排布式为,Y是电负性最大的元素,常温下,0.1的Z的最高价氧化物对应水化物溶液的pH=13.下列说法正确的是
A.最简单离子半径:YC.W与X、Y、Z均能形成化合物 D.Y的单质与反应生成两种酸
12.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物(溶解度随温度升高而增大)。
下列说法错误的是
A.步骤(1)(2)的操作分别是溶解、过滤和萃取、分液
B.步骤(3)的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C.步骤(4)中从有机层溶液中得到甲苯的方法是蒸馏
D.提纯粗产品可以采用过滤的方法
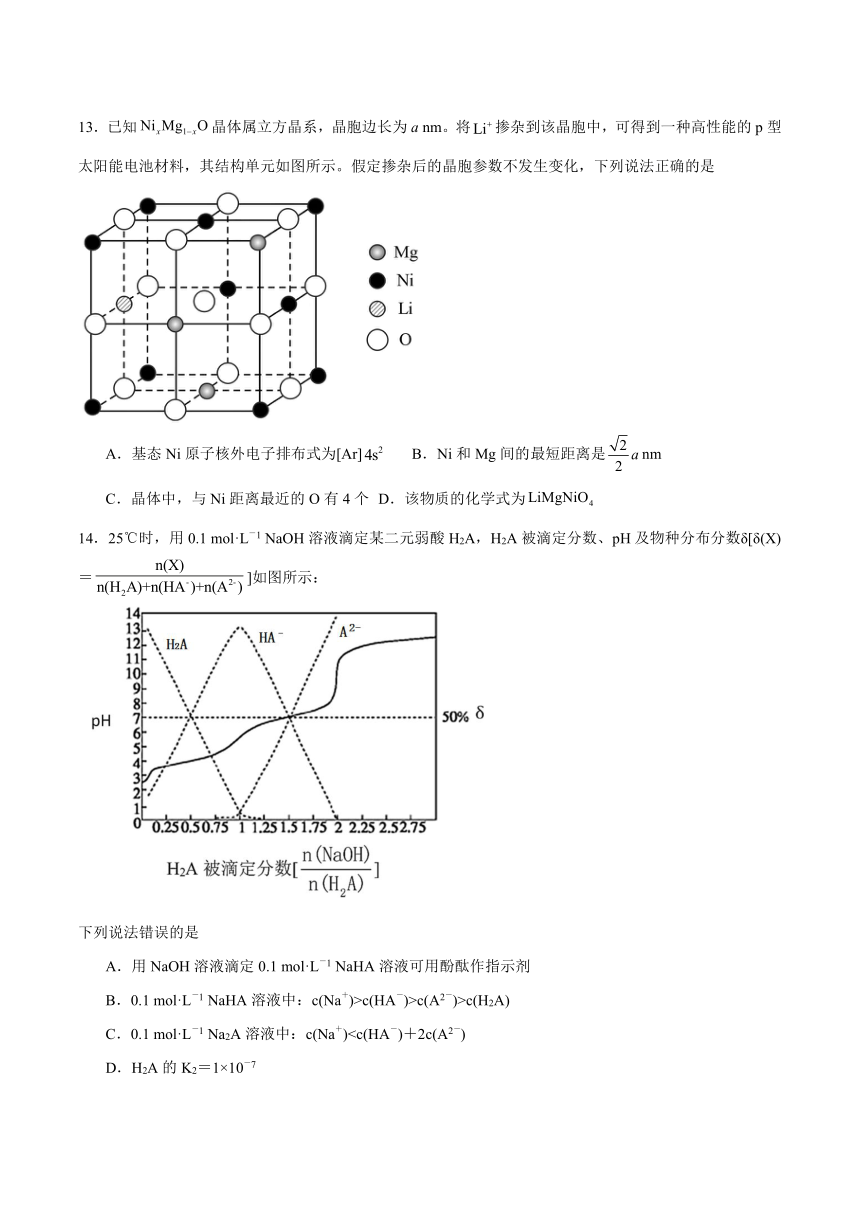
13.已知晶体属立方晶系,晶胞边长为a nm。将掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示。假定掺杂后的晶胞参数不发生变化,下列说法正确的是
A.基态Ni原子核外电子排布式为[Ar] B.Ni和Mg间的最短距离是nm
C.晶体中,与Ni距离最近的O有4个 D.该物质的化学式为
14.25℃时,用0.1 mol·L-1 NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=]如图所示:
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1 NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1 NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)
C.0.1 mol·L-1 Na2A溶液中:c(Na+)D.H2A的K2=1×10-7
二、解答题
15.绿矾(晶体)用途广泛,某同学以废弃小铁钉制备少量绿矾。步骤如下:
步骤1:取4g废弃小铁钉,先用浓度为10%的碳酸钠溶液清除油渍,然后用倾斜法倒去碳酸钠溶液,再用蒸馏水洗涤2~3次;
步骤2:将步骤1得到的铁钉加入如图所示的仪器X中,再加入15mL 4.6硫酸溶液。控温70~80℃加热10~15分钟,将所得溶液经趁热过滤、冷却结晶、过滤、洗涤、干燥,得到。
回答下列问题:
(1)仪器X的名称为 。
(2)通入的目的是 。
(3)步骤1“倾斜法”是分离固体和液体方法的一种操作,操作如图所示。与普通过滤相比,“倾斜法”的优点是 。
(4)步骤2控温70~80℃的加热方式为 ,简述用冷水洗涤晶体的操作: 。
(5)测定的纯度:准确称取3.00g 样品,加适量水溶解,配成100mL溶液,取20.00mL溶液置于锥形瓶中,用0.02的酸性标准溶液滴定(杂质不与酸性标准溶液反应),经3次测定,每次消耗溶液的体积如下:
实验序号 1 2 3
消耗溶液体积/mL 19.98 20.58 20.02
产品中的质量分数为 (保留四位有效数字)。
(6)利用赤铁矿渣(主要成分为、和少量)为原料也可以制备晶体,请补充完整相应的实验方案:取一定量的赤铁矿渣,在不断搅拌下,分批次加入 中,过滤,用 ,生成沉淀、过滤、洗涤后,将沉淀加入1.0的硫酸溶液中,同时加入 ,充分反应后,过滤,向滤液中加乙醇,在恒温水浴槽中冷却结晶,过滤,用丙酮洗涤,干燥,得晶体。(已知该实验中pH=3.5时,沉淀完全;pH=4.1时,开始沉淀。实验中必须使用的试剂:1.0的H2SO4、1.0的NaOH、铁粉)
16.一种以高镁盐湖卤水{主要含、、、、和}为原料制备钴酸锂()的工艺流程如图所示:
已知:常温下,、、、、;相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)已知在水中存在如下平衡:。加入盐酸能实现“脱硼”的原因是 (语言叙述)。
(2)步骤“精制Ⅰ”“精制Ⅱ”是分两次进行深度除镁。
①滤渣Ⅰ和滤渣Ⅱ主要成分中都含有的沉淀物质是 (填化学式)。
②“精制Ⅰ”后溶液中的浓度为2.2,则常温下“精制Ⅱ”时浓度应控制在 以下(保留小数点后一位)。
(3)“系列操作沉锂”包括先加入适量饱和溶液,蒸发浓缩、 ,洗涤,干燥。
(4)滤液Ⅰ中含有较多的阳离子是 (填离子符号)。
(5)“高温固相合成”时,具体做法为按Li/Co的物质的量之比为1∶1调配好和,然后在空气氛围中煅烧,该过程的化学方程式为 。
(6)一种富锂超离子导体的立方晶胞如图所示,其中晶胞参数为a pm。
①该晶体的密度为 (阿伏加德罗常数的值用表示,写出计算式即可)。
②若该晶胞以Cl为顶点,则Li在晶胞中的位置为 。
17.将转化为甲醇,对于能源、环境等具有重要意义。在加氢制甲醇的反应体系中,主要发生反应的热化学方程式如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)相关键能数据如表所示,反应Ⅲ的 。
化学键 H—H C≡O O—H C=O
键能/() 436 1071 464 803
(2)某条件下,假设仅发生反应Ⅰ,该反应的反应速率,,该反应的平衡常数,则x= ,y= 。
(3)一定条件,将和按物质的量之比为1∶3的投料比充入某刚性密闭容器中,发生反应Ⅰ,测得的物质的量随反应时间的变化如图所示。
①0~5min,反应中共放出的热量为 kJ。
②9min时改变的外界条件可能是 。
(4)在体积为1L的恒容密闭容器中通入1mol 和3mol ,发生上述反应Ⅰ、Ⅱ、Ⅲ,的平衡转化率随温度和压强的变化如图所示。
①压强、、由大到小的顺序为 。
②在某温度下,平衡时容器中(g)为0.3mol,n(CO)(g)为0.3mol,则反应Ⅲ的平衡常数K= 。
(5)下列有关说法正确的是 (填字母)。
A.的水溶液能导电,故属于电解质
B.中心原子碳的价层电子对数为4
C.干冰晶胞中,一个分子周围有12个分子紧邻
D.分子中存在大键
(6)甲醇燃料电池的工作原理如图所示,则X电极的电极反应式为 。
18.有机物G是制药中间体。G的一种合成路线如下:
回答下列问题:
(1)F中官能团的名称为 。
(2)C的化学名称为 。
(3)B、D的结构简式分别为 、 。
(4)B→C的反应类型为 。
(5)满足下列条件的A的芳香族同分异构体有 种(不含立体异构),其中分子中含有手性碳原子的结构简式为 (任写一种)。
①苯环上有两个取代基;
②能与溶液发生显色反应;
③能发生银镜反应和水解反应;
④分子中除了含苯环外,不含其他环状结构。
(6)以、为原料制备的合成路线流程图如下:
,其中X、Y、Z的结构简式分别为 、 、 。
参考答案
1.D
2.B
3.D
4.A
5.A
6.C
7.D
8.B
9.C
10.B
11.C
12.D
13.B
14.C
15.(1)三颈烧瓶
(2)排尽装置内的空气,防止被氧化,避免制备的绿矾不纯
(3)操作简单、分离速率快、产品损耗少
(4) 水浴加热 沿玻璃棒向漏斗(过滤器)中加水至水浸没沉淀,待水自然流下,重复2~3次
(5)92.67%
(6) 足量1.0的 1.0的NaOH溶液调节溶液pH到3.5~4.1 过量铁粉
16.(1)加入盐酸会增大,各平衡逆向移动,使得沉淀增多,起到脱硼作用
(2)
(3)趁热过滤
(4)
(5)
(6) 面心
17.(1)+43
(2) 1 3
(3) 19.8 降温或分离生成物
(4) 0.25
(5)CD
(6)
18.(1)羟基、酯基
(2)苯丁酸乙酯(或4-苯基丁酸乙酯)
(3)
(4)取代(或酯化)反应
(5) 24 (邻、间、对任写一种均可)
(6)
一、单选题
1.中国文物凝结着中华上下五千年的文化精华。下列文物的制作材料属于金属材料的是
A.唐三彩陪葬俑 B.北宋木雕罗汉像 C.元白玉镂雕龙穿牡丹盖钮 D.青铜人首柱
A.A B.B C.C D.D
2.下列说法正确的是
A.分子的电子式为
B.甲醛分子的空间填充模型:
C.卤素第一电离能与核电荷数关系:
D.NaClO中Cl的化合价为-1
3.化学与生产、生活密切相关。下列过程中不涉及化学变化的是
A.锂离子电池工作 B.石油的裂化
C.在钢铁部件表面进行钝化处理 D.制作博古梁架时,在木材上雕刻花纹
4.用表示阿伏加德罗常数的值。下列说法正确的是
A.28g 中含中子数为16
B.0.1mol中含有的键数目为0.3
C.1mol 与足量反应,生成物的分子数为2
D.10℃,1L pH=1的溶液中,含有的数目为0.2
5.已知:;熔点为16.8℃、沸点为44.8℃。用如图所示装置设计实验检验分解产物,下列说法正确的是
A.实验前应先检查装置的气密性 B.装置连接顺序是甲→丁→丙→乙
C.分解所得红棕色固体溶于KSCN溶液 D.丁中溴水褪色表明有漂白性
6.下列化学反应表示正确的是
A.溶液中加入过量浓氨水:
B.锂-空气电池充电的阳极反应:
C.绿矾处理含铬()酸性废水:
D.与稀硫酸反应:
7.双极膜电渗析法固碳技术是将捕集的转化为而矿化封存的,其工作原理如图所示。双极膜中间层中的解离成和,并在直流电场作用下分别向两极迁移。下列说法正确的是
A.电势:电极M>电极N
B.交换膜1和交换膜2均为阳离子交换膜
C.消耗1Ah电量时,阴阳两极生成气体的物质的量之比为1∶2
D.该技术中电解固碳总反应的离子方程式为
8.分子结构修饰是指不改变分子的主体骨架,仅改变分子结构中的某些基团而得到的新分子。如图为蔗糖分子修饰,获得三氯蔗糖。下列说法正确的是
A.1分子蔗糖水解可得到2分子葡萄糖
B.三氯蔗糖中,与氯原子相连碳的邻碳上的羟基极性增加
C.三氯蔗糖与蔗糖的性质相同
D.上述过程涉及的元素中,电负性最大的是氯
9.脱氢乙酸对霉菌具有抑制作用,是一种低毒、高效的抗菌剂,其结构如图所示。关于该化合物,下列说法错误的是
A.分子中所有原子不可能共平面
B.在强酸、强碱环境中不能稳定存在
C.不存在分子中含有苯环的同分异构体
D.与足量加成后所得产物分子中有4个手性碳原子
10.在一定温度下,向一恒容密闭容器中充入M和N,发生反应,使用不同的催化剂,其反应历程如图所示。下列说法错误的是
A.混合气体密度不变,可说明该反应达到平衡
B.使用催化剂1时体系更快达到平衡状态,从而获得更高的平衡产率
C.升高温度不利于提高反应物的平衡转化率
D.达到平衡后向容器中加入一定量的Q,再次平衡后M和N的浓度均不变
11.W、X、Y、Z为原子序数依次增大的短周期元素。其中W原子中无中子,基态X原子价层电子排布式为,Y是电负性最大的元素,常温下,0.1的Z的最高价氧化物对应水化物溶液的pH=13.下列说法正确的是
A.最简单离子半径:Y
12.按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物(溶解度随温度升高而增大)。
下列说法错误的是
A.步骤(1)(2)的操作分别是溶解、过滤和萃取、分液
B.步骤(3)的操作是蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C.步骤(4)中从有机层溶液中得到甲苯的方法是蒸馏
D.提纯粗产品可以采用过滤的方法
13.已知晶体属立方晶系,晶胞边长为a nm。将掺杂到该晶胞中,可得到一种高性能的p型太阳能电池材料,其结构单元如图所示。假定掺杂后的晶胞参数不发生变化,下列说法正确的是
A.基态Ni原子核外电子排布式为[Ar] B.Ni和Mg间的最短距离是nm
C.晶体中,与Ni距离最近的O有4个 D.该物质的化学式为
14.25℃时,用0.1 mol·L-1 NaOH溶液滴定某二元弱酸H2A,H2A被滴定分数、pH及物种分布分数δ[δ(X)=]如图所示:
下列说法错误的是
A.用NaOH溶液滴定0.1 mol·L-1 NaHA溶液可用酚酞作指示剂
B.0.1 mol·L-1 NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)
C.0.1 mol·L-1 Na2A溶液中:c(Na+)
二、解答题
15.绿矾(晶体)用途广泛,某同学以废弃小铁钉制备少量绿矾。步骤如下:
步骤1:取4g废弃小铁钉,先用浓度为10%的碳酸钠溶液清除油渍,然后用倾斜法倒去碳酸钠溶液,再用蒸馏水洗涤2~3次;
步骤2:将步骤1得到的铁钉加入如图所示的仪器X中,再加入15mL 4.6硫酸溶液。控温70~80℃加热10~15分钟,将所得溶液经趁热过滤、冷却结晶、过滤、洗涤、干燥,得到。
回答下列问题:
(1)仪器X的名称为 。
(2)通入的目的是 。
(3)步骤1“倾斜法”是分离固体和液体方法的一种操作,操作如图所示。与普通过滤相比,“倾斜法”的优点是 。
(4)步骤2控温70~80℃的加热方式为 ,简述用冷水洗涤晶体的操作: 。
(5)测定的纯度:准确称取3.00g 样品,加适量水溶解,配成100mL溶液,取20.00mL溶液置于锥形瓶中,用0.02的酸性标准溶液滴定(杂质不与酸性标准溶液反应),经3次测定,每次消耗溶液的体积如下:
实验序号 1 2 3
消耗溶液体积/mL 19.98 20.58 20.02
产品中的质量分数为 (保留四位有效数字)。
(6)利用赤铁矿渣(主要成分为、和少量)为原料也可以制备晶体,请补充完整相应的实验方案:取一定量的赤铁矿渣,在不断搅拌下,分批次加入 中,过滤,用 ,生成沉淀、过滤、洗涤后,将沉淀加入1.0的硫酸溶液中,同时加入 ,充分反应后,过滤,向滤液中加乙醇,在恒温水浴槽中冷却结晶,过滤,用丙酮洗涤,干燥,得晶体。(已知该实验中pH=3.5时,沉淀完全;pH=4.1时,开始沉淀。实验中必须使用的试剂:1.0的H2SO4、1.0的NaOH、铁粉)
16.一种以高镁盐湖卤水{主要含、、、、和}为原料制备钴酸锂()的工艺流程如图所示:
已知:常温下,、、、、;相关化合物的溶解度与温度的关系如图所示。
回答下列问题:
(1)已知在水中存在如下平衡:。加入盐酸能实现“脱硼”的原因是 (语言叙述)。
(2)步骤“精制Ⅰ”“精制Ⅱ”是分两次进行深度除镁。
①滤渣Ⅰ和滤渣Ⅱ主要成分中都含有的沉淀物质是 (填化学式)。
②“精制Ⅰ”后溶液中的浓度为2.2,则常温下“精制Ⅱ”时浓度应控制在 以下(保留小数点后一位)。
(3)“系列操作沉锂”包括先加入适量饱和溶液,蒸发浓缩、 ,洗涤,干燥。
(4)滤液Ⅰ中含有较多的阳离子是 (填离子符号)。
(5)“高温固相合成”时,具体做法为按Li/Co的物质的量之比为1∶1调配好和,然后在空气氛围中煅烧,该过程的化学方程式为 。
(6)一种富锂超离子导体的立方晶胞如图所示,其中晶胞参数为a pm。
①该晶体的密度为 (阿伏加德罗常数的值用表示,写出计算式即可)。
②若该晶胞以Cl为顶点,则Li在晶胞中的位置为 。
17.将转化为甲醇,对于能源、环境等具有重要意义。在加氢制甲醇的反应体系中,主要发生反应的热化学方程式如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)相关键能数据如表所示,反应Ⅲ的 。
化学键 H—H C≡O O—H C=O
键能/() 436 1071 464 803
(2)某条件下,假设仅发生反应Ⅰ,该反应的反应速率,,该反应的平衡常数,则x= ,y= 。
(3)一定条件,将和按物质的量之比为1∶3的投料比充入某刚性密闭容器中,发生反应Ⅰ,测得的物质的量随反应时间的变化如图所示。
①0~5min,反应中共放出的热量为 kJ。
②9min时改变的外界条件可能是 。
(4)在体积为1L的恒容密闭容器中通入1mol 和3mol ,发生上述反应Ⅰ、Ⅱ、Ⅲ,的平衡转化率随温度和压强的变化如图所示。
①压强、、由大到小的顺序为 。
②在某温度下,平衡时容器中(g)为0.3mol,n(CO)(g)为0.3mol,则反应Ⅲ的平衡常数K= 。
(5)下列有关说法正确的是 (填字母)。
A.的水溶液能导电,故属于电解质
B.中心原子碳的价层电子对数为4
C.干冰晶胞中,一个分子周围有12个分子紧邻
D.分子中存在大键
(6)甲醇燃料电池的工作原理如图所示,则X电极的电极反应式为 。
18.有机物G是制药中间体。G的一种合成路线如下:
回答下列问题:
(1)F中官能团的名称为 。
(2)C的化学名称为 。
(3)B、D的结构简式分别为 、 。
(4)B→C的反应类型为 。
(5)满足下列条件的A的芳香族同分异构体有 种(不含立体异构),其中分子中含有手性碳原子的结构简式为 (任写一种)。
①苯环上有两个取代基;
②能与溶液发生显色反应;
③能发生银镜反应和水解反应;
④分子中除了含苯环外,不含其他环状结构。
(6)以、为原料制备的合成路线流程图如下:
,其中X、Y、Z的结构简式分别为 、 、 。
参考答案
1.D
2.B
3.D
4.A
5.A
6.C
7.D
8.B
9.C
10.B
11.C
12.D
13.B
14.C
15.(1)三颈烧瓶
(2)排尽装置内的空气,防止被氧化,避免制备的绿矾不纯
(3)操作简单、分离速率快、产品损耗少
(4) 水浴加热 沿玻璃棒向漏斗(过滤器)中加水至水浸没沉淀,待水自然流下,重复2~3次
(5)92.67%
(6) 足量1.0的 1.0的NaOH溶液调节溶液pH到3.5~4.1 过量铁粉
16.(1)加入盐酸会增大,各平衡逆向移动,使得沉淀增多,起到脱硼作用
(2)
(3)趁热过滤
(4)
(5)
(6) 面心
17.(1)+43
(2) 1 3
(3) 19.8 降温或分离生成物
(4) 0.25
(5)CD
(6)
18.(1)羟基、酯基
(2)苯丁酸乙酯(或4-苯基丁酸乙酯)
(3)
(4)取代(或酯化)反应
(5) 24 (邻、间、对任写一种均可)
(6)
同课章节目录
