1.1 课时3 物质的转化课件(共18张PPT) 2025-2026学年人教版(2019)高中化学必修第一册
文档属性
| 名称 | 1.1 课时3 物质的转化课件(共18张PPT) 2025-2026学年人教版(2019)高中化学必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 00:00:00 | ||
图片预览




文档简介
(共18张PPT)
物质的转化
第一章 物质的分类及转化
1、掌握酸碱盐的性质及同类物质性质的相似性。
2、理解化学反应的四种基本反应类型。
3、通过元素、物质的分类深化物质间的联系,认识物质间的转化关系。
4、通过物质间的转化关系,探究工业生产时原料及生产条件的选择。
学习目标
物质的转化—自然界
地壳
变动
石油
煤
石油
情境创设
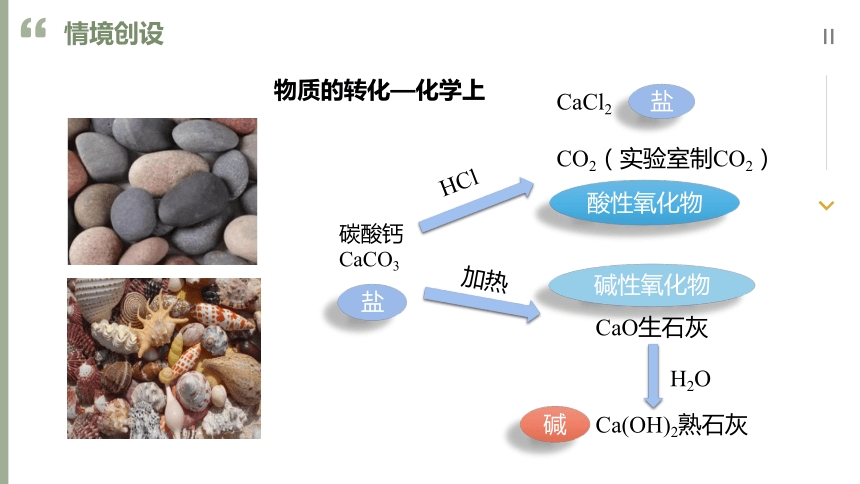
物质的转化—化学上
碳酸钙
CaCO3
HCl
CaCl2
CO2(实验室制CO2)
加热
CaO生石灰
H2O
Ca(OH)2熟石灰
盐
盐
酸性氧化物
碱性氧化物
碱
情境创设
同类物质往往具有相似的性质。例如:通过初中化学的学习,我们已经知道盐酸、硫酸等酸,NaOH、Ca(OH)2等碱,Na2CO3、K2CO3等碳酸盐各具有相似的化学性质。
一、酸、碱、盐及其氧化物的性质
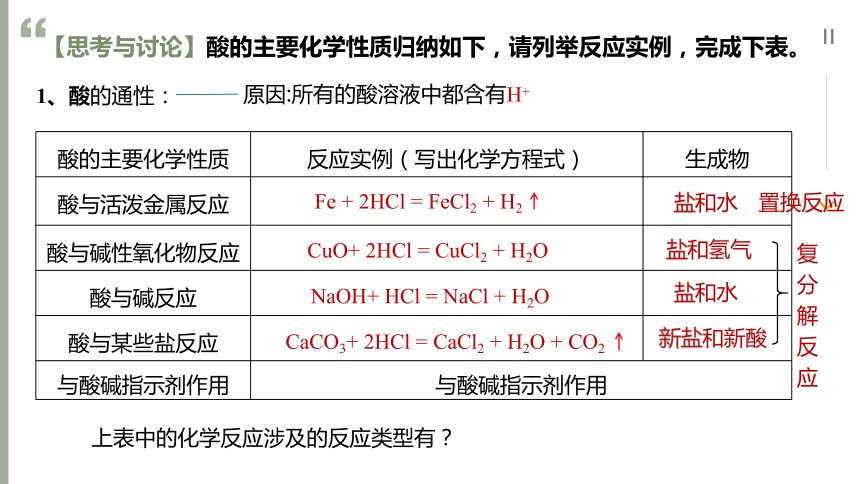
【思考与讨论】酸的主要化学性质归纳如下,请列举反应实例,完成下表。
酸的主要化学性质 反应实例(写出化学方程式) 生成物
酸与活泼金属反应
酸与碱性氧化物反应
酸与碱反应
酸与某些盐反应
与酸碱指示剂作用 与酸碱指示剂作用 Fe + 2HCl = FeCl2 + H2
CuO+ 2HCl = CuCl2 + H2O
NaOH+ HCl = NaCl + H2O
CaCO3+ 2HCl = CaCl2 + H2O + CO2
1、酸的通性:
原因:所有的酸溶液中都含有H+
盐和水
盐和氢气
盐和水
新盐和新酸
置换反应
复分解反应
上表中的化学反应涉及的反应类型有?
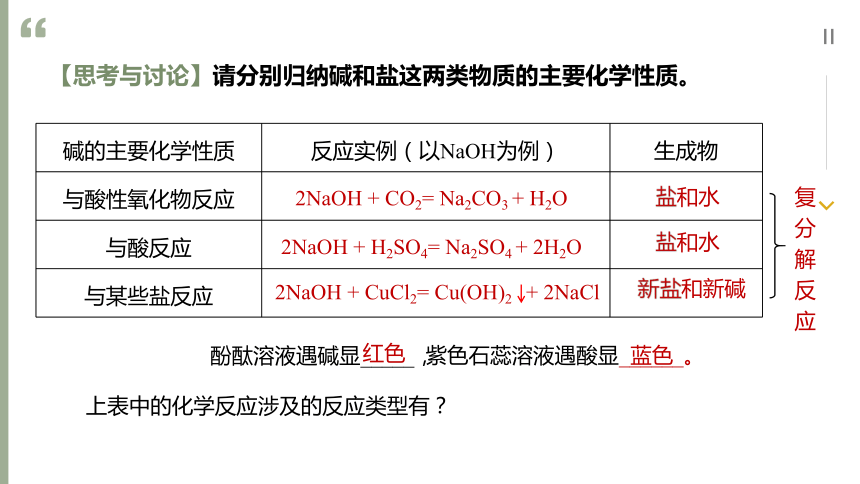
【思考与讨论】请分别归纳碱和盐这两类物质的主要化学性质。
碱的主要化学性质 反应实例(以NaOH为例) 生成物
与酸性氧化物反应
与酸反应
与某些盐反应
2NaOH + CO2= Na2CO3 + H2O
2NaOH + H2SO4= Na2SO4 + 2H2O
2NaOH + CuCl2= Cu(OH)2 + 2NaCl
盐和水
盐和水
新盐和新碱
复分解反应
酚酞溶液遇碱显_____,
红色
紫色石蕊溶液遇酸显______。
蓝色
上表中的化学反应涉及的反应类型有?
【思考与讨论】请分别归纳碱和盐这两类物质的主要化学性质。
盐的主要化学性质 反应实例(写出化学方程式) 生成物
与酸反应
与某些碱反应
与某些盐反应
与金属反应
Na2CO3 + H2SO4= Na2 SO4 + H2O + CO2
Zn + CuSO4 = ZnSO4 + Cu
Na2CO3 + Ca(OH)2= CaCO3 + 2NaOH
Na2CO3 + CaCl2= CaCO3 + 2NaCl
新盐和新碱
新盐和新酸
新盐和新盐
新盐+新金属单质
复分解反应
酸的通性(H+体现)
活泼金属 + 酸 →盐 + 氢气(置换反应)
金属氧化物 + 酸 → 盐 + 水(复分解反应)
弱酸盐 + 强酸 → 弱酸 + 强酸盐(复分解反应)
碱 + 酸 → 盐 + 水(复分解反应)
酸碱指示剂(紫色石蕊试液变红色、无色酚酞试液不变色)
归纳总结
碱的通性(OH-体现)
酸+ 碱 →盐 + 水(复分解反应)
酸性氧化物 + 碱 → 盐 + 水(复分解反应)
盐 + 碱 → 新碱 + 新盐(生成的新碱和新盐至少有一种是沉淀,复分解反应)
酸碱指示剂(紫色石蕊试液变蓝色、无色酚酞试液变红色)
归纳总结
盐的通性
活泼金属+ 不活泼金属的盐 →不活泼金属 + 活泼金属的盐(置换反应)
盐1 + 盐2 → 盐3 + 盐4(复分解反应)
盐 + 碱 → 新盐 + 新碱(复分解反应)
盐 + 酸 → 新盐 + 新酸(复分解反应)
归纳总结
二、物质的转化
根据物质的组成和性质
物质之间的转化
化学变化
元素是不会改变的
最基本的依据
制取某类物质的可能方法
确定
【思考与讨论】写出下列物质之间转化的化学方程式,体会由金属单质到盐、非金属单质到盐的转化关系。
Ca → CaO → Ca(OH)2 → CaSO4
C → CO2 → H2CO3 → CaCO3
2Ca + O2 = 2CaO
CaO + H2O = Ca(OH)2
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
CO2 + H2O = H2CO3
C + O2 CO2
点燃
H2CO3 + Ca(OH)2 = CaCO3 + 2H2O
归纳总结单质到盐的一般转化关系:
O2
H2O
酸或酸性氧化物
部分金属单质
碱性
氧化物
碱
盐
O2
H2O
碱或碱性氧化物
部分非金属单质
酸性
氧化物
酸
盐
化合反应
化合反应
酸或酸性氧化物
化合反应
化合反应
碱或碱性氧化物
二、物质的转化
确定制取物质的方法
(1)确定依据
(2)实例——NaOH的制备方法
①碱性氧化物与水反应
Na2O + H2O ═ 2NaOH
Na2O作为原料,来源少、成本高
②盐与另一种碱反应
Na2CO3 + Ca(OH)2 ═ CaCO3↓+ 2NaOH
在工业生产中要制取某种物质,除了要考虑反应进行的可能性,还要考虑:
①原料来源、②成本高低、③设备要求等因素,以选取最适当的方法。
二、物质的转化
总结:单质、氧化物、酸、碱、盐之间的转化
1.分类法可用于预测物质的性质及其变化规律。下列物质的分类与性质预测对应关系不正确的是( )
选项 物质 类别 性质预测
A SO2 酸性氧化物 能与水反应生成酸
B CO 还原剂 能与Fe2O3等氧化剂反应
C K2CO3 钾盐 能与酸反应
D H2SiO3 酸 能与NaOH反应生成盐
当堂练习
C
2.下列各组物质之间可以按下图所示关系直接转化的是( )
A.Fe→Fe2O3→FeSO4→Fe
B.CO→CO2→H2CO3→CO
C.NaOH→NaCl→Na2CO3→NaOH
D.HCl→CuCl2→BaCl2→HCl
D
当堂练习
物质的转化
第一章 物质的分类及转化
1、掌握酸碱盐的性质及同类物质性质的相似性。
2、理解化学反应的四种基本反应类型。
3、通过元素、物质的分类深化物质间的联系,认识物质间的转化关系。
4、通过物质间的转化关系,探究工业生产时原料及生产条件的选择。
学习目标
物质的转化—自然界
地壳
变动
石油
煤
石油
情境创设
物质的转化—化学上
碳酸钙
CaCO3
HCl
CaCl2
CO2(实验室制CO2)
加热
CaO生石灰
H2O
Ca(OH)2熟石灰
盐
盐
酸性氧化物
碱性氧化物
碱
情境创设
同类物质往往具有相似的性质。例如:通过初中化学的学习,我们已经知道盐酸、硫酸等酸,NaOH、Ca(OH)2等碱,Na2CO3、K2CO3等碳酸盐各具有相似的化学性质。
一、酸、碱、盐及其氧化物的性质
【思考与讨论】酸的主要化学性质归纳如下,请列举反应实例,完成下表。
酸的主要化学性质 反应实例(写出化学方程式) 生成物
酸与活泼金属反应
酸与碱性氧化物反应
酸与碱反应
酸与某些盐反应
与酸碱指示剂作用 与酸碱指示剂作用 Fe + 2HCl = FeCl2 + H2
CuO+ 2HCl = CuCl2 + H2O
NaOH+ HCl = NaCl + H2O
CaCO3+ 2HCl = CaCl2 + H2O + CO2
1、酸的通性:
原因:所有的酸溶液中都含有H+
盐和水
盐和氢气
盐和水
新盐和新酸
置换反应
复分解反应
上表中的化学反应涉及的反应类型有?
【思考与讨论】请分别归纳碱和盐这两类物质的主要化学性质。
碱的主要化学性质 反应实例(以NaOH为例) 生成物
与酸性氧化物反应
与酸反应
与某些盐反应
2NaOH + CO2= Na2CO3 + H2O
2NaOH + H2SO4= Na2SO4 + 2H2O
2NaOH + CuCl2= Cu(OH)2 + 2NaCl
盐和水
盐和水
新盐和新碱
复分解反应
酚酞溶液遇碱显_____,
红色
紫色石蕊溶液遇酸显______。
蓝色
上表中的化学反应涉及的反应类型有?
【思考与讨论】请分别归纳碱和盐这两类物质的主要化学性质。
盐的主要化学性质 反应实例(写出化学方程式) 生成物
与酸反应
与某些碱反应
与某些盐反应
与金属反应
Na2CO3 + H2SO4= Na2 SO4 + H2O + CO2
Zn + CuSO4 = ZnSO4 + Cu
Na2CO3 + Ca(OH)2= CaCO3 + 2NaOH
Na2CO3 + CaCl2= CaCO3 + 2NaCl
新盐和新碱
新盐和新酸
新盐和新盐
新盐+新金属单质
复分解反应
酸的通性(H+体现)
活泼金属 + 酸 →盐 + 氢气(置换反应)
金属氧化物 + 酸 → 盐 + 水(复分解反应)
弱酸盐 + 强酸 → 弱酸 + 强酸盐(复分解反应)
碱 + 酸 → 盐 + 水(复分解反应)
酸碱指示剂(紫色石蕊试液变红色、无色酚酞试液不变色)
归纳总结
碱的通性(OH-体现)
酸+ 碱 →盐 + 水(复分解反应)
酸性氧化物 + 碱 → 盐 + 水(复分解反应)
盐 + 碱 → 新碱 + 新盐(生成的新碱和新盐至少有一种是沉淀,复分解反应)
酸碱指示剂(紫色石蕊试液变蓝色、无色酚酞试液变红色)
归纳总结
盐的通性
活泼金属+ 不活泼金属的盐 →不活泼金属 + 活泼金属的盐(置换反应)
盐1 + 盐2 → 盐3 + 盐4(复分解反应)
盐 + 碱 → 新盐 + 新碱(复分解反应)
盐 + 酸 → 新盐 + 新酸(复分解反应)
归纳总结
二、物质的转化
根据物质的组成和性质
物质之间的转化
化学变化
元素是不会改变的
最基本的依据
制取某类物质的可能方法
确定
【思考与讨论】写出下列物质之间转化的化学方程式,体会由金属单质到盐、非金属单质到盐的转化关系。
Ca → CaO → Ca(OH)2 → CaSO4
C → CO2 → H2CO3 → CaCO3
2Ca + O2 = 2CaO
CaO + H2O = Ca(OH)2
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
CO2 + H2O = H2CO3
C + O2 CO2
点燃
H2CO3 + Ca(OH)2 = CaCO3 + 2H2O
归纳总结单质到盐的一般转化关系:
O2
H2O
酸或酸性氧化物
部分金属单质
碱性
氧化物
碱
盐
O2
H2O
碱或碱性氧化物
部分非金属单质
酸性
氧化物
酸
盐
化合反应
化合反应
酸或酸性氧化物
化合反应
化合反应
碱或碱性氧化物
二、物质的转化
确定制取物质的方法
(1)确定依据
(2)实例——NaOH的制备方法
①碱性氧化物与水反应
Na2O + H2O ═ 2NaOH
Na2O作为原料,来源少、成本高
②盐与另一种碱反应
Na2CO3 + Ca(OH)2 ═ CaCO3↓+ 2NaOH
在工业生产中要制取某种物质,除了要考虑反应进行的可能性,还要考虑:
①原料来源、②成本高低、③设备要求等因素,以选取最适当的方法。
二、物质的转化
总结:单质、氧化物、酸、碱、盐之间的转化
1.分类法可用于预测物质的性质及其变化规律。下列物质的分类与性质预测对应关系不正确的是( )
选项 物质 类别 性质预测
A SO2 酸性氧化物 能与水反应生成酸
B CO 还原剂 能与Fe2O3等氧化剂反应
C K2CO3 钾盐 能与酸反应
D H2SiO3 酸 能与NaOH反应生成盐
当堂练习
C
2.下列各组物质之间可以按下图所示关系直接转化的是( )
A.Fe→Fe2O3→FeSO4→Fe
B.CO→CO2→H2CO3→CO
C.NaOH→NaCl→Na2CO3→NaOH
D.HCl→CuCl2→BaCl2→HCl
D
当堂练习
