1.3 课时1 氧化还原反应 课件 (共19张PPT) 2025-2026学年人教版(2019)高中化学必修第一册
文档属性
| 名称 | 1.3 课时1 氧化还原反应 课件 (共19张PPT) 2025-2026学年人教版(2019)高中化学必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 5.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
氧化还原反应
第一章 物质的分类及转化
1、能够从多角度认识氧化还原反应;
2、理解氧化还原反应的特征和实质;
3、掌握氧化还原反应与四大基本反应类型的关系。
学习目标
无处不在的氧化还原反应
苹果变色
钢铁生锈
电池放电
煤炭燃烧
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说。
在初中,我们根据反应物质中得到氧或失去氧,把化学反应分为氧化反应和还原反应。那么,只有得氧(或者失氧)的反应才是氧化反应(或还原反应)吗?氧化反应和还原反应是分别发生的吗?这类反应的本质是什么?
阶段一:得失氧的角度
氧化还原反应概念发展史—从得失氧的角度
高温
高温
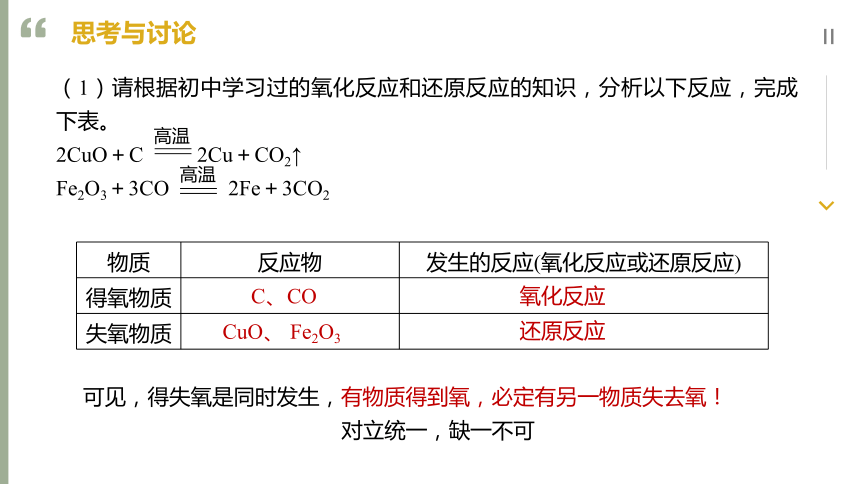
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质
失氧物质
氧化反应
还原反应
C、CO
CuO、 Fe2O3
思考与讨论
可见,得失氧是同时发生,有物质得到氧,必定有另一物质失去氧!
对立统一,缺一不可
(1)请根据初中学习过的氧化反应和还原反应的知识,分析以下反应,完成下表。
2CuO+C 2Cu+CO2↑
Fe2O3+3CO 2Fe+3CO2
2CuO + C
2Cu + CO2
+2 -2 0 0 +4-2
化合价降低,
化合价升高,
失氧,还原反应
得氧,氧化反应
化合价降低,
化合价升高,
失氧,还原反应
Fe2O 3 + 3CO 2Fe + 3CO2
+3 -2 +2-2 0 +4-2
得氧,氧化反应
(2)请标出以上反应中各物质所含元素的化合价,比较反应前后价态有无变化
(3)讨论:在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
思考与讨论
复习回顾
常见元素的化合价
一价氢氯钾钠银
二价氧钙钡镁锌
三铝四硅五价磷
单质化合价为零
二三铁,二四碳
二四六硫都齐全
铜汞二价最常见
负一氢氧硝酸根
负二硫酸碳酸根
还有正一是铵根
阶段二:化合价角度
物质所含元素的化合价
升高
被氧化
氧化反应
降低
被还原
还原反应
结论:凡是有元素化合价升降的化学反应称之为氧化还原反应。
Fe + CuSO4 FeSO4+Cu
+2
0
0
+2
化合价升高
氧化反应
化合价降低
还原反应
虽然没有物质得氧、失氧,但反应前后有元素化合价的变化。
阶段三:电子转移角度
1.化学反应的实质:化学反应的实质是原子之间的重新组合。从原子结构来看,原子核外的电子是分层排布的。原子核外电子的排布,特别是最外层的电子数目与化学反应有密切关系。化合价的升降与电子转移密切相关。
下列原子结构示意图中,哪些原子容易得到电子,哪些原子容易失去电子?
当原子最外层电子数为多少时达到稳定结构?
八隅体规则(或称八电子规则):
当原子的最外层电子数为8(只有一个电子层时,为2)最稳定。
思
考
+11+17Na+Cl-NaCl0 0 +1 -1失去2×e-、化合价升高,被氧化得到2×e-、化合价降低,被还原结论:化合价升降的原因——①电子得失+17+11Cl-Na+失去一个e-得到一个e-2.从微观的角度分析Na和Cl2反应0 0 +1 -1电子对偏离,化合价升高,被氧化电子对偏向,化合价降低,被还原结论:化合价升降的原因——②共用电子对偏移HCl均不容易失去e-共用电子对偏向氯,偏离氢+17+1HCl+1-1+1+172.从微观的角度分析Na和Cl2反应氧化还原反应的定义:凡是有电子转移(得失或偏移)的反应,都是氧化还原反应。
氧化还原反应的本质:电子转移(得失或偏移)。
氧化还原反应中电子转移与元素化合价升降的关系:
元素的化合价升高,原子失去电子(电子对偏离),物质被氧化,发生氧化反应;
元素的化合价降低,原子得到电子(电子对偏向),物质被还原,发生还原反应。
升-失-氧
降-得-还
归纳总结
推测下列反应属于四大反应类型中的哪一类,是否为氧化还原反应?
2Na + Cl2 === 2NaCl
Δ
H2O + CaO === Ca(OH)2
CaCO3 === CaO + CO2 ↑
高温
H2O2 === 2 H2O + O2 ↑
MnO2
H2SO4 + Fe == FeSO4 + H2↑
HCl + NaOH == NaCl + H2O
化合反应
√
×
×
√
√
×
CuSO4 + Fe == FeSO4 + Cu
√
BaCl2 + H2SO4 == BaSO4↓+ 2HCl
×
分解反应
置换反应
复分解反应
判断是否为氧化还原反应依据:元素化合价是否有升降
1.置换反应全是氧化还原反应
2.复分解反应不是氧化还原反应
3.有单质参加的化合和有单质生成的分解是氧化还原反应
观察下列反应,它们是氧化还原反应吗?属于四大基本反应类型吗?
有的反应虽不属于四大基本反应类型,但属于氧化还原反应。
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
3O2 2O3
小结:氧化还原反应与四种基本类型反应的关系
总结
特征:有元素化合价升降
化学反应
氧化还原反应
本质:有电子转移
元素化合价升高
失电子(或共用电子对偏离)
发生氧化反应
元素化合价降低
得电子(或共用电子对偏向)
发生还原反应
课堂训练
1. 判断正误(正确的打“√”,错误的打“×”)。
(1)凡有元素化合价升降的化学反应一定是氧化还原反应。 ( )
(2)在反应CuO+2HCl =CuCl2+H2O中有得氧、失氧的发生,该反应是氧化还原反应( )
(3)氧化还原反应的实质是元素化合价的升降。( )
(4)氧化还原反应中化合价的升高和降低可以发生在同一物质的不同元素之间。( )
(5)氧化还原反应中,被氧化和被还原的物质必须是不同的物质。 ( )
√
×
×
√
×
2. 下列化学反应中溴元素仅被氧化的是( )
A.2NaBr+Cl2===2NaCl+Br2
B.Br2+2NaI===2NaBr+I2
C.3Br2+6NaOH===5NaBr+NaBrO3+3H2O
D.HBr+NaOH===NaBr+H2O
A
3. 下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=== FeSO4+Cu
B.AgNO3+NaCl=== AgCl↓+NaNO3
C.Fe2O3+3CO === 2Fe+3CO2
D.2KMnO4 === K2MnO4+MnO2+O2↑
化合反应: A+B==C
分解反应: A==B+C
置换反应: AC+B==AB+C
复分解反应: AB+CD=AD+BC
四种基本反应类型:
C
课堂训练
4. 氧化还原反应与四种基本反应类型的关系如图所示,
下列化学反应属于阴影区域的是( )
A.2HClO 2HCl+O2↑
B.NH4HCO3 NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.Fe2O3+3CO 2Fe+3CO2
D
Δ
Δ
高温
课堂训练
5.下列反应(条件均省略)中,反应物中的各种元素都参加了氧化还原反应的是( )
A.2KNO3+S+3C=K2S+N2↑+3CO2↑
B.2KMnO4=K2MnO4+MnO2+O2↑
C.4HNO3=2H2O+4NO2↑+O2↑
D.HgS+O2=Hg+SO2
D
课堂训练
氧化还原反应
第一章 物质的分类及转化
1、能够从多角度认识氧化还原反应;
2、理解氧化还原反应的特征和实质;
3、掌握氧化还原反应与四大基本反应类型的关系。
学习目标
无处不在的氧化还原反应
苹果变色
钢铁生锈
电池放电
煤炭燃烧
1774年,拉瓦锡创立氧化学说(既燃烧是物质与氧气的反应)推翻了流行千年的燃素说。
在初中,我们根据反应物质中得到氧或失去氧,把化学反应分为氧化反应和还原反应。那么,只有得氧(或者失氧)的反应才是氧化反应(或还原反应)吗?氧化反应和还原反应是分别发生的吗?这类反应的本质是什么?
阶段一:得失氧的角度
氧化还原反应概念发展史—从得失氧的角度
高温
高温
物质 反应物 发生的反应(氧化反应或还原反应)
得氧物质
失氧物质
氧化反应
还原反应
C、CO
CuO、 Fe2O3
思考与讨论
可见,得失氧是同时发生,有物质得到氧,必定有另一物质失去氧!
对立统一,缺一不可
(1)请根据初中学习过的氧化反应和还原反应的知识,分析以下反应,完成下表。
2CuO+C 2Cu+CO2↑
Fe2O3+3CO 2Fe+3CO2
2CuO + C
2Cu + CO2
+2 -2 0 0 +4-2
化合价降低,
化合价升高,
失氧,还原反应
得氧,氧化反应
化合价降低,
化合价升高,
失氧,还原反应
Fe2O 3 + 3CO 2Fe + 3CO2
+3 -2 +2-2 0 +4-2
得氧,氧化反应
(2)请标出以上反应中各物质所含元素的化合价,比较反应前后价态有无变化
(3)讨论:在以上反应中,物质发生氧化反应或还原反应,与物质所含元素化合价的升高或降低有什么关系?
思考与讨论
复习回顾
常见元素的化合价
一价氢氯钾钠银
二价氧钙钡镁锌
三铝四硅五价磷
单质化合价为零
二三铁,二四碳
二四六硫都齐全
铜汞二价最常见
负一氢氧硝酸根
负二硫酸碳酸根
还有正一是铵根
阶段二:化合价角度
物质所含元素的化合价
升高
被氧化
氧化反应
降低
被还原
还原反应
结论:凡是有元素化合价升降的化学反应称之为氧化还原反应。
Fe + CuSO4 FeSO4+Cu
+2
0
0
+2
化合价升高
氧化反应
化合价降低
还原反应
虽然没有物质得氧、失氧,但反应前后有元素化合价的变化。
阶段三:电子转移角度
1.化学反应的实质:化学反应的实质是原子之间的重新组合。从原子结构来看,原子核外的电子是分层排布的。原子核外电子的排布,特别是最外层的电子数目与化学反应有密切关系。化合价的升降与电子转移密切相关。
下列原子结构示意图中,哪些原子容易得到电子,哪些原子容易失去电子?
当原子最外层电子数为多少时达到稳定结构?
八隅体规则(或称八电子规则):
当原子的最外层电子数为8(只有一个电子层时,为2)最稳定。
思
考
+11+17Na+Cl-NaCl0 0 +1 -1失去2×e-、化合价升高,被氧化得到2×e-、化合价降低,被还原结论:化合价升降的原因——①电子得失+17+11Cl-Na+失去一个e-得到一个e-2.从微观的角度分析Na和Cl2反应0 0 +1 -1电子对偏离,化合价升高,被氧化电子对偏向,化合价降低,被还原结论:化合价升降的原因——②共用电子对偏移HCl均不容易失去e-共用电子对偏向氯,偏离氢+17+1HCl+1-1+1+172.从微观的角度分析Na和Cl2反应氧化还原反应的定义:凡是有电子转移(得失或偏移)的反应,都是氧化还原反应。
氧化还原反应的本质:电子转移(得失或偏移)。
氧化还原反应中电子转移与元素化合价升降的关系:
元素的化合价升高,原子失去电子(电子对偏离),物质被氧化,发生氧化反应;
元素的化合价降低,原子得到电子(电子对偏向),物质被还原,发生还原反应。
升-失-氧
降-得-还
归纳总结
推测下列反应属于四大反应类型中的哪一类,是否为氧化还原反应?
2Na + Cl2 === 2NaCl
Δ
H2O + CaO === Ca(OH)2
CaCO3 === CaO + CO2 ↑
高温
H2O2 === 2 H2O + O2 ↑
MnO2
H2SO4 + Fe == FeSO4 + H2↑
HCl + NaOH == NaCl + H2O
化合反应
√
×
×
√
√
×
CuSO4 + Fe == FeSO4 + Cu
√
BaCl2 + H2SO4 == BaSO4↓+ 2HCl
×
分解反应
置换反应
复分解反应
判断是否为氧化还原反应依据:元素化合价是否有升降
1.置换反应全是氧化还原反应
2.复分解反应不是氧化还原反应
3.有单质参加的化合和有单质生成的分解是氧化还原反应
观察下列反应,它们是氧化还原反应吗?属于四大基本反应类型吗?
有的反应虽不属于四大基本反应类型,但属于氧化还原反应。
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
3O2 2O3
小结:氧化还原反应与四种基本类型反应的关系
总结
特征:有元素化合价升降
化学反应
氧化还原反应
本质:有电子转移
元素化合价升高
失电子(或共用电子对偏离)
发生氧化反应
元素化合价降低
得电子(或共用电子对偏向)
发生还原反应
课堂训练
1. 判断正误(正确的打“√”,错误的打“×”)。
(1)凡有元素化合价升降的化学反应一定是氧化还原反应。 ( )
(2)在反应CuO+2HCl =CuCl2+H2O中有得氧、失氧的发生,该反应是氧化还原反应( )
(3)氧化还原反应的实质是元素化合价的升降。( )
(4)氧化还原反应中化合价的升高和降低可以发生在同一物质的不同元素之间。( )
(5)氧化还原反应中,被氧化和被还原的物质必须是不同的物质。 ( )
√
×
×
√
×
2. 下列化学反应中溴元素仅被氧化的是( )
A.2NaBr+Cl2===2NaCl+Br2
B.Br2+2NaI===2NaBr+I2
C.3Br2+6NaOH===5NaBr+NaBrO3+3H2O
D.HBr+NaOH===NaBr+H2O
A
3. 下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4=== FeSO4+Cu
B.AgNO3+NaCl=== AgCl↓+NaNO3
C.Fe2O3+3CO === 2Fe+3CO2
D.2KMnO4 === K2MnO4+MnO2+O2↑
化合反应: A+B==C
分解反应: A==B+C
置换反应: AC+B==AB+C
复分解反应: AB+CD=AD+BC
四种基本反应类型:
C
课堂训练
4. 氧化还原反应与四种基本反应类型的关系如图所示,
下列化学反应属于阴影区域的是( )
A.2HClO 2HCl+O2↑
B.NH4HCO3 NH3↑+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.Fe2O3+3CO 2Fe+3CO2
D
Δ
Δ
高温
课堂训练
5.下列反应(条件均省略)中,反应物中的各种元素都参加了氧化还原反应的是( )
A.2KNO3+S+3C=K2S+N2↑+3CO2↑
B.2KMnO4=K2MnO4+MnO2+O2↑
C.4HNO3=2H2O+4NO2↑+O2↑
D.HgS+O2=Hg+SO2
D
课堂训练
