1.2 课时1 电解质的电离 课件 (共32张PPT) 2025-2026学年人教版(2019)高中化学必修第一册
文档属性
| 名称 | 1.2 课时1 电解质的电离 课件 (共32张PPT) 2025-2026学年人教版(2019)高中化学必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 31.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 22:42:44 | ||
图片预览



文档简介
(共32张PPT)
第一章 物质及其变化
课堂导入
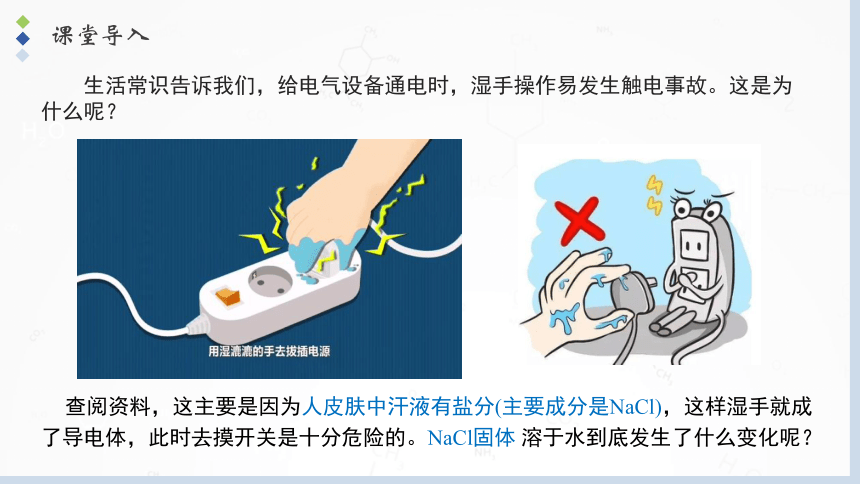
生活常识告诉我们,给电气设备通电时,湿手操作易发生触电事故。这是为什么呢?
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时去摸开关是十分危险的。NaCl固体 溶于水到底发生了什么变化呢?
课堂导入
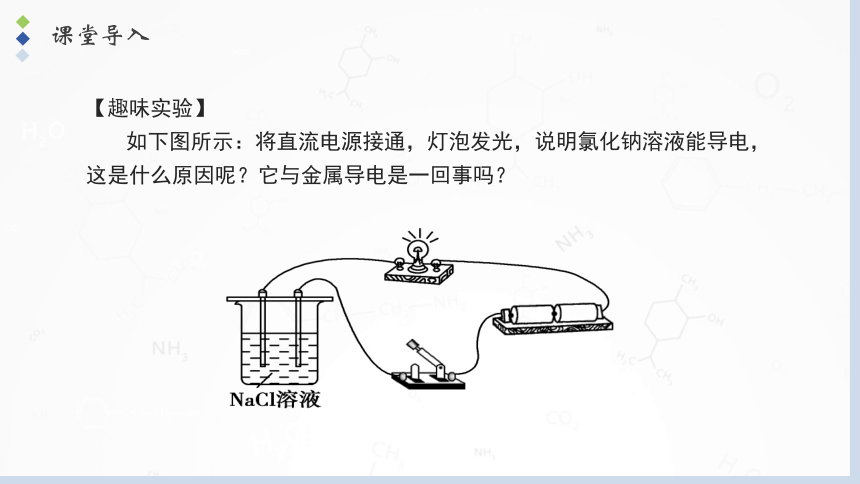
【趣味实验】
如下图所示:将直流电源接通,灯泡发光,说明氯化钠溶液能导电,这是什么原因呢?它与金属导电是一回事吗?
新知讲解
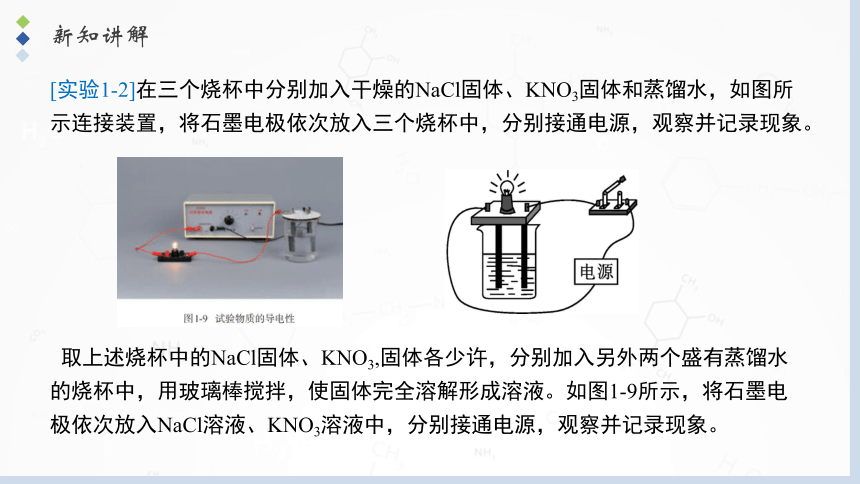
[实验1-2]在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3,固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图1-9所示,将石墨电极依次放入NaCl溶液、KNO3溶液中,分别接通电源,观察并记录现象。
新知讲解
[补充实验]试验物质的导电性视频
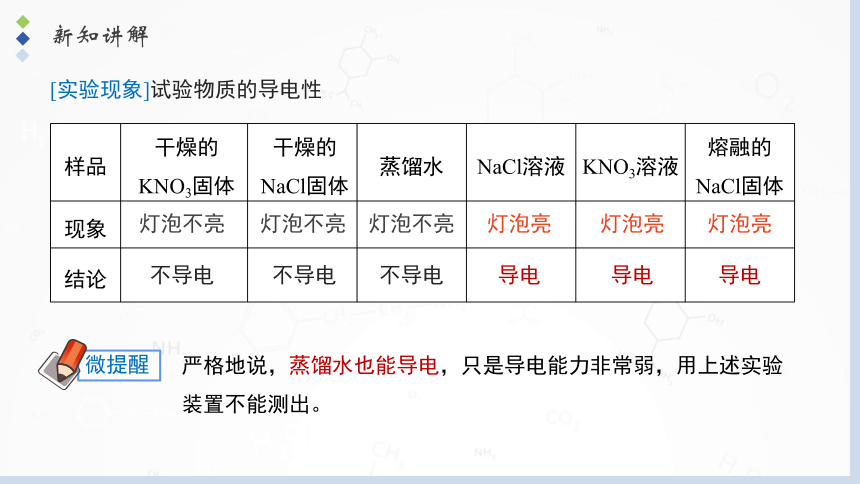
[实验现象]试验物质的导电性
新知讲解
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
现象
结论
灯泡不亮
不导电
灯泡不亮
不导电
灯泡不亮
不导电
灯泡亮
导电
灯泡亮
导电
灯泡亮
导电
微提醒
严格地说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出。
新知讲解
金属导电:有自由移动的电子。
氯化钠溶液导电:
类比
【氯化钠在水溶液里导电】
有自由移动的离子。
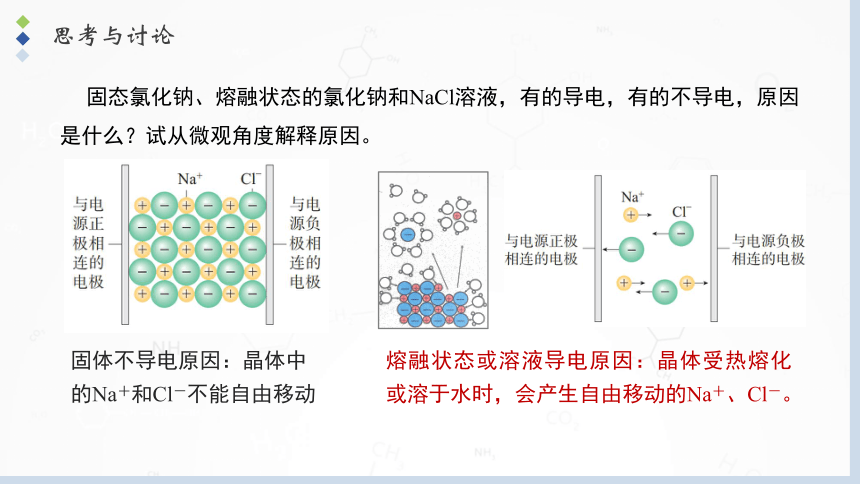
思考与讨论
固态氯化钠、熔融状态的氯化钠和NaCl溶液,有的导电,有的不导电,原因是什么?试从微观角度解释原因。
固体不导电原因:晶体中的Na+和Cl-不能自由移动
熔融状态或溶液导电原因:晶体受热熔化或溶于水时,会产生自由移动的Na+、Cl-。
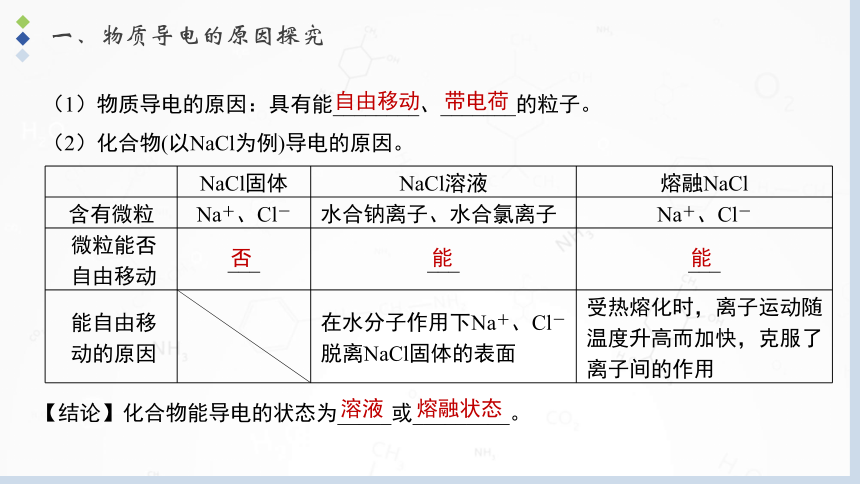
一、物质导电的原因探究
(1)物质导电的原因:具有能________、_______的粒子。
(2)化合物(以NaCl为例)导电的原因。
NaCl固体 NaCl溶液 熔融NaCl
含有微粒 Na+、Cl- 水合钠离子、水合氯离子 Na+、Cl-
微粒能否 自由移动 ___ ___ ___
能自由移 动的原因 在水分子作用下Na+、Cl-脱离NaCl固体的表面 受热熔化时,离子运动随温度升高而加快,克服了离子间的作用
【结论】化合物能导电的状态为_____或_________。
自由移动
带电荷
溶液
否
能
能
熔融状态
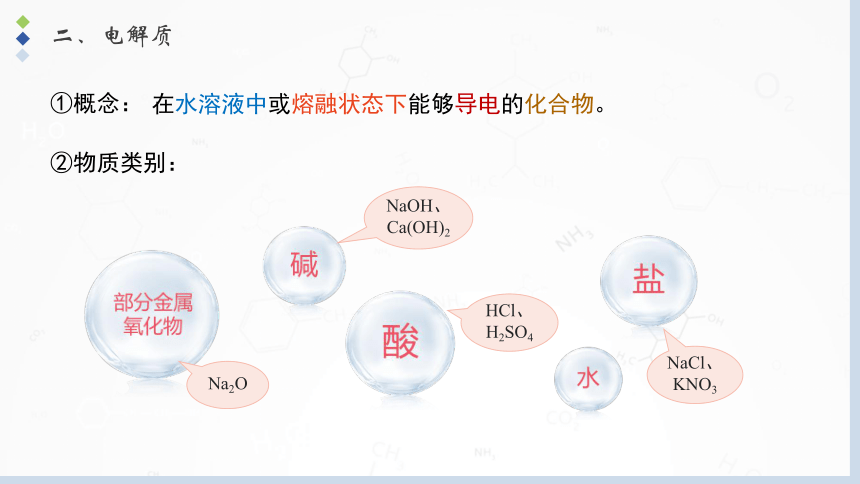
二、电解质
①概念:
在水溶液中或熔融状态下能够导电的化合物。
②物质类别:
Na2O
HCl、H2SO4
NaCl、KNO3
NaOH、 Ca(OH)2
二、电解质
电解质 非电解质
相同点 均为化合物 不同点 在水溶液里或熔融状态下能导电 在水溶液里和熔融状态下都不能导电
本质 区别 在水溶液里或熔融状态下能发生电离 在水溶液里和熔融状态下均不能发生电离
所含物 质类型 酸,如H2SO4、H2CO3等 碱,如NaOH、NH3·H2O等 盐,如NaCl、CaCO3等 活泼金属氧化物,如Na2O等 非金属氧化物,如CO2、CO等
非酸性气态氢化物,如NH3等
绝大多数有机物,如蔗糖、酒精、CH4等
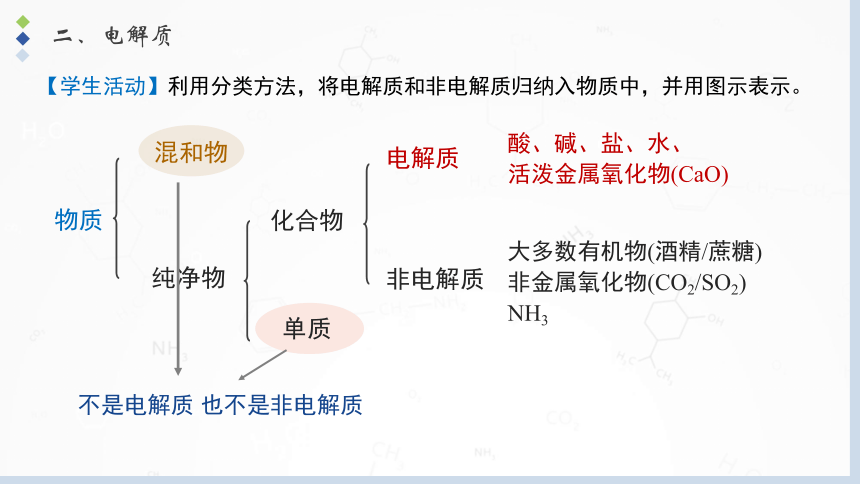
二、电解质
物质
混和物
纯净物
化合物
单质
电解质
非电解质
不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物(CaO)
大多数有机物(酒精/蔗糖)
非金属氧化物(CO2/SO2)
NH3
【学生活动】利用分类方法,将电解质和非电解质归纳入物质中,并用图示表示。
深度思考
判断题:
铜能够导电,所以是电解质;
氯化钠的水溶液能够导电,所以食盐水是电解质;
盐酸是电解质
硫酸是电解质
剖析电解质定义中的关键词:
(1)化合物:单质和混合物不属于化合物,所以不是电解质。
(×)
(×)
(×):因为盐酸是混合物,只能说氯化氢是电解质。
(√):硫酸是纯净物
深度思考
(2)或:两个条件满足其一即可;
判断:
固体氯化钠不导电,所以氯化钠不是电解质;
NaCl在水溶液和熔融状态下都能导电,所以NaCl是电解质;
液态HCl不导电,所以HCl不是电解质;
BaSO4难溶于水,其水溶液不导电,所以BaSO4不是电解质;
(×)
( √ )
(×)
(×)
剖析电解质定义中的关键词:
深度思考
(3)熔融:对于各种状态的物质,熔融的含义不同
对于常温下是固体的物质(如NaCl,KNO3),熔融态就是指加热至熔化的状态;
对于常温下是液体的物质(如酒精,硫酸),熔融态是指纯液态的状态;
对于常温下是气体的物质(如HCl,NH3),熔融态是指气体液化后的形式。
剖析电解质定义中的关键词:
深度思考
剖析电解质定义中的关键词:
判断:CO2是不是电解质?
CO2不属于电解质。因为CO2溶于水后导电的物质已经不是CO2而是碳酸。
(4)导电是指自身能够导电,而不是发生化学反应才导电。
类似的物质还包括SO2,SO3,NO2,NH3
SO2+H2O=H2SO3; SO3+H2O=H2SO4
3NO2+H2O=2HNO3+NO; NH3+H2O=NH3·H2O
深度思考
①非电解质也必须是化合物
判断:氢气在水溶液和熔融状态下均不能导电,所以氢气是非电解质
②“和”
判断:酒精在水溶液和熔融状态下均不能导电,所以酒精是非电解质
(×)
( √ )
(5)非电解质
即时反馈
1、下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
解析:CO2的水溶液能导电,并不是它自身电离的结果,而是它与水反应的产物H2CO3电离的结果。电解质一定是化合物,铜、石墨均不是电解质。
新知讲解
NaCl溶液能够导电
将NaCl固体加入水中
在水分子 的作用下
Na+和Cl-脱离NaCl固体的表面
进入水中
形成能够自由移动的水合钠离子和水合氯离子
当在NaCI溶液 中插入电极并接通电源
带正电荷的水合钠离子向与电源负极相连的电极移动
带负电荷的水合氯离子向与电源正极相连的电极移动
熔融的NaCl能够导电
当NaCl固体受热熔化
离子的运动随温度升高而加快
克服了离子间 的相互作用
产生了能够自由移动的Na+和Cl-
新知讲解
三、电离
②表示方法——电离方程式
①概念:像氯化钠这样,溶于水或受热熔化时解离成能够自由移动的离子的过程称为电离。
【试一试】写出NaCl熔融状态下或在水溶液中的电离方程式。
用化学式和离子符号表示物质电离过程的式子。
熔融状态:NaCl=Na++Cl-
在水溶液中:NaCl=Na++Cl-
新知讲解
例题1.用电离方程式表示下列物质在水溶液中的电离:
HCl HNO3 H2SO4
酸:电离时生成的阳离子全是氢离子的化合物
HNO3 H+ + NO3–
HCl H+ + Cl–
H2SO4 2H+ + SO42–
例题2.用电离方程式表示下列物质的电离:
NaOH Ca(OH)2 Ba(OH)2
碱:电离时生成的阴离子全是氢氧根离子的化合物
NaOH Na+ + OH–
Ca(OH)2 Ca2+ + 2OH–
Ba(OH)2 Ba2+ + 2OH–
四、酸、碱、盐的电离本质
例题3.用电离方程式表示下列物质的电离:
(NH4)2CO3 MgSO4 NaCl
盐:电离时生成金属阳离子(或NH4+)和酸根阴离子的化合物
MgSO4 Mg2+ + SO42–
(NH4)2CO3 2NH4+ + CO32–
NaCl Na+ + Cl–
四、酸、碱、盐的电离本质
四、酸、碱、盐的电离本质
【思考】在NaHSO4溶液中:NaHSO4 = Na+ + H+ + SO42–,
你认为NaHSO4是酸还是盐?
盐可以细分为
正盐:酸跟碱完全中和生成的盐,如CuSO4、AgNO3;
酸式盐:酸中的氢离子部分被中和生成的盐,如KHSO4;
碱式盐:碱中的氢氧根部分被中和生成的盐,如Cu2(OH)2CO3;
NaHSO4是酸式盐。
几种“特殊电解质”在水中的电离
1.NaHCO3
NaHCO3的组成是Na+和HCO3-, HCO3-在水中很难再发生电离,故NaHCO3在水中的电离方程式,
应写为NaHCO3= Na++HCO3-
不写为NaHCO3=Na++H++CO32-
2.NaHSO4
NaHSO4的组成是Na+和HSO4-, HSO4-在水中易电离为H+和SO42-,故NaHSO4在水中的电离方程式,应写为NaHSO4=Na++H++SO42-
新知讲解
新知讲解
3.CH3COOH
每个CH3COOH有4个H,但CH3COOH是一元酸,在水中电离为H+的H只有OH中的这1个。 CH3COOH在水中的电离是可逆的。综合上述, CH3COOH在水中的电离方程式,应写为
CH3COOH CH3COO-+H+
4.BaSO4
BaSO4 难溶于水,其意思是溶解度很小,但不是不溶解。 BaSO4 溶于水的部分会全部电离为Ba2+和SO42-,故BaSO4在水中的电离方程式,应写为BaSO4 = Ba2++SO42-。
5.H2O
在液态水中, H2O与H2O相互作用,使少量H2O可逆性地电离为H+和OH-,故 H2O的电离方程式,应写为H2O H++OH-。
6. NH3·H2O
NH3·H2O是一种一元碱,但该化学式在形式上与一般的碱不同。 NH3·H2O在水中可逆性地电离为NH4+和OH-,故 NH3·H2O的电离方程式,应写为NH3·H2O NH4++OH- 。
即时反馈
2、判断下列物质在水溶液中的电离方程式是否正确,不正确的加以改正。
_______________________________
(2)Ba(OH)2===Ba2++(OH-)2
__________________________________
__________________________________
____________________________________
不正确;改正:Ba(OH)2===Ba2++2OH-
电离方程式的书写原则
(1)符合客观事实。
(2)遵循质量守恒:方程式两边原子种类、原子数目相等
(3)遵循电荷守恒:阳离子所带正电荷总数等于阴离子所带负电荷总数,溶液显电中性。
课堂小结
书写电离方程式要注意哪些方面?
a.左边写电解质的化学式,右边写阴、阳离子;
b.强酸、强碱、盐(大部分)用“=”号,弱酸、弱碱用“ ”号;
c.原子团不能拆开 ,如 SO42-、NO3-、CO32-、NH4+ 、OH-
d.要遵循质量守恒和电荷守恒(电离方程式右侧的正负电荷数相等,溶液呈电中性)。
随堂练习
1.下列物质________________________________________能导电?
________________________________________是电解质?
______________________________________是非电解质?
(1)金属铜 (2)碳棒 (3)O2 (4)H2SO4 (5)液态HCl (6)CH3COOH
(7)葡萄糖 (8)固态NaCl (9)CaCO3固体 (10)CuSO4·5H2O
(11)熔融状态的KNO3 (12)KOH水溶液 (13)酒精水溶液
(14)盐酸 (15)CaO (16)CO2 (17)H2O (18)NH3
(1)、(2)、(11)、(12)、(14)、(17)
(4)、(5)、(6)、(8)、(9)、(10)、(11)、(15)
(7)、(16)、(18)
随堂练习
2、下列在水溶液中的电离方程式,错误的是 ( )
A.Na2CO3=2Na++CO32-
B.H2SO4=2H++SO42-
C.NaHCO3=Na++H++CO32-
D.NaHSO4=Na++H++SO42-
C
随堂练习
3、下列物质在指定条件下电离方程式正确的是( )
A.Na2CO3溶于水:Na2CO3=Na22++CO32-
B.Fe(OH)3部分溶于水电离:Fe(OH)3=Fe3++3OH-
C.NaHS溶于水HS-的电离:HS-+H2O H2S+OH-
D.NaHSO4加热熔化:NaHSO4=Na++HSO4-
D
第一章 物质及其变化
课堂导入
生活常识告诉我们,给电气设备通电时,湿手操作易发生触电事故。这是为什么呢?
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时去摸开关是十分危险的。NaCl固体 溶于水到底发生了什么变化呢?
课堂导入
【趣味实验】
如下图所示:将直流电源接通,灯泡发光,说明氯化钠溶液能导电,这是什么原因呢?它与金属导电是一回事吗?
新知讲解
[实验1-2]在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
取上述烧杯中的NaCl固体、KNO3,固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图1-9所示,将石墨电极依次放入NaCl溶液、KNO3溶液中,分别接通电源,观察并记录现象。
新知讲解
[补充实验]试验物质的导电性视频
[实验现象]试验物质的导电性
新知讲解
样品 干燥的KNO3固体 干燥的NaCl固体 蒸馏水 NaCl溶液 KNO3溶液 熔融的NaCl固体
现象
结论
灯泡不亮
不导电
灯泡不亮
不导电
灯泡不亮
不导电
灯泡亮
导电
灯泡亮
导电
灯泡亮
导电
微提醒
严格地说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出。
新知讲解
金属导电:有自由移动的电子。
氯化钠溶液导电:
类比
【氯化钠在水溶液里导电】
有自由移动的离子。
思考与讨论
固态氯化钠、熔融状态的氯化钠和NaCl溶液,有的导电,有的不导电,原因是什么?试从微观角度解释原因。
固体不导电原因:晶体中的Na+和Cl-不能自由移动
熔融状态或溶液导电原因:晶体受热熔化或溶于水时,会产生自由移动的Na+、Cl-。
一、物质导电的原因探究
(1)物质导电的原因:具有能________、_______的粒子。
(2)化合物(以NaCl为例)导电的原因。
NaCl固体 NaCl溶液 熔融NaCl
含有微粒 Na+、Cl- 水合钠离子、水合氯离子 Na+、Cl-
微粒能否 自由移动 ___ ___ ___
能自由移 动的原因 在水分子作用下Na+、Cl-脱离NaCl固体的表面 受热熔化时,离子运动随温度升高而加快,克服了离子间的作用
【结论】化合物能导电的状态为_____或_________。
自由移动
带电荷
溶液
否
能
能
熔融状态
二、电解质
①概念:
在水溶液中或熔融状态下能够导电的化合物。
②物质类别:
Na2O
HCl、H2SO4
NaCl、KNO3
NaOH、 Ca(OH)2
二、电解质
电解质 非电解质
相同点 均为化合物 不同点 在水溶液里或熔融状态下能导电 在水溶液里和熔融状态下都不能导电
本质 区别 在水溶液里或熔融状态下能发生电离 在水溶液里和熔融状态下均不能发生电离
所含物 质类型 酸,如H2SO4、H2CO3等 碱,如NaOH、NH3·H2O等 盐,如NaCl、CaCO3等 活泼金属氧化物,如Na2O等 非金属氧化物,如CO2、CO等
非酸性气态氢化物,如NH3等
绝大多数有机物,如蔗糖、酒精、CH4等
二、电解质
物质
混和物
纯净物
化合物
单质
电解质
非电解质
不是电解质
也不是非电解质
酸、碱、盐、水、
活泼金属氧化物(CaO)
大多数有机物(酒精/蔗糖)
非金属氧化物(CO2/SO2)
NH3
【学生活动】利用分类方法,将电解质和非电解质归纳入物质中,并用图示表示。
深度思考
判断题:
铜能够导电,所以是电解质;
氯化钠的水溶液能够导电,所以食盐水是电解质;
盐酸是电解质
硫酸是电解质
剖析电解质定义中的关键词:
(1)化合物:单质和混合物不属于化合物,所以不是电解质。
(×)
(×)
(×):因为盐酸是混合物,只能说氯化氢是电解质。
(√):硫酸是纯净物
深度思考
(2)或:两个条件满足其一即可;
判断:
固体氯化钠不导电,所以氯化钠不是电解质;
NaCl在水溶液和熔融状态下都能导电,所以NaCl是电解质;
液态HCl不导电,所以HCl不是电解质;
BaSO4难溶于水,其水溶液不导电,所以BaSO4不是电解质;
(×)
( √ )
(×)
(×)
剖析电解质定义中的关键词:
深度思考
(3)熔融:对于各种状态的物质,熔融的含义不同
对于常温下是固体的物质(如NaCl,KNO3),熔融态就是指加热至熔化的状态;
对于常温下是液体的物质(如酒精,硫酸),熔融态是指纯液态的状态;
对于常温下是气体的物质(如HCl,NH3),熔融态是指气体液化后的形式。
剖析电解质定义中的关键词:
深度思考
剖析电解质定义中的关键词:
判断:CO2是不是电解质?
CO2不属于电解质。因为CO2溶于水后导电的物质已经不是CO2而是碳酸。
(4)导电是指自身能够导电,而不是发生化学反应才导电。
类似的物质还包括SO2,SO3,NO2,NH3
SO2+H2O=H2SO3; SO3+H2O=H2SO4
3NO2+H2O=2HNO3+NO; NH3+H2O=NH3·H2O
深度思考
①非电解质也必须是化合物
判断:氢气在水溶液和熔融状态下均不能导电,所以氢气是非电解质
②“和”
判断:酒精在水溶液和熔融状态下均不能导电,所以酒精是非电解质
(×)
( √ )
(5)非电解质
即时反馈
1、下列说法中,正确的是( )
A.液态HCl、固态NaCl均不导电,所以HCl、NaCl均不是电解质
B.NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质
C.蔗糖、酒精在水溶液里或熔融状态时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
解析:CO2的水溶液能导电,并不是它自身电离的结果,而是它与水反应的产物H2CO3电离的结果。电解质一定是化合物,铜、石墨均不是电解质。
新知讲解
NaCl溶液能够导电
将NaCl固体加入水中
在水分子 的作用下
Na+和Cl-脱离NaCl固体的表面
进入水中
形成能够自由移动的水合钠离子和水合氯离子
当在NaCI溶液 中插入电极并接通电源
带正电荷的水合钠离子向与电源负极相连的电极移动
带负电荷的水合氯离子向与电源正极相连的电极移动
熔融的NaCl能够导电
当NaCl固体受热熔化
离子的运动随温度升高而加快
克服了离子间 的相互作用
产生了能够自由移动的Na+和Cl-
新知讲解
三、电离
②表示方法——电离方程式
①概念:像氯化钠这样,溶于水或受热熔化时解离成能够自由移动的离子的过程称为电离。
【试一试】写出NaCl熔融状态下或在水溶液中的电离方程式。
用化学式和离子符号表示物质电离过程的式子。
熔融状态:NaCl=Na++Cl-
在水溶液中:NaCl=Na++Cl-
新知讲解
例题1.用电离方程式表示下列物质在水溶液中的电离:
HCl HNO3 H2SO4
酸:电离时生成的阳离子全是氢离子的化合物
HNO3 H+ + NO3–
HCl H+ + Cl–
H2SO4 2H+ + SO42–
例题2.用电离方程式表示下列物质的电离:
NaOH Ca(OH)2 Ba(OH)2
碱:电离时生成的阴离子全是氢氧根离子的化合物
NaOH Na+ + OH–
Ca(OH)2 Ca2+ + 2OH–
Ba(OH)2 Ba2+ + 2OH–
四、酸、碱、盐的电离本质
例题3.用电离方程式表示下列物质的电离:
(NH4)2CO3 MgSO4 NaCl
盐:电离时生成金属阳离子(或NH4+)和酸根阴离子的化合物
MgSO4 Mg2+ + SO42–
(NH4)2CO3 2NH4+ + CO32–
NaCl Na+ + Cl–
四、酸、碱、盐的电离本质
四、酸、碱、盐的电离本质
【思考】在NaHSO4溶液中:NaHSO4 = Na+ + H+ + SO42–,
你认为NaHSO4是酸还是盐?
盐可以细分为
正盐:酸跟碱完全中和生成的盐,如CuSO4、AgNO3;
酸式盐:酸中的氢离子部分被中和生成的盐,如KHSO4;
碱式盐:碱中的氢氧根部分被中和生成的盐,如Cu2(OH)2CO3;
NaHSO4是酸式盐。
几种“特殊电解质”在水中的电离
1.NaHCO3
NaHCO3的组成是Na+和HCO3-, HCO3-在水中很难再发生电离,故NaHCO3在水中的电离方程式,
应写为NaHCO3= Na++HCO3-
不写为NaHCO3=Na++H++CO32-
2.NaHSO4
NaHSO4的组成是Na+和HSO4-, HSO4-在水中易电离为H+和SO42-,故NaHSO4在水中的电离方程式,应写为NaHSO4=Na++H++SO42-
新知讲解
新知讲解
3.CH3COOH
每个CH3COOH有4个H,但CH3COOH是一元酸,在水中电离为H+的H只有OH中的这1个。 CH3COOH在水中的电离是可逆的。综合上述, CH3COOH在水中的电离方程式,应写为
CH3COOH CH3COO-+H+
4.BaSO4
BaSO4 难溶于水,其意思是溶解度很小,但不是不溶解。 BaSO4 溶于水的部分会全部电离为Ba2+和SO42-,故BaSO4在水中的电离方程式,应写为BaSO4 = Ba2++SO42-。
5.H2O
在液态水中, H2O与H2O相互作用,使少量H2O可逆性地电离为H+和OH-,故 H2O的电离方程式,应写为H2O H++OH-。
6. NH3·H2O
NH3·H2O是一种一元碱,但该化学式在形式上与一般的碱不同。 NH3·H2O在水中可逆性地电离为NH4+和OH-,故 NH3·H2O的电离方程式,应写为NH3·H2O NH4++OH- 。
即时反馈
2、判断下列物质在水溶液中的电离方程式是否正确,不正确的加以改正。
_______________________________
(2)Ba(OH)2===Ba2++(OH-)2
__________________________________
__________________________________
____________________________________
不正确;改正:Ba(OH)2===Ba2++2OH-
电离方程式的书写原则
(1)符合客观事实。
(2)遵循质量守恒:方程式两边原子种类、原子数目相等
(3)遵循电荷守恒:阳离子所带正电荷总数等于阴离子所带负电荷总数,溶液显电中性。
课堂小结
书写电离方程式要注意哪些方面?
a.左边写电解质的化学式,右边写阴、阳离子;
b.强酸、强碱、盐(大部分)用“=”号,弱酸、弱碱用“ ”号;
c.原子团不能拆开 ,如 SO42-、NO3-、CO32-、NH4+ 、OH-
d.要遵循质量守恒和电荷守恒(电离方程式右侧的正负电荷数相等,溶液呈电中性)。
随堂练习
1.下列物质________________________________________能导电?
________________________________________是电解质?
______________________________________是非电解质?
(1)金属铜 (2)碳棒 (3)O2 (4)H2SO4 (5)液态HCl (6)CH3COOH
(7)葡萄糖 (8)固态NaCl (9)CaCO3固体 (10)CuSO4·5H2O
(11)熔融状态的KNO3 (12)KOH水溶液 (13)酒精水溶液
(14)盐酸 (15)CaO (16)CO2 (17)H2O (18)NH3
(1)、(2)、(11)、(12)、(14)、(17)
(4)、(5)、(6)、(8)、(9)、(10)、(11)、(15)
(7)、(16)、(18)
随堂练习
2、下列在水溶液中的电离方程式,错误的是 ( )
A.Na2CO3=2Na++CO32-
B.H2SO4=2H++SO42-
C.NaHCO3=Na++H++CO32-
D.NaHSO4=Na++H++SO42-
C
随堂练习
3、下列物质在指定条件下电离方程式正确的是( )
A.Na2CO3溶于水:Na2CO3=Na22++CO32-
B.Fe(OH)3部分溶于水电离:Fe(OH)3=Fe3++3OH-
C.NaHS溶于水HS-的电离:HS-+H2O H2S+OH-
D.NaHSO4加热熔化:NaHSO4=Na++HSO4-
D
