1.3 课时2 氧化剂和还原剂课件 (共29张PPT) 2025-2026学年人教版(2019)高中化学必修第一册
文档属性
| 名称 | 1.3 课时2 氧化剂和还原剂课件 (共29张PPT) 2025-2026学年人教版(2019)高中化学必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 22:46:14 | ||
图片预览






文档简介
氧化剂和还原剂
第一章 物质的分类及转化
1.让学生理解氧化剂和还原剂、氧化性和还原性的概念,理解其与价态及电子转移的关系。
2.知道常见的氧化剂和还原剂。
学习目标
一、氧化还原反应中电子转移的表示方法
1.双线桥法:
2CuO + C == 2Cu + CO2
得2×2e-,价降低,被还原
+2
0
0
+4
高温
失4e-,价升高,被氧化
书写步骤:
(1)标出变化了的元素化合价;
(2)划箭头起止为同种元素(跨等号)
(4)查得失电子总数要相等。
(3)书写线桥上内容。
表示反应前后__________由反应物转化为生成物时电子转移的情况。
同一元素
标价态——连双线——注得失
2.单线桥法:
2CuO + C == 2Cu + CO2
+2
0
0
+4
高温
4e-
表示反应过程中__________原子间的电子转移情况。
不同元素
(1)标出价态发生改变元素的化合价
(2)在反应物中从失电子元素指向得电子元素
(3)注电子 定数目(电子转移总数)
书写步骤:
标价态——连单线——注数目
一、氧化还原反应中电子转移的表示方法
Zn + 2H+ == Zn2+ + H2↑ (2) 2K + S == K2S
(3) 2Na+Cl2 2NaCl (4) MnO2 + 4HCl(浓) MnCl + 2H2O + Cl2↑
0
+1
失去2×e-
-2
0
得到2e-
0
+2
失去2e-
0
+1
得到2×e-
0
+1
失去2 ×e-
-1
0
得到2×e-
+4 -2
+2 -1
得到2e-
0
+1 -1
失去2×e-
+1 -2
用双线桥法标出下列反应中电子转移方向和数目
学以致用
下列化学反应中电子转移的表示方法正确的是 ( )
B
学以致用
二、氧化剂与还原剂
得到2e- ,化合价降低,被还原
失去2×e-,化合价升高,被氧化
CuO + H2 Cu + H2O
?
+2
+1
0
0
氧化剂
还原剂
还原产物
氧化产物
氧化剂:得到电子(或电子对偏向的物质)的物质,元素的化合价降低
还原剂:失去电子(或电子对偏离的物质)的物质,元素的化合价升高
反应物
生成物
氧化产物:还原剂被氧化后的生成物
还原产物:氧化剂被还原后的生成物
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性,得电子,化合价降低,被还原,发生还原反应
还原性,失电子,化合价升高,被氧化,发生氧化反应
氧化剂
氧化性
得电子
价降低
被还原
还原
产物
还原剂
还原性
失电子
价升高
被氧化
氧化
产物
具有
生成
具有
生成
物质
性质
转移电子
变价
过程
产物
还原
反应
氧化
反应
发生
发生
反应
口诀: 升失氧氧还,降得还还氧
二、氧化剂与还原剂
氧化剂与还原剂一定是不同物质吗?氧化产物与还原产物一定是不同物质吗?
3S+6KOH == 2K2S+K2SO3+3H2O
2H2S + SO2 == 3S↓ + 2H2O
0 -2 +4
氧化剂
还原剂
还原产物
氧化产物
歧化反应
-2 0 +4
K2S
S
K2SO3
-2 +4 0
氧化剂
还原剂
还原产物
氧化产物
归中反应
-2 0 +4
H2S
S
SO2
思考与讨论
两类特殊的氧化还原反应
2、归中反应:不同反应物中不同价态的同种原子,一部分化合价升高,一部分化合价降低,生成相同价态的物质。 规律:高价+低价→中间价
(中间价态可以相同,也可以不同。“只靠拢、不相交”)
1、歧化反应:同一反应物中同种价态原子,一部分化合价升高,一部分化合价降低,生成两种不同价态的物质。 规律:中间价 → 高价+低价
注意:歧化反应属于自身氧化还原反应,但自身氧化还原反应不一定都属于歧化反应。
如:2KClO3 == 2KCl +3O2↑
?
MnO2
常见氧化剂、还原剂
O2 , Cl2 等
CuO , Fe2O3 等
KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3 等
Fe3+ , H+等
1) 活泼的非金属单质:
2) 高价的氧化物:
3) 高价的含氧酸及其盐:
4) 某些阳离子:
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}物质归类
活泼非金属单质
变价元素高价态化合物
过氧化物
其他
氧化剂
O2
Cl2
Br2
KMnO4
FeCl3
HNO3
H2SO4
(浓)
Na2O2
H2O2
HClO
MnO2
对应还原产物
H2O
Cl-
Br-
Mn2+
Fe2+
NO2
NO
SO2
NaOH等
H2O
Cl-
Mn2+
具有氧化性,易得电子,化合价降低
1.常见的氧化剂
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}物质归类
金属单质
非金属单质
某些氧化物
某些氢化物
某些盐
还原剂
Na
Al
H2
C
CO
SO2
NH3
H2S
KI
FeCl2
Na2SO3
对应氧化产物
Na+
Al3+
H2O
CO、CO2
CO2
SO42-
N2
S
I2
Fe3+
SO42-
2)某些非金属单质:
H2 , C等
3)变价元素的低价态物质:
I-, S2-等
1)活泼的金属单质:
4)某些阴离子:
K , Na , Mg , Fe , Al等
CO ,H2S, Cu2O等
中间价态的化合物,在氧化还原反应中既能得到电子又能失去电子,既能做氧化剂又能做还原剂,例如H2O2、SO2、SO32-等。
具有还原性,失去电子,化合价升高
常见氧化剂、还原剂
2.常见的还原剂
高价氧,低价还,中间价态两边转
2. 下列氧化还原反应中水作为氧化剂的是( )
A. CO+H2O CO2 +H2
高温
B. Cl2+H2O HClO +HCl
C. Na2O+ H2O 2NaOH
D. 2F2+ 2H2O 4HF +O2
学以致用
1.下列物质属于常见氧化剂的一组是( )
A.Cl2、O2、FeCl3、KMnO4
B.O2、KMnO4、C、H2
C.Na、K、FeCl2、H2、CO
D.CuO、CO、Fe2O3、H2
A
A
氧化性和还原性:
氧化剂
还原剂
什么剂具有什么性
氧化性:得电子能力
还原性:失电子能力
得电子能力越强,氧化性越强
失电子能力越强,还原性越强
氧化性还原性强弱主要取决于物质本身得失电子的难易程度,而不取决于得失电子数的多少。 如还原性:Na>Mg>Al
三、氧化性与还原性强弱比较
氧化还原反应发生规律可用如下式子表示:
氧化剂+还原剂 还原产物+氧化产物
被还原
被氧化
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
特点:比什么性,找什么剂,产物之性小于剂。
简记:“强制弱”
1.根据氧化还原反应方程式比较
三、氧化性与还原性强弱比较
常温下,发生下列反应:
①16H++10Cl-+ 2MnO4- === 2Mn2++5Cl2↑+8H2O
②2Fe2++Br2=== 2Fe3++2Br-
③2Br-+Cl2 === Br2+2Cl-
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是_______________________。
MnO4- > Cl2 > Br2 > Fe3+
学以致用
单质 还原性强
氧化性强
容易得电子
容易失电子
不容易得电子
2.根据金属性的活动性顺序比较
金属元素活泼性越弱,金属单质的还原性越弱,对应阳离子的氧化性越强
离子 氧化性弱
Mg2+ < Al 3+<Zn2+< Fe2+<Pb2+<H+ < Cu2+ < Fe3+ < Hg2+< Ag+
氧化性:
Fe3+
还原性弱
不容易失电子
还原性:
K >...............> Zn > Fe > Pb > H > Cu > Fe2+ > Hg > Ag
Fe2+
三、氧化性与还原性强弱比较
单质氧化性强
得电子能力强
离子还原性弱
失电子能力弱
非金属元素活泼性越弱,非金属单质氧化性越弱,对应阴离子的还原性越强
F-< Cl-< Br-< Fe2+< I-< S2-
还原性:
F2 > Cl2 > Br2 >Fe3+> I2 > S
氧化性:
Fe3+
Fe2+
3.根据非金属的活动性顺序比较
三.氧化性与还原性强弱比较
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,可根据反应的难易来判断,反应越容易,该氧化剂氧化性就越强。
从是否加热、温度高低、有无催化剂等方面判断。如:
练:①2KMnO4+16HCl(浓) == 2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
可判断氧化性:KMnO4____MnO2
>
4.根据反应难易、反应条件等判断
三.氧化性与还原性强弱比较
5、根据变价元素被氧化(或被还原)的程度比较
不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例:
2Fe+3Cl2 2FeCl3
Fe+S FeS
氧化性
Cl2 S
>
Cu+2Fe3+ = Cu2++2Fe2+
3Zn+2Fe3+ = 3Zn2++2Fe
还原性
Zn Cu
>
不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。例:
0 +3
0 +2
三.氧化性与还原性强弱比较
6.根据同种元素的价态高低比较
具有变价的元素,一般价态越高,氧化性越强;价态越低,还原性越强。
氧化性:Fe3+>Fe2+>Fe
S(+6)>S(+4)>S(0)
特例:HClO>HClO2>HClO3>HClO4(氧化性)
还原性:I->I2
H2S>S >SO2
三.氧化性与还原性强弱比较
7.根据外界影响因素比较
氧化性:浓H2SO4 —— 稀H2SO4 还原性:浓HNO3 —— 稀HNO3
浓度:同一物质的浓度越大,其氧化性(或还原性)越强。
氧化性: NO3_ (H+) —— NO3_ (OH_)
>
>
温度:温度升高,某些物质的氧化性或还原性增强。
氧化性:浓硫酸(热)> 浓硫酸(冷)
还原性:浓盐酸(热)> 浓盐酸(冷)
酸碱性:同一物质,所处的环境酸(或碱)性越强,其氧化(或还原性)越强。
>
三.氧化性与还原性强弱比较
【思考与讨论】
还原剂
氧化剂
+2 +2 +4 0
化合价升高,失去2×2e-,被氧化
化合价降低,得到2×2e-电子,被还原
氧化产物
还原产物
2CO + 2NO=== 2CO2 + N2
高温
催化剂
在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(1)请写出上述反应的化学方程式。
(2)请分析上述反应是否为氧化还原反应。 如果是,请指出反应中的氧化剂和还原剂。
CO、NO均有毒,二者在催化剂作用下发生氧化还原反应,生成的产物N2和CO2,都是无毒物质,从而减少了汽车尾气排放所造成的空气污染。
(3)催化转化器中发生的反应对减少汽车尾气污染有什么作用?请查阅资料,了解氧化还原反应在生产和生活中应用的其他具体事例,与同学讨论你对氧化还原反应价值的认识。
【思考与讨论】
四、氧化还原反应的应用
金属的冶炼 电镀 燃料的燃烧 植物光合作用
易燃物的自燃 食物的腐败 钢铁的锈蚀
正面影响
负面影响
本节小结
化合价升高
化合价降低
失电子(电子对偏离)
得电子(电子对偏向)
被氧化
被还原
还原性
氧化性
反应物
生成物
氧化剂
还原剂
氧化产物
还原产物
升—失—氧化——还原剂
降—得—还原——氧化剂
1.下列表示反应中电子转移的方向和数目正确的是( )
B
同种元素间发生氧化还原反应的规律:只靠近不交叉
夯实训练
2.已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe3++H2O2===2Fe2++O2↑+2H+
C
夯实训练
3.常温下,发生下列几种反应:
①16H++10Cl-+2MnO4?===2Mn2++5Cl2↑+8H2O
②2Fe2++Br2===2Fe3++2Br-
③2Br-+Cl2===Br2+2Cl-
根据上述反应,判断下列结论错误的是
A.溶液中可发生:Cl2+2Fe2+===2Fe3++2Cl-
B.Cl2在①③反应中均为氧化剂
C.氧化性强弱的顺序为MnO4?>Cl2>Br2>Fe3+
D.Mn2+是MnO4?的还原产物
?
√
氧化性:MnO4?>Cl2
?
Cl2在①中是氧化产物,而在③中Cl2做氧化剂。
氧化性:Br2>Fe3+
氧化性:Cl2>Br2
夯实训练
第一章 物质的分类及转化
1.让学生理解氧化剂和还原剂、氧化性和还原性的概念,理解其与价态及电子转移的关系。
2.知道常见的氧化剂和还原剂。
学习目标
一、氧化还原反应中电子转移的表示方法
1.双线桥法:
2CuO + C == 2Cu + CO2
得2×2e-,价降低,被还原
+2
0
0
+4
高温
失4e-,价升高,被氧化
书写步骤:
(1)标出变化了的元素化合价;
(2)划箭头起止为同种元素(跨等号)
(4)查得失电子总数要相等。
(3)书写线桥上内容。
表示反应前后__________由反应物转化为生成物时电子转移的情况。
同一元素
标价态——连双线——注得失
2.单线桥法:
2CuO + C == 2Cu + CO2
+2
0
0
+4
高温
4e-
表示反应过程中__________原子间的电子转移情况。
不同元素
(1)标出价态发生改变元素的化合价
(2)在反应物中从失电子元素指向得电子元素
(3)注电子 定数目(电子转移总数)
书写步骤:
标价态——连单线——注数目
一、氧化还原反应中电子转移的表示方法
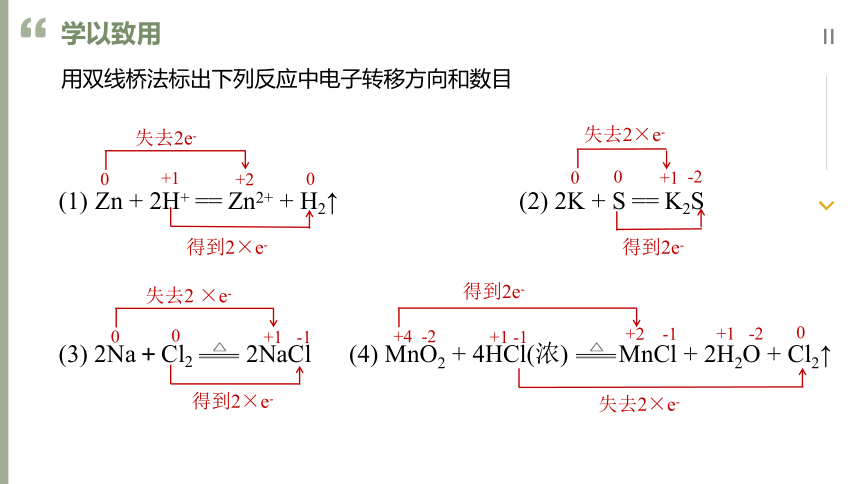
Zn + 2H+ == Zn2+ + H2↑ (2) 2K + S == K2S
(3) 2Na+Cl2 2NaCl (4) MnO2 + 4HCl(浓) MnCl + 2H2O + Cl2↑
0
+1
失去2×e-
-2
0
得到2e-
0
+2
失去2e-
0
+1
得到2×e-
0
+1
失去2 ×e-
-1
0
得到2×e-
+4 -2
+2 -1
得到2e-
0
+1 -1
失去2×e-
+1 -2
用双线桥法标出下列反应中电子转移方向和数目
学以致用
下列化学反应中电子转移的表示方法正确的是 ( )
B
学以致用
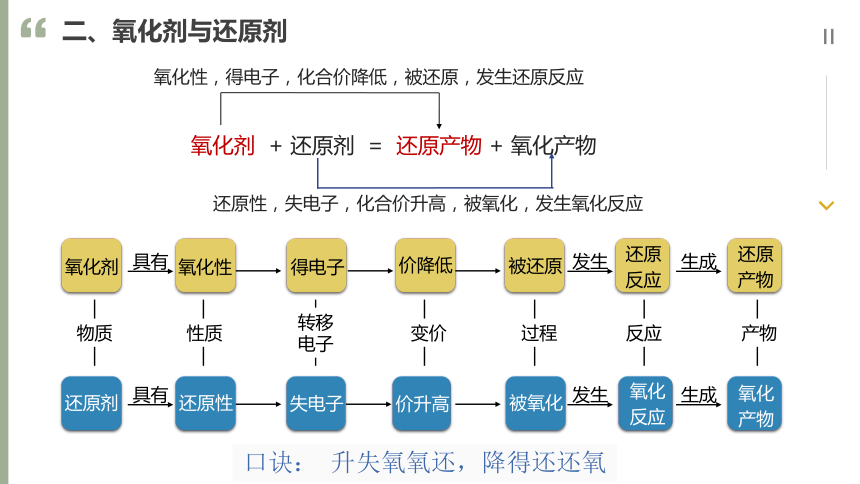
二、氧化剂与还原剂
得到2e- ,化合价降低,被还原
失去2×e-,化合价升高,被氧化
CuO + H2 Cu + H2O
?
+2
+1
0
0
氧化剂
还原剂
还原产物
氧化产物
氧化剂:得到电子(或电子对偏向的物质)的物质,元素的化合价降低
还原剂:失去电子(或电子对偏离的物质)的物质,元素的化合价升高
反应物
生成物
氧化产物:还原剂被氧化后的生成物
还原产物:氧化剂被还原后的生成物
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性,得电子,化合价降低,被还原,发生还原反应
还原性,失电子,化合价升高,被氧化,发生氧化反应
氧化剂
氧化性
得电子
价降低
被还原
还原
产物
还原剂
还原性
失电子
价升高
被氧化
氧化
产物
具有
生成
具有
生成
物质
性质
转移电子
变价
过程
产物
还原
反应
氧化
反应
发生
发生
反应
口诀: 升失氧氧还,降得还还氧
二、氧化剂与还原剂
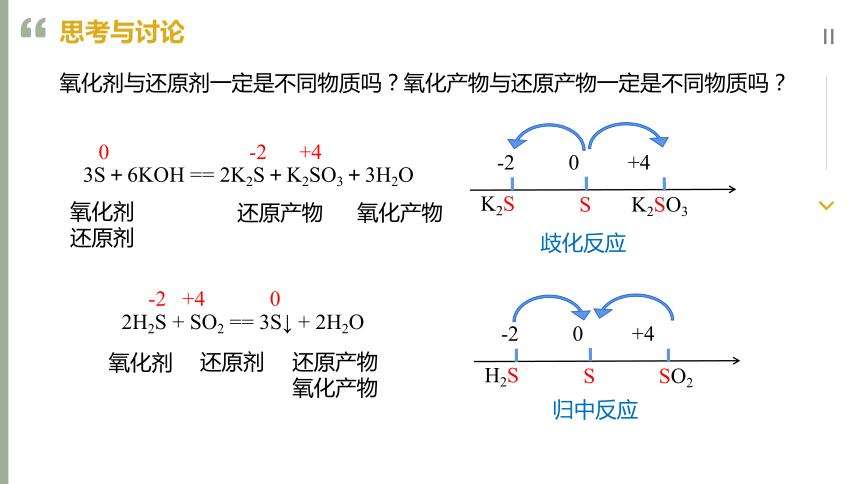
氧化剂与还原剂一定是不同物质吗?氧化产物与还原产物一定是不同物质吗?
3S+6KOH == 2K2S+K2SO3+3H2O
2H2S + SO2 == 3S↓ + 2H2O
0 -2 +4
氧化剂
还原剂
还原产物
氧化产物
歧化反应
-2 0 +4
K2S
S
K2SO3
-2 +4 0
氧化剂
还原剂
还原产物
氧化产物
归中反应
-2 0 +4
H2S
S
SO2
思考与讨论
两类特殊的氧化还原反应
2、归中反应:不同反应物中不同价态的同种原子,一部分化合价升高,一部分化合价降低,生成相同价态的物质。 规律:高价+低价→中间价
(中间价态可以相同,也可以不同。“只靠拢、不相交”)
1、歧化反应:同一反应物中同种价态原子,一部分化合价升高,一部分化合价降低,生成两种不同价态的物质。 规律:中间价 → 高价+低价
注意:歧化反应属于自身氧化还原反应,但自身氧化还原反应不一定都属于歧化反应。
如:2KClO3 == 2KCl +3O2↑
?
MnO2
常见氧化剂、还原剂
O2 , Cl2 等
CuO , Fe2O3 等
KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3 等
Fe3+ , H+等
1) 活泼的非金属单质:
2) 高价的氧化物:
3) 高价的含氧酸及其盐:
4) 某些阳离子:
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}物质归类
活泼非金属单质
变价元素高价态化合物
过氧化物
其他
氧化剂
O2
Cl2
Br2
KMnO4
FeCl3
HNO3
H2SO4
(浓)
Na2O2
H2O2
HClO
MnO2
对应还原产物
H2O
Cl-
Br-
Mn2+
Fe2+
NO2
NO
SO2
NaOH等
H2O
Cl-
Mn2+
具有氧化性,易得电子,化合价降低
1.常见的氧化剂
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}物质归类
金属单质
非金属单质
某些氧化物
某些氢化物
某些盐
还原剂
Na
Al
H2
C
CO
SO2
NH3
H2S
KI
FeCl2
Na2SO3
对应氧化产物
Na+
Al3+
H2O
CO、CO2
CO2
SO42-
N2
S
I2
Fe3+
SO42-
2)某些非金属单质:
H2 , C等
3)变价元素的低价态物质:
I-, S2-等
1)活泼的金属单质:
4)某些阴离子:
K , Na , Mg , Fe , Al等
CO ,H2S, Cu2O等
中间价态的化合物,在氧化还原反应中既能得到电子又能失去电子,既能做氧化剂又能做还原剂,例如H2O2、SO2、SO32-等。
具有还原性,失去电子,化合价升高
常见氧化剂、还原剂
2.常见的还原剂
高价氧,低价还,中间价态两边转
2. 下列氧化还原反应中水作为氧化剂的是( )
A. CO+H2O CO2 +H2
高温
B. Cl2+H2O HClO +HCl
C. Na2O+ H2O 2NaOH
D. 2F2+ 2H2O 4HF +O2
学以致用
1.下列物质属于常见氧化剂的一组是( )
A.Cl2、O2、FeCl3、KMnO4
B.O2、KMnO4、C、H2
C.Na、K、FeCl2、H2、CO
D.CuO、CO、Fe2O3、H2
A
A
氧化性和还原性:
氧化剂
还原剂
什么剂具有什么性
氧化性:得电子能力
还原性:失电子能力
得电子能力越强,氧化性越强
失电子能力越强,还原性越强
氧化性还原性强弱主要取决于物质本身得失电子的难易程度,而不取决于得失电子数的多少。 如还原性:Na>Mg>Al
三、氧化性与还原性强弱比较
氧化还原反应发生规律可用如下式子表示:
氧化剂+还原剂 还原产物+氧化产物
被还原
被氧化
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
特点:比什么性,找什么剂,产物之性小于剂。
简记:“强制弱”
1.根据氧化还原反应方程式比较
三、氧化性与还原性强弱比较
常温下,发生下列反应:
①16H++10Cl-+ 2MnO4- === 2Mn2++5Cl2↑+8H2O
②2Fe2++Br2=== 2Fe3++2Br-
③2Br-+Cl2 === Br2+2Cl-
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是_______________________。
MnO4- > Cl2 > Br2 > Fe3+
学以致用
单质 还原性强
氧化性强
容易得电子
容易失电子
不容易得电子
2.根据金属性的活动性顺序比较
金属元素活泼性越弱,金属单质的还原性越弱,对应阳离子的氧化性越强
离子 氧化性弱
Mg2+ < Al 3+<Zn2+< Fe2+<Pb2+<H+ < Cu2+ < Fe3+ < Hg2+< Ag+
氧化性:
Fe3+
还原性弱
不容易失电子
还原性:
K >...............> Zn > Fe > Pb > H > Cu > Fe2+ > Hg > Ag
Fe2+
三、氧化性与还原性强弱比较
单质氧化性强
得电子能力强
离子还原性弱
失电子能力弱
非金属元素活泼性越弱,非金属单质氧化性越弱,对应阴离子的还原性越强
F-< Cl-< Br-< Fe2+< I-< S2-
还原性:
F2 > Cl2 > Br2 >Fe3+> I2 > S
氧化性:
Fe3+
Fe2+
3.根据非金属的活动性顺序比较
三.氧化性与还原性强弱比较
当不同氧化剂分别与同一还原剂反应时,如果氧化产物价态相同,可根据反应的难易来判断,反应越容易,该氧化剂氧化性就越强。
从是否加热、温度高低、有无催化剂等方面判断。如:
练:①2KMnO4+16HCl(浓) == 2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
可判断氧化性:KMnO4____MnO2
>
4.根据反应难易、反应条件等判断
三.氧化性与还原性强弱比较
5、根据变价元素被氧化(或被还原)的程度比较
不同还原剂作用于同一种氧化剂,还原产物价态低的其还原性强。例:
2Fe+3Cl2 2FeCl3
Fe+S FeS
氧化性
Cl2 S
>
Cu+2Fe3+ = Cu2++2Fe2+
3Zn+2Fe3+ = 3Zn2++2Fe
还原性
Zn Cu
>
不同氧化剂作用于同一种还原剂,氧化产物价态高的其氧化性强。例:
0 +3
0 +2
三.氧化性与还原性强弱比较
6.根据同种元素的价态高低比较
具有变价的元素,一般价态越高,氧化性越强;价态越低,还原性越强。
氧化性:Fe3+>Fe2+>Fe
S(+6)>S(+4)>S(0)
特例:HClO>HClO2>HClO3>HClO4(氧化性)
还原性:I->I2
H2S>S >SO2
三.氧化性与还原性强弱比较
7.根据外界影响因素比较
氧化性:浓H2SO4 —— 稀H2SO4 还原性:浓HNO3 —— 稀HNO3
浓度:同一物质的浓度越大,其氧化性(或还原性)越强。
氧化性: NO3_ (H+) —— NO3_ (OH_)
>
>
温度:温度升高,某些物质的氧化性或还原性增强。
氧化性:浓硫酸(热)> 浓硫酸(冷)
还原性:浓盐酸(热)> 浓盐酸(冷)
酸碱性:同一物质,所处的环境酸(或碱)性越强,其氧化(或还原性)越强。
>
三.氧化性与还原性强弱比较
【思考与讨论】
还原剂
氧化剂
+2 +2 +4 0
化合价升高,失去2×2e-,被氧化
化合价降低,得到2×2e-电子,被还原
氧化产物
还原产物
2CO + 2NO=== 2CO2 + N2
高温
催化剂
在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下发生反应,生成CO2和N2。
(1)请写出上述反应的化学方程式。
(2)请分析上述反应是否为氧化还原反应。 如果是,请指出反应中的氧化剂和还原剂。
CO、NO均有毒,二者在催化剂作用下发生氧化还原反应,生成的产物N2和CO2,都是无毒物质,从而减少了汽车尾气排放所造成的空气污染。
(3)催化转化器中发生的反应对减少汽车尾气污染有什么作用?请查阅资料,了解氧化还原反应在生产和生活中应用的其他具体事例,与同学讨论你对氧化还原反应价值的认识。
【思考与讨论】
四、氧化还原反应的应用
金属的冶炼 电镀 燃料的燃烧 植物光合作用
易燃物的自燃 食物的腐败 钢铁的锈蚀
正面影响
负面影响
本节小结
化合价升高
化合价降低
失电子(电子对偏离)
得电子(电子对偏向)
被氧化
被还原
还原性
氧化性
反应物
生成物
氧化剂
还原剂
氧化产物
还原产物
升—失—氧化——还原剂
降—得—还原——氧化剂
1.下列表示反应中电子转移的方向和数目正确的是( )
B
同种元素间发生氧化还原反应的规律:只靠近不交叉
夯实训练
2.已知I-、Fe2+、SO2和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O
D.2Fe3++H2O2===2Fe2++O2↑+2H+
C
夯实训练
3.常温下,发生下列几种反应:
①16H++10Cl-+2MnO4?===2Mn2++5Cl2↑+8H2O
②2Fe2++Br2===2Fe3++2Br-
③2Br-+Cl2===Br2+2Cl-
根据上述反应,判断下列结论错误的是
A.溶液中可发生:Cl2+2Fe2+===2Fe3++2Cl-
B.Cl2在①③反应中均为氧化剂
C.氧化性强弱的顺序为MnO4?>Cl2>Br2>Fe3+
D.Mn2+是MnO4?的还原产物
?
√
氧化性:MnO4?>Cl2
?
Cl2在①中是氧化产物,而在③中Cl2做氧化剂。
氧化性:Br2>Fe3+
氧化性:Cl2>Br2
夯实训练
