1.3 课时3 氧化还原反应规律及应用 课件(共20张PPT) 2025-2026学年人教版(2019)高中化学必修第一册
文档属性
| 名称 | 1.3 课时3 氧化还原反应规律及应用 课件(共20张PPT) 2025-2026学年人教版(2019)高中化学必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 22:48:37 | ||
图片预览








文档简介
(共20张PPT)
氧化还原反应规律及应用
第一章 物质的分类及转化
学习目标
1.掌握氧化还原反应的规律。
2.掌握氧化还原反应的配平原理及方法技巧。
一、氧化还原反应的基本规律
1. 强弱规律:
根据氧化还原反应方程式:
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性强
还原性强
还原性弱
氧化性弱
注意:氧化性、还原性的强弱取决于:物质得失电子的难易程度,
与得失电子数目的多少无关。
应用:比较粒子氧化性或还原性强弱;(剂 >物)
判断氧化还原反应在一定条件下能否发生;(强制弱)
根据下列反应:
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
3FeCl2+4HNO3==2FeCl3 + NO↑+ 2H2O +Fe(NO3)3
判断有关物质还原性由强到弱的顺序是( )
A.H2SO3> I- >Fe2+>NO B. I- >Fe2+>H2SO3> NO
C.Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3> I-
A
学以致用
A
应用:(1)利用此规律可准确确定氧化产物和还原产物。
(2)可判断同种元素不同价态的原子间能否发生氧化还原反应。
归中规律:高价态+低价态―→中间价态,即“只靠拢,不交叉”“邻价转化”
同种元素不同价态之间发生氧化还原反应时:
歧化规律:中间价态→高价+低价(不会出现一边倒的情况)
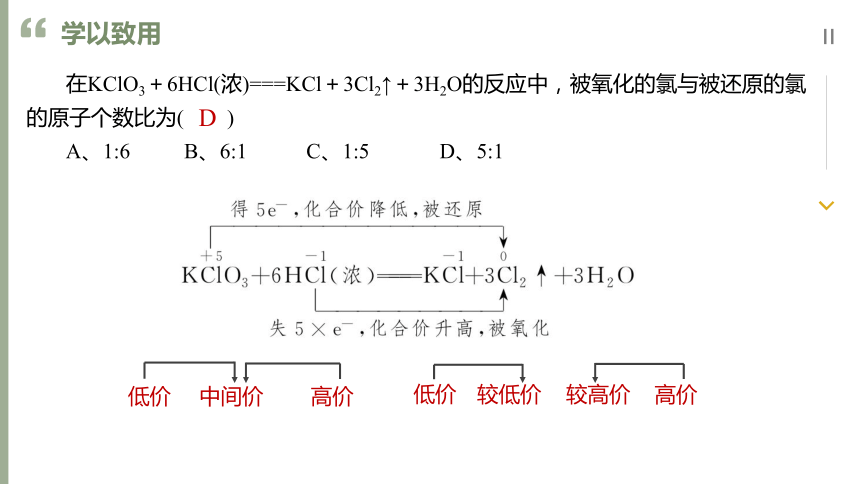
KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
2. 价态规律:
Cl2+2NaOH = NaCl+NaClO+H2O
一、氧化还原反应的基本规律
学以致用
已知 H2S 与浓硫酸反应的方程式如下,
H2S + H2SO4 (浓) === S↓ + SO2↑ + 2H2O
判断:两种画法哪一种是对的呢?
在KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为( )
A、1:6 B、6:1 C、1:5 D、5:1
D
低价
高价
中间价
较高价
高价
低价
较低价
学以致用
3. 电子得失守恒规律:
应用:氧化还原反应的配平、计算
C + 2CuO
CO2↑ + 2Cu
高温
微观本质:得到电子总数=失去电子总数=转移电子总数
宏观特征:化合价下降之和=化合价上升之和
氧化还原反应中,得失电子总数相等,元素化合价升降总数相等,
反应前后电荷总数相等(离子反应)。即有关系式:
一、氧化还原反应的基本规律
2.在硫酸溶液中NaClO3和Na2SO3按 2∶1数目之比完全反应,生成一种棕黄色气体X,其中Na2SO3被氧化为Na2SO4,则X为( )
A. ClO2 B. Cl2O C. Cl2 D. Cl2O3
1.含1.2×1020个Na2SO3的溶液恰好被含4×1019个K2Cr2O7的溶液氧化为Na2SO4,则元素Cr在被还原的产物中的化合价是( )
A.+6 B.+3 C.+2 D.0
N(氧化剂)×化合价变化值×变价原子个数=N(还原剂)×化合价变化值×变价原子个数
学以致用
B
A
4. 先后规律:
如把Fe--Al合金放入稀盐酸中,Al先反应,当Al反应完全后,Fe开始反应。
如Fe与CuCl2、HCl的混合溶液反应时,Fe先于Cu2+反应,后于H+反应。
(1)同一氧化剂与多种还原剂混合,还原性强的先被氧化。
(2)同一还原剂与多种氧化剂混合,氧化性强的先被还原。
一、氧化还原反应的基本规律
1. 已知 : Br2 + 2Fe2+ = 2Br- + 2Fe3+
向FeBr2溶液中通入少量Cl2时, _____先与Cl2反应。
已知:2Fe3++ Cu = 2Fe2++ Cu2+
在含有Fe3+、Cu2+、H+的溶液中加入铁粉,铁粉先与_______反应,
然后依次为 。
Cu2+、H+
Fe3+
Fe2+
学以致用
2.已知有如下三个氧化还原反应:
2Fe3++2I-===2Fe2++I2
2Fe2++Cl2===2Fe3++2Cl-
2MnO4-+16H+ 10Cl-===2Mn2++5Cl2↑+8H2O
若某溶液中Fe2+和I-共存,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
二、氧化还原反应的配平
原则:电子守恒、原子守恒、电荷守恒
配平步骤:
标变价
列得失/
写升降
求总数
标出变价元素的化合价
列出得失电子数
最小公倍数法配平使得失电子守恒(确定氧化剂与还原剂的系数)
配系数
用原子守恒法配平其它物质的化学计量数
查守恒
检查原子、电荷是否守恒,并将短线改等号
只有离子方程式需要检查电荷是否守恒!
二、氧化还原反应的配平
原则:电子守恒、原子守恒、电荷守恒
【例】配平化学方程式:H2S+HNO3→S↓+NO↑+H2O
1.标变价
2.列得失
3.等升降
H2S+HNO3→S↓+NO↑+H2O
-2 +5 0 +2
↑ 2e-
S :
0
-2
↓3e-
N :
+2
+5
2和3的最小公倍数是6,确定化学计量数。
×3
×2
4.配系数
5.查守恒
H2S+ HNO3 S↓+ NO↑+ H2O
3
3
2
2
4
=
最后利用O原子守恒来进行验证。
(3)___ KClO3+___ HCl(浓) =___ KCl+___ H2O+___ Cl2↑
(2)__KI+__KIO3+___H2SO4→___I2+___K2SO4+___H2O
5
1
3
3
3
3
(1)___ H2S +___SO2 →___S+___H2O
2
1
3
2
小结:归中反应使用正向配平法
1 6 1 3 3
1.正向配平法
二、氧化还原反应的配平
(1)___ HCl(浓)+___ MnO2 → ___ Cl2↑+___ MnCl2+___ H2O
(2) S + KOH → K2S + K2SO3 + H2O
(3) KClO3 → KCl + O2↑
小结:部分氧化还原反应、歧化反应、分解型氧化还原反应使用逆向配平法
4 1 1 1 2
3 6 2 1 3
2 2 3
2.逆向配平法
二、氧化还原反应的配平
(1) MnO4-+ H++ Br-→ Br2+ Mn2++ H2O
(3) Fe3+ + SO2 + H2O→ Fe2++ SO42-+ H+
(4) C2O42- + MnO4- + H+→ CO2+ Mn2++ H2O
小结:先配升降,再配电荷,后配原子
2 16 10 5 2 8
2 1 2 2 1 4
5 2 16 10 2 8
3.离子反应配平法
二、氧化还原反应的配平
(1) MnO4-+ H2O2 + → Mn2+ + O2↑ + H2O
(2) ClO-+ Fe(OH)3+ → Cl-+ FeO42-+ H2O
(3) Mn2++ ClO3-+ H2O→ MnO2↓+ + Cl2↑
(4) S2- + ClO- + H2O→ S↓+ + Cl-↑
2 5 6H+ 2 5 8
3 2 4OH- 3 2 5
5 2 4 5 8H+ 1
1 1 1 1 2OH- 1
4.缺项配平法
条件 补项原则(补写H+/OH-/水)
酸性条件下 缺H或多O补H+,少O补H2O
碱性条件下 缺H或多O补H2O,少O补OH-
二、氧化还原反应的配平
1.请配平下列离子方程式。
(1) 在酸性条件下,K2Cr2O7与FeSO4反应的离子方程式为
____Cr2O72-+ ___Fe2++___ ( )=____Cr3++___Fe3++___H2O,
(2) 在酸性条件下,SO2通入FeCl3溶液中反应离子方程式为
___Fe3++___SO2+___( )=___Fe2++___SO42- +___ ( )
1
6
14
H+
2
6
7
2
1
H2O
2
2
1
H+
4
2.在酸性条件下,可发生如下反应:
ClO3-+2M3++4H2O=M2O7n-+Cl-+8H+, M2O7n-中M的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
C
随堂练习
氧化还原反应的规律
电子守恒规律
本质
先后规律
强易弱难,先强后弱
价态规律
高低规律
归中规律
歧化规律
还原剂失去电子总数 = 氧化剂得到电子总数
表征
化合价升高总数 = 化合价降低总数
中间价→高价+低价
高价+低价→中间价
(不交叉规律)
课堂小结
氧化还原反应的配平
氧化还原反应的分类
一般氧化还原反应
氧化还原反应的配平
配平原则
配平步骤
自身氧化还原反应
部分氧化还原反应
标变价、列得失
等升降、配系数
查守恒
配平技巧
全变左边配
自变右边配
部分变两边配
整体配平法
缺项配平
课堂小结
氧化还原反应规律及应用
第一章 物质的分类及转化
学习目标
1.掌握氧化还原反应的规律。
2.掌握氧化还原反应的配平原理及方法技巧。
一、氧化还原反应的基本规律
1. 强弱规律:
根据氧化还原反应方程式:
氧化剂 + 还原剂 = 还原产物 + 氧化产物
氧化性强
还原性强
还原性弱
氧化性弱
注意:氧化性、还原性的强弱取决于:物质得失电子的难易程度,
与得失电子数目的多少无关。
应用:比较粒子氧化性或还原性强弱;(剂 >物)
判断氧化还原反应在一定条件下能否发生;(强制弱)
根据下列反应:
H2SO3 + I2 + H2O == 2HI + H2SO4
2FeCl3 + 2HI == 2FeCl2 + 2HCl + I2
3FeCl2+4HNO3==2FeCl3 + NO↑+ 2H2O +Fe(NO3)3
判断有关物质还原性由强到弱的顺序是( )
A.H2SO3> I- >Fe2+>NO B. I- >Fe2+>H2SO3> NO
C.Fe2+>I->H2SO3>NO D. NO>Fe2+>H2SO3> I-
A
学以致用
A
应用:(1)利用此规律可准确确定氧化产物和还原产物。
(2)可判断同种元素不同价态的原子间能否发生氧化还原反应。
归中规律:高价态+低价态―→中间价态,即“只靠拢,不交叉”“邻价转化”
同种元素不同价态之间发生氧化还原反应时:
歧化规律:中间价态→高价+低价(不会出现一边倒的情况)
KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
2. 价态规律:
Cl2+2NaOH = NaCl+NaClO+H2O
一、氧化还原反应的基本规律
学以致用
已知 H2S 与浓硫酸反应的方程式如下,
H2S + H2SO4 (浓) === S↓ + SO2↑ + 2H2O
判断:两种画法哪一种是对的呢?
在KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为( )
A、1:6 B、6:1 C、1:5 D、5:1
D
低价
高价
中间价
较高价
高价
低价
较低价
学以致用
3. 电子得失守恒规律:
应用:氧化还原反应的配平、计算
C + 2CuO
CO2↑ + 2Cu
高温
微观本质:得到电子总数=失去电子总数=转移电子总数
宏观特征:化合价下降之和=化合价上升之和
氧化还原反应中,得失电子总数相等,元素化合价升降总数相等,
反应前后电荷总数相等(离子反应)。即有关系式:
一、氧化还原反应的基本规律
2.在硫酸溶液中NaClO3和Na2SO3按 2∶1数目之比完全反应,生成一种棕黄色气体X,其中Na2SO3被氧化为Na2SO4,则X为( )
A. ClO2 B. Cl2O C. Cl2 D. Cl2O3
1.含1.2×1020个Na2SO3的溶液恰好被含4×1019个K2Cr2O7的溶液氧化为Na2SO4,则元素Cr在被还原的产物中的化合价是( )
A.+6 B.+3 C.+2 D.0
N(氧化剂)×化合价变化值×变价原子个数=N(还原剂)×化合价变化值×变价原子个数
学以致用
B
A
4. 先后规律:
如把Fe--Al合金放入稀盐酸中,Al先反应,当Al反应完全后,Fe开始反应。
如Fe与CuCl2、HCl的混合溶液反应时,Fe先于Cu2+反应,后于H+反应。
(1)同一氧化剂与多种还原剂混合,还原性强的先被氧化。
(2)同一还原剂与多种氧化剂混合,氧化性强的先被还原。
一、氧化还原反应的基本规律
1. 已知 : Br2 + 2Fe2+ = 2Br- + 2Fe3+
向FeBr2溶液中通入少量Cl2时, _____先与Cl2反应。
已知:2Fe3++ Cu = 2Fe2++ Cu2+
在含有Fe3+、Cu2+、H+的溶液中加入铁粉,铁粉先与_______反应,
然后依次为 。
Cu2+、H+
Fe3+
Fe2+
学以致用
2.已知有如下三个氧化还原反应:
2Fe3++2I-===2Fe2++I2
2Fe2++Cl2===2Fe3++2Cl-
2MnO4-+16H+ 10Cl-===2Mn2++5Cl2↑+8H2O
若某溶液中Fe2+和I-共存,要除去I-而不氧化Fe2+和Cl-,可以加入的试剂是( )
A.Cl2 B.KMnO4 C.FeCl3 D.HCl
C
二、氧化还原反应的配平
原则:电子守恒、原子守恒、电荷守恒
配平步骤:
标变价
列得失/
写升降
求总数
标出变价元素的化合价
列出得失电子数
最小公倍数法配平使得失电子守恒(确定氧化剂与还原剂的系数)
配系数
用原子守恒法配平其它物质的化学计量数
查守恒
检查原子、电荷是否守恒,并将短线改等号
只有离子方程式需要检查电荷是否守恒!
二、氧化还原反应的配平
原则:电子守恒、原子守恒、电荷守恒
【例】配平化学方程式:H2S+HNO3→S↓+NO↑+H2O
1.标变价
2.列得失
3.等升降
H2S+HNO3→S↓+NO↑+H2O
-2 +5 0 +2
↑ 2e-
S :
0
-2
↓3e-
N :
+2
+5
2和3的最小公倍数是6,确定化学计量数。
×3
×2
4.配系数
5.查守恒
H2S+ HNO3 S↓+ NO↑+ H2O
3
3
2
2
4
=
最后利用O原子守恒来进行验证。
(3)___ KClO3+___ HCl(浓) =___ KCl+___ H2O+___ Cl2↑
(2)__KI+__KIO3+___H2SO4→___I2+___K2SO4+___H2O
5
1
3
3
3
3
(1)___ H2S +___SO2 →___S+___H2O
2
1
3
2
小结:归中反应使用正向配平法
1 6 1 3 3
1.正向配平法
二、氧化还原反应的配平
(1)___ HCl(浓)+___ MnO2 → ___ Cl2↑+___ MnCl2+___ H2O
(2) S + KOH → K2S + K2SO3 + H2O
(3) KClO3 → KCl + O2↑
小结:部分氧化还原反应、歧化反应、分解型氧化还原反应使用逆向配平法
4 1 1 1 2
3 6 2 1 3
2 2 3
2.逆向配平法
二、氧化还原反应的配平
(1) MnO4-+ H++ Br-→ Br2+ Mn2++ H2O
(3) Fe3+ + SO2 + H2O→ Fe2++ SO42-+ H+
(4) C2O42- + MnO4- + H+→ CO2+ Mn2++ H2O
小结:先配升降,再配电荷,后配原子
2 16 10 5 2 8
2 1 2 2 1 4
5 2 16 10 2 8
3.离子反应配平法
二、氧化还原反应的配平
(1) MnO4-+ H2O2 + → Mn2+ + O2↑ + H2O
(2) ClO-+ Fe(OH)3+ → Cl-+ FeO42-+ H2O
(3) Mn2++ ClO3-+ H2O→ MnO2↓+ + Cl2↑
(4) S2- + ClO- + H2O→ S↓+ + Cl-↑
2 5 6H+ 2 5 8
3 2 4OH- 3 2 5
5 2 4 5 8H+ 1
1 1 1 1 2OH- 1
4.缺项配平法
条件 补项原则(补写H+/OH-/水)
酸性条件下 缺H或多O补H+,少O补H2O
碱性条件下 缺H或多O补H2O,少O补OH-
二、氧化还原反应的配平
1.请配平下列离子方程式。
(1) 在酸性条件下,K2Cr2O7与FeSO4反应的离子方程式为
____Cr2O72-+ ___Fe2++___ ( )=____Cr3++___Fe3++___H2O,
(2) 在酸性条件下,SO2通入FeCl3溶液中反应离子方程式为
___Fe3++___SO2+___( )=___Fe2++___SO42- +___ ( )
1
6
14
H+
2
6
7
2
1
H2O
2
2
1
H+
4
2.在酸性条件下,可发生如下反应:
ClO3-+2M3++4H2O=M2O7n-+Cl-+8H+, M2O7n-中M的化合价是 ( )
A.+4 B.+5 C.+6 D.+7
C
随堂练习
氧化还原反应的规律
电子守恒规律
本质
先后规律
强易弱难,先强后弱
价态规律
高低规律
归中规律
歧化规律
还原剂失去电子总数 = 氧化剂得到电子总数
表征
化合价升高总数 = 化合价降低总数
中间价→高价+低价
高价+低价→中间价
(不交叉规律)
课堂小结
氧化还原反应的配平
氧化还原反应的分类
一般氧化还原反应
氧化还原反应的配平
配平原则
配平步骤
自身氧化还原反应
部分氧化还原反应
标变价、列得失
等升降、配系数
查守恒
配平技巧
全变左边配
自变右边配
部分变两边配
整体配平法
缺项配平
课堂小结
