1.3 课时2 氧化剂和还原剂 课件(共30张PPT) 2025-2026学年人教版(2019)高中化学必修第一册
文档属性
| 名称 | 1.3 课时2 氧化剂和还原剂 课件(共30张PPT) 2025-2026学年人教版(2019)高中化学必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 20.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 00:00:00 | ||
图片预览









文档简介
第一章 物质及其变化
回顾氧化还原反应概念
元素化合价降低的物质被 ,发生
元素化合价升高的物质被 ,发生
1、氧化还原反应的特征是 (判定依据)
“升失氧;降得还”
元素化合价变化
电子转移(电子得失或共用电子对偏移)
氧化
(化合价变化原因)
2、氧化还原反应的本质是
降低
氧化反应
还原
还原反应
,物质发生
得到电子的元素化合价
还原反应
升高
,物质发生
失去电子的元素化合价
氧化反应
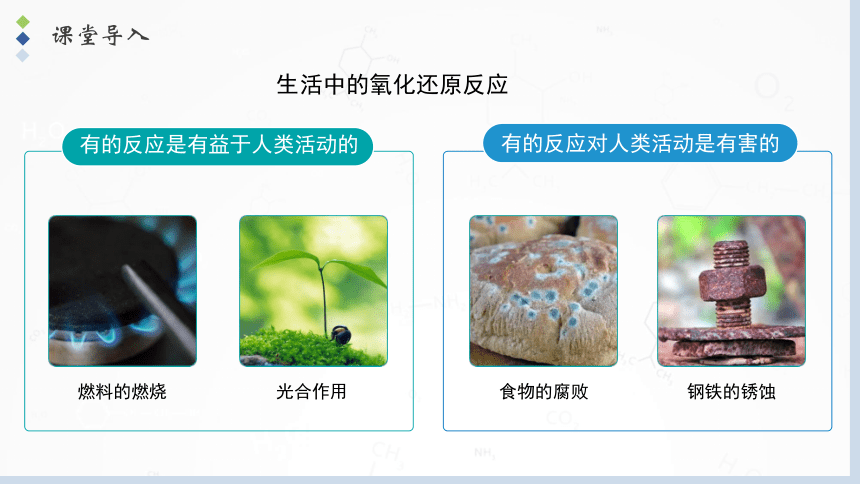
课堂导入
生活中的氧化还原反应
燃料的燃烧
光合作用
钢铁的锈蚀
食物的腐败
有的反应是有益于人类活动的
有的反应对人类活动是有害的
课堂导入
1、氧化剂、还原剂、氧化产物、还原产物如何确定?
2、如何判断氧化性、还原性强弱?
课前思考:
学习任务:
目标一:氧化剂、还原剂的相关概念
目标二:常见的氧化剂、还原剂
目标三:常见的氧化剂、还原剂强弱判断
目标一:氧化剂、还原剂的相关概念
2Na+Cl2 2NaCl
2e-
CuO
+
H2
Cu
+
H2O
还原剂
氧化剂
还原剂
氧化剂
还原剂
氧化剂
e-
失电子
(或电子对偏离)
的物质
得电子
(或电子对偏向)
的物质
还原剂和氧化剂的关系
氧化剂:元素化合价降低,即得到电子(或电子对偏移)的物质。
还原剂:元素化合价升高,即失去电子(或电子对偏离)的物质。
“两剂”是指某一反应物,而不是指某一元素。
2e-
【概念1】:氧化剂、还原剂
目标一:氧化剂、还原剂的相关概念
还原剂
氧化剂
还原产物
氧化产物
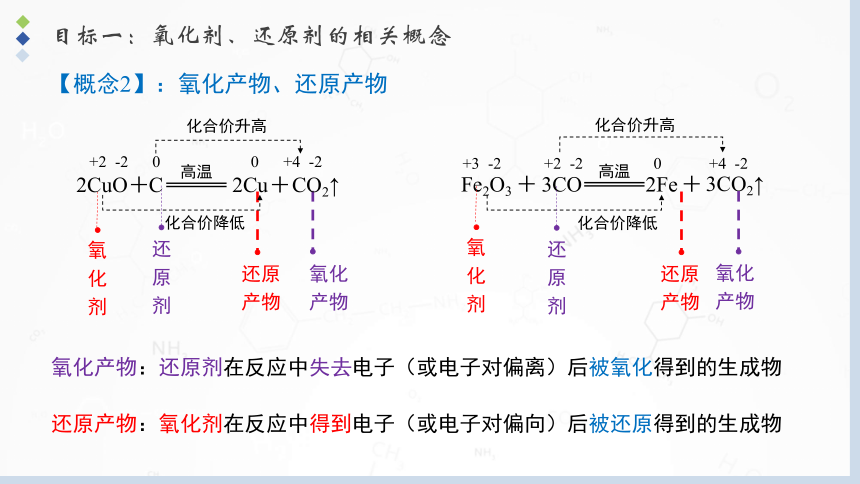
高温
Fe2O3
+
3CO
2Fe
+
3CO2↑
-2
+4
-2
+2
-2
0
+3
高温
2CuO
+
C
2Cu
+
CO2↑
+2
-2
0
0
+4
-2
化合价降低
化合价升高
化合价降低
化合价升高
还原产物
氧化产物
还原产物:氧化剂在反应中得到电子(或电子对偏向)后被还原得到的生成物
氧化产物:还原剂在反应中失去电子(或电子对偏离)后被氧化得到的生成物
氧化剂
还原剂
【概念2】:氧化产物、还原产物
氧化性:物质得电子性质,氧化剂具有氧化性。
还原性:物质失电子性质,还原剂具有还原性。
(什么剂具有什么性)
【概念辨析】物质得失电子数目越多,物质的氧化性、还原性就越强?
物质氧化性或还原性的强弱取决于其得失电子的难易程度,与得失电子的多少无关。
物质得电子越容易氧化性越强;失电子越容易还原性越强
【概念3】:氧化性、还原性
目标一:氧化剂、还原剂的相关概念
目标一:氧化剂、还原剂的相关概念
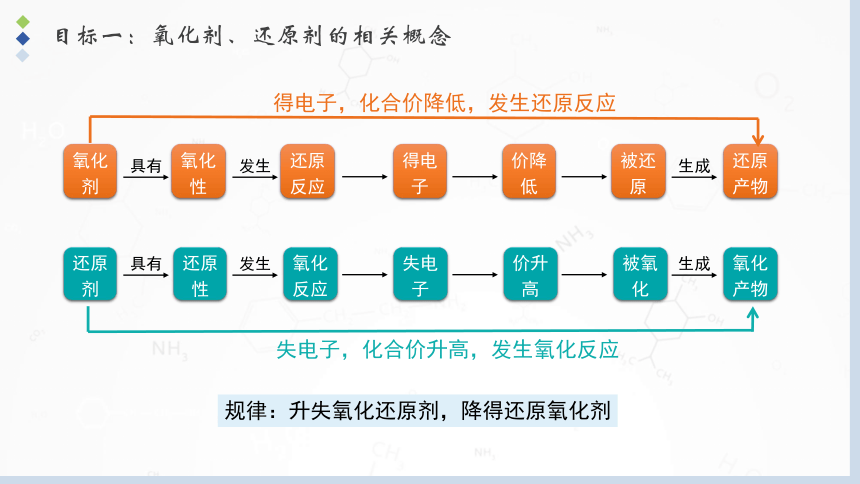
规律:升失氧化还原剂,降得还原氧化剂
氧化剂
氧化
性
还原
反应
得电
子
价降
低
被还
原
还原
产物
还原
剂
还原
性
氧化
反应
失电
子
价升
高
被氧
化
氧化
产物
具有
发生
生成
具有
发生
生成
得电子,化合价降低,发生还原反应
失电子,化合价升高,发生氧化反应
即时反馈
2Na + Cl2 2NaCl
1.指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物。
(3)
(1)
(4)
(2)
CuCl 2 + Zn==Cu + ZnCl 2
氧化剂
还原剂
还原产物
氧化产物
氧化剂
还原剂
氧化产物
还原产物
2KMnO4 K2MnO4 + MnO2 + O2↑
?
氧化剂
还原剂
氧化产物
还原产物
还原产物
Cl2 + H2O == HCl + HClO
?
氧化剂
还原剂
还原产物
氧化产物
【注意】在有些反应中,氧化剂和还原剂可能是同一物质;氧化产物和还原产物可能是同一物质
即时反馈
1.对于此反应:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O,氧化剂为_________,发生氧化反应的是____________,还原产物是______。
2.对于此反应:3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O,氧化剂是______,还原剂是____________,氧化产物是__________。
3.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S + 2KNO3 +3C =K2S +N2↑+ 3CO2↑。在该反应中被还原的元素是_______,氧化剂是_______。
HNO3
Cu
NO
Cl2
Cl2
KClO3
N
S、C
4. 2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是_____;氧化产物是____,还原产物是_____。
SO2
H2S
S
S
2.相关概念辨析
目标二:常见的氧化剂、还原剂
1、氧化剂: 具有氧化性,易得电子,高价态物质。
O2 , Cl2
CuO , Fe2O3
KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3
Fe3+ , H+
1)活泼的非金属单质:
2)高价的氧化物:
3)高价的含氧酸及其盐:
4)某些阳离子:
目标二:常见的氧化剂、还原剂
2、还原剂: 具有还原性,失电子,低价态物质
中间价态的化合物,在氧化还原反应中既能得到电子又能失去电子,既能做氧化剂又能做还原剂,例如H2O2、SO2、SO32-等。
(1)活泼的金属单质:
K , Na , Mg , Fe , Al
(2)某些非金属单质:
H2 , C , S
(3)变价元素的低价态物质:
CO ,H2S, Cu2O
(4)某些阴离子:
I-, S2-
目标二:常见的氧化剂、还原剂
3.元素处于中间价态,则既有氧化性又有还原性
2.元素处于低价态具有还原性,最低价态,则只具有还原性
元素处于高价态具有氧化性,最高价态,则只具有氧化性
宏观辨识——根据元素的化合价进行判断
【练】下列物质只具有氧化性的是( );只具有还原性的是( );即具有氧化性又具有还原性的是( )。
A. HCl B. Cu2+ C. Cl2 D. I- E. F2
BE
D
AC
目标二:常见的氧化剂、还原剂
资料卡片——常见的氧化剂/还原剂及其一般对应产物
氧化剂
对应还原产物
?
还原剂
对应氧化产物
Fe3+
Fe2+
Fe2+
Fe3+
浓H2SO4
SO2
SO2、SO32?、S2O32?
SO42?
H2O2
H2O
H2O2
O2
KMnO4(H+)、MnO2
Mn2+
H2C2O4
CO2
K2Cr2O7(H+)
Cr3+
I-
I2
O2
O2-
CO、C
CO2
浓HNO3
NO2
S2-、H2S
S
稀HNO3
NO
NH3
N2、NO
Cl2、ClO-、ClO3??
Cl-
?
?
氧化剂
对应还原产物
?
还原剂
对应氧化产物
Fe3+
Fe2+
Fe2+
Fe3+
浓H2SO4
SO2
H2O2
H2O
H2O2
O2
KMnO4(H+)、MnO2
Mn2+
H2C2O4
CO2
K2Cr2O7(H+)
Cr3+
I-
I2
O2
O2-
CO、C
CO2
浓HNO3
NO2
S2-、H2S
S
稀HNO3
NO
NH3
N2、NO
Cl-
?
?
即时反馈
(1)Fe→FeCl3,需要加________剂,如: ________
(2)CuO→Cu,需要加________剂,如:________
(3)HCl→Cl2是________反应,HCl是________剂。
(4)HCl→H2是________反应,HCl是________剂。
(5)Fe3+→Fe,需要加________剂,Fe3+具有______性
氧化
Cl2
氧化
氧化
还原
还原
还原
还原
H2
氧化
3.分析下列变化:
即时反馈
4.吸进人体内的氧有2%转化为氧化性极强的活性氧,活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.作还原剂
B.作氧化剂
C.既作氧化剂又作还原剂
D.以上均不是
A
即时反馈
5.实现下列物质之间的转化,需要加入还原剂才能实现的是 ( )。
A. SO3→ H2SO4
B.Cu→ Cu(NO)3
C. CuO→ Cu
D.CO→ CO2
氧化剂 + 还原剂 = 还原产物 + 氧化产物
C
目标三:常见的氧化剂、还原剂强弱判断
氧化性还原性强弱主要取决于物质本身得失电子的难易程度,而不取决于得失电子数目的多少。
核心元素化合价
实例
性质
最高价
只有____________
中间价
既有____________
又有____________
最低价
只有____________
氧化性
氧化性
还原性
还原性
目标三:常见的氧化剂、还原剂强弱判断
反应中Fe是_____剂,Cu是_____产物。
例如:Fe+CuSO4===FeSO4+Cu
还原
还原
金属的还原性:Fe>Cu
反应中CuSO4是_____剂, FeSO4是_____产物。
氧化
氧化
离子的氧化性: CuSO4 > FeSO4
非金属单质的氧化性越强,对应阴离子的还原性越弱
金属单质的还原性越强,对应阳离子的氧化性越弱
目标三:常见的氧化剂、还原剂强弱判断
>
>
氧化性:
氧化剂___氧化产物
还原性:
还原剂___还原产物
即时反馈
①I2+SO2+2H2O= = = H2SO4+2HI
③2FeCl2+Cl2 = = = 2FeCl3
②2FeCl3+2HI = = = 2FeCl2+2HCl+I2
氧化性:I2 > H2SO4
还原性:SO2 > HI
氧化性:Cl2 > FeCl3
还原性:FeCl2 > FeCl3
氧化性:FeCl3 > I2
还原性:HI > FeCl2
6.比较下列物质的氧化性、还原性强弱:
目标三:常见的氧化剂、还原剂强弱判断
反应条件越简单,说明反应越容易发生,说明物质的氧化性/还原性越强
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓)===MnCl2 + 2H2O + Cl2↑
氧化性:_____________________________
KMnO4>MnO2
目标三:常见的氧化剂、还原剂强弱判断
同一还原剂被不同的氧化剂氧化时,元素化合价升的越高,说明氧化剂的氧化性越强
2Fe + 3Cl2 2FeCl3
Fe + S FeS
氧化性:__________
点燃
△
Cl2 > S
目标三:常见的氧化剂、还原剂强弱判断
Cu + 2Fe3+ ==== Cu2+ + 2Fe2+
3Zn + 2Fe3+ ==== 3Zn2+ + 2Fe
还原性:__________
Zn > Cu
同一氧化剂被不同的还原剂还原时,元素化合价降的越低,说明还原剂的还原性越强
目标三:常见的氧化剂、还原剂强弱判断
同一物质在不同的条件下,其氧化性/还原性会有所不同。
(1)温度:①氧化性:浓硫酸(热)>浓硫酸(冷);
②还原性:浓盐酸(热)>浓盐酸(冷)。
(2)浓度:HNO3(浓) > HNO3(稀)
(3)pH:
①中性环境中?NO3? 不显氧化性,酸性环境中 NO3? 显强氧化性;
②KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
?
即时反馈
6.现有下列几个离子反应,下列有关性质的比较正确的是( )
①Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O
②2Fe2++Cl2=2Fe3++2Cl-
③2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
A.氧化性:Cr2O72->Cl2>Fe3+>SO42-
B.氧化性:Fe3+>SO42->Cl2>Cr2O72-
C.还原性:SO2D.还原性:Cl->Cr3+>Fe2+>SO2
A
即时反馈
7.根据反应式:①2Fe3++2I-=2Fe2++I2,
②Br2+2Fe2+=2Br-+2Fe3+,
可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I-
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
B
生活中氧化还原反应的应用
红酒中添加二氧化硫的原因:
红酒的某些成分在储存的过程中会被氧气氧化,而使红酒的口感变差。所以我们应该在红酒中加入一些什么剂呢?
还原剂
二氧化硫就是这种加入的还原剂,所以我们说二氧化硫应该具有还原性
随堂练习
1、已知X2、Y2、Z2、W2四种物质的氧化性由强到弱的顺序为W2>Z2>X2>Y2,下列氧化还原反应能发生的是 ( )
A.2NaW+Z2=2NaZ+W2
B.2NaX+Z2=2NaZ+X2
C.2NaW+Y2=2NaY+W2
D.2NaZ+X2=2NaX+Z2
2、下列过程中,必须加入氧化剂才能实现的是 ( )
A、HCl →H2 B、H2O→O2
C、H2SO4→SO2 D、Fe→Fe3O4
B
D
随堂练习
3.常温下,发生下列反应:
①16H++10Cl-+ ===2Mn2++5Cl2↑+8H2O
②2Fe2++Br2===2Fe3++2Br-
③2Br-+Cl2===Br2+2Cl-
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是__________________。
MnO4->Cl2>Br2>Fe3+
4.已知H2能与Cl2、Br2发生反应,前者反应的条件是点燃或光照,后者反应的条件是高温,Cl2和Br2的氧化性强弱关系是________。
Cl2>Br2。与同一还原剂反应时,反应越容易进行,则氧化剂的氧化性越强,故氧化性强弱关系为Cl2>Br2。
回顾氧化还原反应概念
元素化合价降低的物质被 ,发生
元素化合价升高的物质被 ,发生
1、氧化还原反应的特征是 (判定依据)
“升失氧;降得还”
元素化合价变化
电子转移(电子得失或共用电子对偏移)
氧化
(化合价变化原因)
2、氧化还原反应的本质是
降低
氧化反应
还原
还原反应
,物质发生
得到电子的元素化合价
还原反应
升高
,物质发生
失去电子的元素化合价
氧化反应
课堂导入
生活中的氧化还原反应
燃料的燃烧
光合作用
钢铁的锈蚀
食物的腐败
有的反应是有益于人类活动的
有的反应对人类活动是有害的
课堂导入
1、氧化剂、还原剂、氧化产物、还原产物如何确定?
2、如何判断氧化性、还原性强弱?
课前思考:
学习任务:
目标一:氧化剂、还原剂的相关概念
目标二:常见的氧化剂、还原剂
目标三:常见的氧化剂、还原剂强弱判断
目标一:氧化剂、还原剂的相关概念
2Na+Cl2 2NaCl
2e-
CuO
+
H2
Cu
+
H2O
还原剂
氧化剂
还原剂
氧化剂
还原剂
氧化剂
e-
失电子
(或电子对偏离)
的物质
得电子
(或电子对偏向)
的物质
还原剂和氧化剂的关系
氧化剂:元素化合价降低,即得到电子(或电子对偏移)的物质。
还原剂:元素化合价升高,即失去电子(或电子对偏离)的物质。
“两剂”是指某一反应物,而不是指某一元素。
2e-
【概念1】:氧化剂、还原剂
目标一:氧化剂、还原剂的相关概念
还原剂
氧化剂
还原产物
氧化产物
高温
Fe2O3
+
3CO
2Fe
+
3CO2↑
-2
+4
-2
+2
-2
0
+3
高温
2CuO
+
C
2Cu
+
CO2↑
+2
-2
0
0
+4
-2
化合价降低
化合价升高
化合价降低
化合价升高
还原产物
氧化产物
还原产物:氧化剂在反应中得到电子(或电子对偏向)后被还原得到的生成物
氧化产物:还原剂在反应中失去电子(或电子对偏离)后被氧化得到的生成物
氧化剂
还原剂
【概念2】:氧化产物、还原产物
氧化性:物质得电子性质,氧化剂具有氧化性。
还原性:物质失电子性质,还原剂具有还原性。
(什么剂具有什么性)
【概念辨析】物质得失电子数目越多,物质的氧化性、还原性就越强?
物质氧化性或还原性的强弱取决于其得失电子的难易程度,与得失电子的多少无关。
物质得电子越容易氧化性越强;失电子越容易还原性越强
【概念3】:氧化性、还原性
目标一:氧化剂、还原剂的相关概念
目标一:氧化剂、还原剂的相关概念
规律:升失氧化还原剂,降得还原氧化剂
氧化剂
氧化
性
还原
反应
得电
子
价降
低
被还
原
还原
产物
还原
剂
还原
性
氧化
反应
失电
子
价升
高
被氧
化
氧化
产物
具有
发生
生成
具有
发生
生成
得电子,化合价降低,发生还原反应
失电子,化合价升高,发生氧化反应
即时反馈
2Na + Cl2 2NaCl
1.指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物。
(3)
(1)
(4)
(2)
CuCl 2 + Zn==Cu + ZnCl 2
氧化剂
还原剂
还原产物
氧化产物
氧化剂
还原剂
氧化产物
还原产物
2KMnO4 K2MnO4 + MnO2 + O2↑
?
氧化剂
还原剂
氧化产物
还原产物
还原产物
Cl2 + H2O == HCl + HClO
?
氧化剂
还原剂
还原产物
氧化产物
【注意】在有些反应中,氧化剂和还原剂可能是同一物质;氧化产物和还原产物可能是同一物质
即时反馈
1.对于此反应:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O,氧化剂为_________,发生氧化反应的是____________,还原产物是______。
2.对于此反应:3Cl2 + 6KOH = KClO3 + 5KCl + 3H2O,氧化剂是______,还原剂是____________,氧化产物是__________。
3.我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时的反应为:S + 2KNO3 +3C =K2S +N2↑+ 3CO2↑。在该反应中被还原的元素是_______,氧化剂是_______。
HNO3
Cu
NO
Cl2
Cl2
KClO3
N
S、C
4. 2H2S+SO2===3S↓+2H2O
氧化剂是_____,还原剂是_____;氧化产物是____,还原产物是_____。
SO2
H2S
S
S
2.相关概念辨析
目标二:常见的氧化剂、还原剂
1、氧化剂: 具有氧化性,易得电子,高价态物质。
O2 , Cl2
CuO , Fe2O3
KMnO4 , K2Cr2O7 , 浓H2SO4 , HNO3 , KClO3
Fe3+ , H+
1)活泼的非金属单质:
2)高价的氧化物:
3)高价的含氧酸及其盐:
4)某些阳离子:
目标二:常见的氧化剂、还原剂
2、还原剂: 具有还原性,失电子,低价态物质
中间价态的化合物,在氧化还原反应中既能得到电子又能失去电子,既能做氧化剂又能做还原剂,例如H2O2、SO2、SO32-等。
(1)活泼的金属单质:
K , Na , Mg , Fe , Al
(2)某些非金属单质:
H2 , C , S
(3)变价元素的低价态物质:
CO ,H2S, Cu2O
(4)某些阴离子:
I-, S2-
目标二:常见的氧化剂、还原剂
3.元素处于中间价态,则既有氧化性又有还原性
2.元素处于低价态具有还原性,最低价态,则只具有还原性
元素处于高价态具有氧化性,最高价态,则只具有氧化性
宏观辨识——根据元素的化合价进行判断
【练】下列物质只具有氧化性的是( );只具有还原性的是( );即具有氧化性又具有还原性的是( )。
A. HCl B. Cu2+ C. Cl2 D. I- E. F2
BE
D
AC
目标二:常见的氧化剂、还原剂
资料卡片——常见的氧化剂/还原剂及其一般对应产物
氧化剂
对应还原产物
?
还原剂
对应氧化产物
Fe3+
Fe2+
Fe2+
Fe3+
浓H2SO4
SO2
SO2、SO32?、S2O32?
SO42?
H2O2
H2O
H2O2
O2
KMnO4(H+)、MnO2
Mn2+
H2C2O4
CO2
K2Cr2O7(H+)
Cr3+
I-
I2
O2
O2-
CO、C
CO2
浓HNO3
NO2
S2-、H2S
S
稀HNO3
NO
NH3
N2、NO
Cl2、ClO-、ClO3??
Cl-
?
?
氧化剂
对应还原产物
?
还原剂
对应氧化产物
Fe3+
Fe2+
Fe2+
Fe3+
浓H2SO4
SO2
H2O2
H2O
H2O2
O2
KMnO4(H+)、MnO2
Mn2+
H2C2O4
CO2
K2Cr2O7(H+)
Cr3+
I-
I2
O2
O2-
CO、C
CO2
浓HNO3
NO2
S2-、H2S
S
稀HNO3
NO
NH3
N2、NO
Cl-
?
?
即时反馈
(1)Fe→FeCl3,需要加________剂,如: ________
(2)CuO→Cu,需要加________剂,如:________
(3)HCl→Cl2是________反应,HCl是________剂。
(4)HCl→H2是________反应,HCl是________剂。
(5)Fe3+→Fe,需要加________剂,Fe3+具有______性
氧化
Cl2
氧化
氧化
还原
还原
还原
还原
H2
氧化
3.分析下列变化:
即时反馈
4.吸进人体内的氧有2%转化为氧化性极强的活性氧,活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.作还原剂
B.作氧化剂
C.既作氧化剂又作还原剂
D.以上均不是
A
即时反馈
5.实现下列物质之间的转化,需要加入还原剂才能实现的是 ( )。
A. SO3→ H2SO4
B.Cu→ Cu(NO)3
C. CuO→ Cu
D.CO→ CO2
氧化剂 + 还原剂 = 还原产物 + 氧化产物
C
目标三:常见的氧化剂、还原剂强弱判断
氧化性还原性强弱主要取决于物质本身得失电子的难易程度,而不取决于得失电子数目的多少。
核心元素化合价
实例
性质
最高价
只有____________
中间价
既有____________
又有____________
最低价
只有____________
氧化性
氧化性
还原性
还原性
目标三:常见的氧化剂、还原剂强弱判断
反应中Fe是_____剂,Cu是_____产物。
例如:Fe+CuSO4===FeSO4+Cu
还原
还原
金属的还原性:Fe>Cu
反应中CuSO4是_____剂, FeSO4是_____产物。
氧化
氧化
离子的氧化性: CuSO4 > FeSO4
非金属单质的氧化性越强,对应阴离子的还原性越弱
金属单质的还原性越强,对应阳离子的氧化性越弱
目标三:常见的氧化剂、还原剂强弱判断
>
>
氧化性:
氧化剂___氧化产物
还原性:
还原剂___还原产物
即时反馈
①I2+SO2+2H2O= = = H2SO4+2HI
③2FeCl2+Cl2 = = = 2FeCl3
②2FeCl3+2HI = = = 2FeCl2+2HCl+I2
氧化性:I2 > H2SO4
还原性:SO2 > HI
氧化性:Cl2 > FeCl3
还原性:FeCl2 > FeCl3
氧化性:FeCl3 > I2
还原性:HI > FeCl2
6.比较下列物质的氧化性、还原性强弱:
目标三:常见的氧化剂、还原剂强弱判断
反应条件越简单,说明反应越容易发生,说明物质的氧化性/还原性越强
2KMnO4 + 16HCl(浓) === 2KCl + 2MnCl2 + 8H2O + 5Cl2↑
MnO2 + 4HCl(浓)===MnCl2 + 2H2O + Cl2↑
氧化性:_____________________________
KMnO4>MnO2
目标三:常见的氧化剂、还原剂强弱判断
同一还原剂被不同的氧化剂氧化时,元素化合价升的越高,说明氧化剂的氧化性越强
2Fe + 3Cl2 2FeCl3
Fe + S FeS
氧化性:__________
点燃
△
Cl2 > S
目标三:常见的氧化剂、还原剂强弱判断
Cu + 2Fe3+ ==== Cu2+ + 2Fe2+
3Zn + 2Fe3+ ==== 3Zn2+ + 2Fe
还原性:__________
Zn > Cu
同一氧化剂被不同的还原剂还原时,元素化合价降的越低,说明还原剂的还原性越强
目标三:常见的氧化剂、还原剂强弱判断
同一物质在不同的条件下,其氧化性/还原性会有所不同。
(1)温度:①氧化性:浓硫酸(热)>浓硫酸(冷);
②还原性:浓盐酸(热)>浓盐酸(冷)。
(2)浓度:HNO3(浓) > HNO3(稀)
(3)pH:
①中性环境中?NO3? 不显氧化性,酸性环境中 NO3? 显强氧化性;
②KMnO4(酸性)>KMnO4(中性)>KMnO4(碱性)
?
即时反馈
6.现有下列几个离子反应,下列有关性质的比较正确的是( )
①Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O
②2Fe2++Cl2=2Fe3++2Cl-
③2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
A.氧化性:Cr2O72->Cl2>Fe3+>SO42-
B.氧化性:Fe3+>SO42->Cl2>Cr2O72-
C.还原性:SO2
A
即时反馈
7.根据反应式:①2Fe3++2I-=2Fe2++I2,
②Br2+2Fe2+=2Br-+2Fe3+,
可判断离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I-
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-
B
生活中氧化还原反应的应用
红酒中添加二氧化硫的原因:
红酒的某些成分在储存的过程中会被氧气氧化,而使红酒的口感变差。所以我们应该在红酒中加入一些什么剂呢?
还原剂
二氧化硫就是这种加入的还原剂,所以我们说二氧化硫应该具有还原性
随堂练习
1、已知X2、Y2、Z2、W2四种物质的氧化性由强到弱的顺序为W2>Z2>X2>Y2,下列氧化还原反应能发生的是 ( )
A.2NaW+Z2=2NaZ+W2
B.2NaX+Z2=2NaZ+X2
C.2NaW+Y2=2NaY+W2
D.2NaZ+X2=2NaX+Z2
2、下列过程中,必须加入氧化剂才能实现的是 ( )
A、HCl →H2 B、H2O→O2
C、H2SO4→SO2 D、Fe→Fe3O4
B
D
随堂练习
3.常温下,发生下列反应:
①16H++10Cl-+ ===2Mn2++5Cl2↑+8H2O
②2Fe2++Br2===2Fe3++2Br-
③2Br-+Cl2===Br2+2Cl-
根据上述反应,可得知相关微粒氧化性由强到弱的顺序是__________________。
MnO4->Cl2>Br2>Fe3+
4.已知H2能与Cl2、Br2发生反应,前者反应的条件是点燃或光照,后者反应的条件是高温,Cl2和Br2的氧化性强弱关系是________。
Cl2>Br2。与同一还原剂反应时,反应越容易进行,则氧化剂的氧化性越强,故氧化性强弱关系为Cl2>Br2。
