1.2 课时3 离子反应的应用 课件(共26张PPT) 2025-2026学年人教版(2019)高中化学必修第一册
文档属性
| 名称 | 1.2 课时3 离子反应的应用 课件(共26张PPT) 2025-2026学年人教版(2019)高中化学必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 141.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-22 23:00:52 | ||
图片预览







文档简介
离子反应的应用
第一章 物质的分类及转化
学习目标
1. 掌握离子反应在物质制备、分离、提纯及鉴定中的原理和方法
2. 学会利用离子反应消除水中污染物的应用及原理
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
用实际参加反应的离子符号来表示反应的式子。?
Na2SO4 和BaCl2的反应的离子方程式:SO42-+ Ba2+=BaSO4↓
复习巩固
离子反应
离子方程式
一、离子方程式正误判断
1、看是否符合客观事实
2、看是否符合质量守恒
3、看是否符合电荷守恒
铁与稀盐酸反应:2Fe+6H+ ====2Fe3++3H2↑
铝与稀盐酸反应:Al+3H+ ==== Al3++H2↑
铜与稀盐酸反应:Cu + 2H+ = Cu2+ + H2↑
铜与氯化银反应:Cu + Ag+ = Cu2+ + Ag
金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
4、看物质拆分是否正确
CO32-+2H+ ==== H2O+CO2↑
碳酸钡和稀硝酸反应:
氢氧化铁与盐酸反应:H++OH-=H2O
碳酸钠与醋酸反应: CO32-+2H+=CO2↑+H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
BaCO3+2H+ ==== Ba2++H2O+CO2↑
一、离子方程式正误判断
6、看反应物的配比是否正确
Ba2++OH-+H++SO42-====BaSO4↓+H2O
Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O
5、看是否漏掉反应的离子
氢氧化钡和稀硫酸反应:
Ba2++SO42-====BaSO4↓
Ba(OH)2溶液与硫酸铜溶液反应:
Ba2++SO42-====BaSO4↓
Ba2++2OH-+Cu2++SO42====BaSO4↓+Cu(OH)2↓
一、离子方程式正误判断
二、离子共存
1、定义:几种离子在某一溶液中能大量共存,即离子和离子之间
不能发生离子反应;如果离子之间可以发生离子反应,则不能大量共存
2、离子反应发生的条件:
①生成沉淀、气体和弱电解质
②水溶液中的置换反应
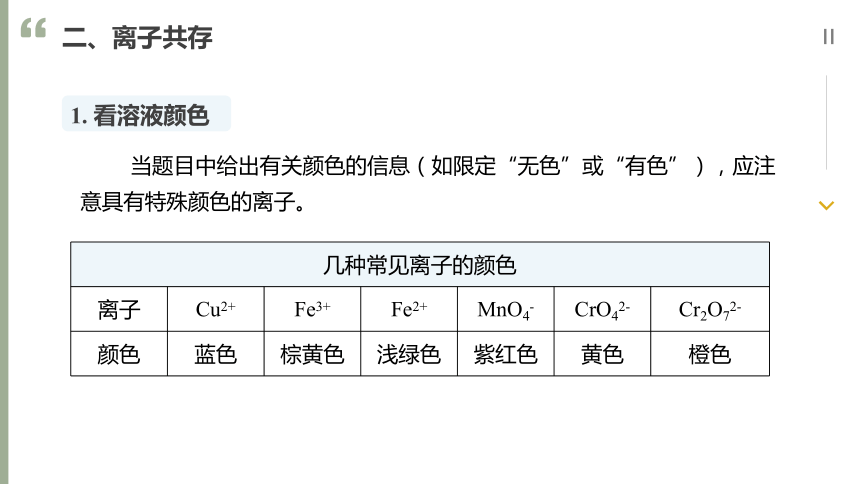
二、离子共存
当题目中给出有关颜色的信息(如限定“无色”或“有色”),应注意具有特殊颜色的离子。
1. 看溶液颜色
{76E7CF37-9C7E-40D2-887C-6D89348AA526}几种常见离子的颜色
离子
Cu2+
Fe3+
Fe2+
MnO4-
CrO42-
Cr2O72-
颜色
蓝色
棕黄色
浅绿色
紫红色
黄色
橙色
下列条件中例子可以大量共存的是( )
A. 无色透明溶液中:K+、SO42-、MnO4-、H+
B. 在酸性无色透明溶液中:K+、Cr2O72-、Na+、Cl-
C. 无色透明溶液中:Fe3+、SO42-、Na+、H+
D. 透明溶液中:Na+、Cu2+、SO42-、Cl-
总结:澄清透明可以有色,但无色必须无色
学以致用
强酸性溶液、pH<7(常温下)的溶液或使紫色石蕊溶液变红的溶液,都含有大量的H+,则能与H+反应的离子不能大量存在。
2. 看溶液的酸碱性
强碱性溶液、pH>7(常温下)的溶液或使紫色石蕊溶液变蓝的溶液或使酚酞溶液变红的溶液,都含有大量的OH-,则能与OH-反应的离子不能大量存在。
二、离子共存
(2)碱性溶液不能共存:
①H+
②除K+、Na+、Ca2+、Ba2+外,其他金属阳离子、NH4+
③弱酸酸式酸根:HCO3-、HSO3-等
(1)酸性溶液不能共存:
①OH-
②弱酸酸根:CO32-、SO32-、S2-、ClO-、CH3COO-
③弱酸酸式酸根:HCO3-、HSO3-
二、离子共存
2. 看溶液的酸碱性
有离子:①Cl- ②SO42- ③H+ ④OH- ⑤CO32- ⑥MnO4-
⑦HCO3- ⑧Cu2+ ⑨Ca2+ ⑩Ag+ ?Ba2+ ?K+
(1)在酸性条件下,不能大量共存的有___________________(填序号,下同)。
(2)在碱性条件下,不能大量共存的有___________________。
(3)在无色透明溶液中,不能共存的有___________________。
④⑤⑦
③⑦⑧⑨⑩
⑥⑧
提醒:透明不一定为无色
一看要求,二看条件,三看反应
学以致用
二、离子共存
3. 看能否发生复分解反应
OH-:Fe3+、Fe2+、Mg2+、Cu2+、Al3+等
Ag+:Cl-、Br-、I-、CO32-、S2-、SO42-等
生成难溶或微溶的物质
Ca2+:CO32-、SO42-等
Ba2+:CO32-、SO42-、SO32-等
H+:CO32-、HCO3-、SO32-、HSO3-、S2-、HS-等
生成气体
H+:OH-、CH3COO-等
生成水或其他难电离的物质
OH-:HCO3-、NH4+等
巩固练习
1、 下列各组中的离子,能形成无色透明的溶液且能大量共存的是( )
A.H+、CO32?、Na+、Cl- B.Cl-、NO3?、K+、Ag+
C.Cu2+、NO3?、Ca2+、Ba2+ D.NH4+、Mg2+、Na+、SO42?
?
D
2、在酸性条件下,CO32?、Na+、SO42?、Ba2+能够大量共存。 ( )
3、在K2CO3溶液中,Na+、Ca2+、Cl-、OH-可以大量共存。 ( )
4、在NaOH溶液中,Na+、K+、CO32?、SO42?可以大量共存。( )
?
×
×
√
5、下列各组物质电离产生的离子在溶液中能够大量共存的是 ( )
A.BaCl2 NaNO3 CuCl2 B.K2CO3 NaCl CaCl2
C.HNO3 NaOH KNO3 D.K2CO3 Ba(OH)2 KCl
A
6、 下列各组离子在给定条件下能大量共存的是 ( )
A.在某无色透明溶液中:K+、NH4+、Cl-、Cu2+
B.使酚酞变红的溶液中:Ag+、Mg2+、Cl-、NO3?
C.有大量H+存在的溶液中:K+、Cl-、Ba2+、CO32?
D.在强碱性溶液中:NO3?、K+、CO32?、Na+
?
D
巩固练习
三、离子推断
坚持“四原则”
(1)肯定性原则:
据现象推断存在或肯定不存在的离子。
(2)互斥性原则:
如溶液中含有Ba2+,则不存在大量的CO32-、SO42-。
(3)进出性原则:
要注意所加试剂引入什么离子,是否造成干扰。
(4)守恒原则(电中性原则) :
阳离子和阴离子同时存在于溶液中且正负电荷总量相等。
某溶液中含有CO32-、SO42-、SO32-、Cl-、Na+、Ag+中的若干种,为确定该溶液的离子组成,进行如下实验∶
①取少量该溶液,向其中滴加 BaCl2溶液,产生白色沉淀
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;白色沉淀部分溶解
③取②中上层清液继续滴加 BaCl2溶液至无沉淀时,再滴加 AgNO3溶液,产生白色沉淀根据上述实验,以下推测不正确的是( )
A.一定有CO32- B.一定有SO42-
C.不能确定Cl-是否存在 D.不能确定SO42-是否存在
D
学以致用
【思考与交流】粗盐提纯
对于粗盐水(NaCl)
要除去可溶杂质离子是:
Mg2+
选择要加入的除杂试剂:
Ca2+
Na2CO3
NaOH
SO42-
BaCl2
引入了新的离子:
CO32-
OH-
Ba2+
BaCO3↓
HCl
为了能完全除去杂质离子,加入的除杂试剂必须过量!
除杂原则:
*不增
*不减
*易分
*复原
NaCl
MgCl2
CaCl2
Na2SO4
过量BaCl2
过滤
BaSO4
NaCl
MgCl2
CaCl2
BaCl2
过量NaOH
过滤
Mg(OH)2
NaCl
CaCl2
BaCl2
NaOH
过量Na2CO3
过滤
CaCO3
BaCO3
NaCl
NaOH
Na2CO3
NaCl
溶液
适量盐酸
食盐水
蒸发结晶
纯净NaCl固体
BaCl2→NaOH →Na2CO3 →HCl
BaCl2→ Na2CO3 → NaOH →HCl
NaOH →BaCl2→ Na2CO3 →HCl
加入除杂试剂的顺序可以是:
1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸适量(或过量)
思考与讨论:除杂时加入的试剂可以交换顺序吗?
粗盐提纯过程中既要除SO42– ,又要除Mg2+ ,那加入Ba(OH)2是不是更好?
?
四、与“量”有关的离子方程式的书写
1.连续反应型:反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。
常见的是CO2、SO2通入碱液中
CO2+OH- =HCO3-
NaOH溶液中通入少量CO2
NaOH溶液中通入过量CO2
CO2+2OH-=CO32-+H2O
CO2+OH- =HCO3-
澄清石灰水Ca(OH)2中通入少量CO2
澄清石灰水Ca(OH)2中通入过量CO2
CO2+Ca2++2OH-=CaCO3↓+H2O
练习:向Na2CO3溶液中滴加HCl溶液至过量
开始滴加时:酸不足:
CO32- + H+ === HCO3-
酸过量时:
CO32- + 2H+ === H2O + CO2↑
四、与“量”有关的离子方程式的书写
2.量多量少型:谁“少”定谁为“1”
(1)少量Ca(HCO3)2和足量的NaOH反应
a.把“量少”的物质的化学计量数定为“1”;
b.依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。
Ca2+ + 2HCO3- + 2OH- === CaCO3↓ + CO32- + 2H2O
(2)少量NaOH和足量的Ca(HCO3)2反应
OH- + HCO3- + Ca2+ === CaCO3↓ + H2O
练习:(1)Ca(OH)2和NaHCO3(少量和过量)
(2)Ba(OH)2和NaHSO4(少量和过量)
四、与“量”有关的离子方程式的书写
3.离子配比型:谁“恰好”谁为主
(1)向NaHSO4溶液中滴加Ba(OH)2溶液至溶液恰好呈中性的离子方程式为:
(2)向NaHSO4溶液中滴加Ba(OH)2至Ba2+恰好沉淀时的离子方程式为:
Ba2+ + 2OH - + SO42- + 2H+ = BaSO4↓+ 2H2O
分析:OH -:H+ = 1 : 1
分析:Ba2+:SO42- = 1 : 1
Ba2+ + SO42- + OH- + H+ = BaSO4↓ + H2O
五、离子反应的应用
消除水中污染物
若一种污水中含有KCl,另一种污水中含有AgNO3,若将这两种污水按适当的比例混合,则发生离子反应:Ag++Cl-===AgCl↓。混合后的污水经过滤后再排放,不但消除了水污染,而且还能回收AgCl,再用这样的水灌溉农田又为植物提供了营养(K+和NO3?)。
?
离子反应在物质制备和分离、物质提纯和鉴定,以及消除水中污染物等方面都有广泛应用
自来水厂净水过程
小结
离子配比型
离子反应的应用
离子不能共存的条件
离子共存
如何判断是否共存---三看
检验离子的方法
离子检验
常见离子的检验
离子推断
坚持“四项基本原则”
物质提纯
不增不减、易分离、易复原
连续反应型
与“量”有关的离子方程式的书写
量多量少型
第一章 物质的分类及转化
学习目标
1. 掌握离子反应在物质制备、分离、提纯及鉴定中的原理和方法
2. 学会利用离子反应消除水中污染物的应用及原理
电解质在溶液中的反应实质上是离子之间的反应,这样的反应属于离子反应。
用实际参加反应的离子符号来表示反应的式子。?
Na2SO4 和BaCl2的反应的离子方程式:SO42-+ Ba2+=BaSO4↓
复习巩固
离子反应
离子方程式
一、离子方程式正误判断
1、看是否符合客观事实
2、看是否符合质量守恒
3、看是否符合电荷守恒
铁与稀盐酸反应:2Fe+6H+ ====2Fe3++3H2↑
铝与稀盐酸反应:Al+3H+ ==== Al3++H2↑
铜与稀盐酸反应:Cu + 2H+ = Cu2+ + H2↑
铜与氯化银反应:Cu + Ag+ = Cu2+ + Ag
金属钠和水反应:Na+2H2O=Na++2OH-+H2↑
4、看物质拆分是否正确
CO32-+2H+ ==== H2O+CO2↑
碳酸钡和稀硝酸反应:
氢氧化铁与盐酸反应:H++OH-=H2O
碳酸钠与醋酸反应: CO32-+2H+=CO2↑+H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
BaCO3+2H+ ==== Ba2++H2O+CO2↑
一、离子方程式正误判断
6、看反应物的配比是否正确
Ba2++OH-+H++SO42-====BaSO4↓+H2O
Ba2++2OH-+2H++SO42-====BaSO4↓+2H2O
5、看是否漏掉反应的离子
氢氧化钡和稀硫酸反应:
Ba2++SO42-====BaSO4↓
Ba(OH)2溶液与硫酸铜溶液反应:
Ba2++SO42-====BaSO4↓
Ba2++2OH-+Cu2++SO42====BaSO4↓+Cu(OH)2↓
一、离子方程式正误判断
二、离子共存
1、定义:几种离子在某一溶液中能大量共存,即离子和离子之间
不能发生离子反应;如果离子之间可以发生离子反应,则不能大量共存
2、离子反应发生的条件:
①生成沉淀、气体和弱电解质
②水溶液中的置换反应
二、离子共存
当题目中给出有关颜色的信息(如限定“无色”或“有色”),应注意具有特殊颜色的离子。
1. 看溶液颜色
{76E7CF37-9C7E-40D2-887C-6D89348AA526}几种常见离子的颜色
离子
Cu2+
Fe3+
Fe2+
MnO4-
CrO42-
Cr2O72-
颜色
蓝色
棕黄色
浅绿色
紫红色
黄色
橙色
下列条件中例子可以大量共存的是( )
A. 无色透明溶液中:K+、SO42-、MnO4-、H+
B. 在酸性无色透明溶液中:K+、Cr2O72-、Na+、Cl-
C. 无色透明溶液中:Fe3+、SO42-、Na+、H+
D. 透明溶液中:Na+、Cu2+、SO42-、Cl-
总结:澄清透明可以有色,但无色必须无色
学以致用
强酸性溶液、pH<7(常温下)的溶液或使紫色石蕊溶液变红的溶液,都含有大量的H+,则能与H+反应的离子不能大量存在。
2. 看溶液的酸碱性
强碱性溶液、pH>7(常温下)的溶液或使紫色石蕊溶液变蓝的溶液或使酚酞溶液变红的溶液,都含有大量的OH-,则能与OH-反应的离子不能大量存在。
二、离子共存
(2)碱性溶液不能共存:
①H+
②除K+、Na+、Ca2+、Ba2+外,其他金属阳离子、NH4+
③弱酸酸式酸根:HCO3-、HSO3-等
(1)酸性溶液不能共存:
①OH-
②弱酸酸根:CO32-、SO32-、S2-、ClO-、CH3COO-
③弱酸酸式酸根:HCO3-、HSO3-
二、离子共存
2. 看溶液的酸碱性
有离子:①Cl- ②SO42- ③H+ ④OH- ⑤CO32- ⑥MnO4-
⑦HCO3- ⑧Cu2+ ⑨Ca2+ ⑩Ag+ ?Ba2+ ?K+
(1)在酸性条件下,不能大量共存的有___________________(填序号,下同)。
(2)在碱性条件下,不能大量共存的有___________________。
(3)在无色透明溶液中,不能共存的有___________________。
④⑤⑦
③⑦⑧⑨⑩
⑥⑧
提醒:透明不一定为无色
一看要求,二看条件,三看反应
学以致用
二、离子共存
3. 看能否发生复分解反应
OH-:Fe3+、Fe2+、Mg2+、Cu2+、Al3+等
Ag+:Cl-、Br-、I-、CO32-、S2-、SO42-等
生成难溶或微溶的物质
Ca2+:CO32-、SO42-等
Ba2+:CO32-、SO42-、SO32-等
H+:CO32-、HCO3-、SO32-、HSO3-、S2-、HS-等
生成气体
H+:OH-、CH3COO-等
生成水或其他难电离的物质
OH-:HCO3-、NH4+等
巩固练习
1、 下列各组中的离子,能形成无色透明的溶液且能大量共存的是( )
A.H+、CO32?、Na+、Cl- B.Cl-、NO3?、K+、Ag+
C.Cu2+、NO3?、Ca2+、Ba2+ D.NH4+、Mg2+、Na+、SO42?
?
D
2、在酸性条件下,CO32?、Na+、SO42?、Ba2+能够大量共存。 ( )
3、在K2CO3溶液中,Na+、Ca2+、Cl-、OH-可以大量共存。 ( )
4、在NaOH溶液中,Na+、K+、CO32?、SO42?可以大量共存。( )
?
×
×
√
5、下列各组物质电离产生的离子在溶液中能够大量共存的是 ( )
A.BaCl2 NaNO3 CuCl2 B.K2CO3 NaCl CaCl2
C.HNO3 NaOH KNO3 D.K2CO3 Ba(OH)2 KCl
A
6、 下列各组离子在给定条件下能大量共存的是 ( )
A.在某无色透明溶液中:K+、NH4+、Cl-、Cu2+
B.使酚酞变红的溶液中:Ag+、Mg2+、Cl-、NO3?
C.有大量H+存在的溶液中:K+、Cl-、Ba2+、CO32?
D.在强碱性溶液中:NO3?、K+、CO32?、Na+
?
D
巩固练习
三、离子推断
坚持“四原则”
(1)肯定性原则:
据现象推断存在或肯定不存在的离子。
(2)互斥性原则:
如溶液中含有Ba2+,则不存在大量的CO32-、SO42-。
(3)进出性原则:
要注意所加试剂引入什么离子,是否造成干扰。
(4)守恒原则(电中性原则) :
阳离子和阴离子同时存在于溶液中且正负电荷总量相等。
某溶液中含有CO32-、SO42-、SO32-、Cl-、Na+、Ag+中的若干种,为确定该溶液的离子组成,进行如下实验∶
①取少量该溶液,向其中滴加 BaCl2溶液,产生白色沉淀
②然后继续加入稀盐酸至溶液呈酸性,产生无刺激性气味且能使澄清石灰水变浑浊的气体;白色沉淀部分溶解
③取②中上层清液继续滴加 BaCl2溶液至无沉淀时,再滴加 AgNO3溶液,产生白色沉淀根据上述实验,以下推测不正确的是( )
A.一定有CO32- B.一定有SO42-
C.不能确定Cl-是否存在 D.不能确定SO42-是否存在
D
学以致用
【思考与交流】粗盐提纯
对于粗盐水(NaCl)
要除去可溶杂质离子是:
Mg2+
选择要加入的除杂试剂:
Ca2+
Na2CO3
NaOH
SO42-
BaCl2
引入了新的离子:
CO32-
OH-
Ba2+
BaCO3↓
HCl
为了能完全除去杂质离子,加入的除杂试剂必须过量!
除杂原则:
*不增
*不减
*易分
*复原
NaCl
MgCl2
CaCl2
Na2SO4
过量BaCl2
过滤
BaSO4
NaCl
MgCl2
CaCl2
BaCl2
过量NaOH
过滤
Mg(OH)2
NaCl
CaCl2
BaCl2
NaOH
过量Na2CO3
过滤
CaCO3
BaCO3
NaCl
NaOH
Na2CO3
NaCl
溶液
适量盐酸
食盐水
蒸发结晶
纯净NaCl固体
BaCl2→NaOH →Na2CO3 →HCl
BaCl2→ Na2CO3 → NaOH →HCl
NaOH →BaCl2→ Na2CO3 →HCl
加入除杂试剂的顺序可以是:
1、只要Na2CO3加在BaCl2之后便合理
2、最后加入的盐酸适量(或过量)
思考与讨论:除杂时加入的试剂可以交换顺序吗?
粗盐提纯过程中既要除SO42– ,又要除Mg2+ ,那加入Ba(OH)2是不是更好?
?
四、与“量”有关的离子方程式的书写
1.连续反应型:反应生成的离子因又能跟剩余(过量)的反应物继续反应而跟用量有关。
常见的是CO2、SO2通入碱液中
CO2+OH- =HCO3-
NaOH溶液中通入少量CO2
NaOH溶液中通入过量CO2
CO2+2OH-=CO32-+H2O
CO2+OH- =HCO3-
澄清石灰水Ca(OH)2中通入少量CO2
澄清石灰水Ca(OH)2中通入过量CO2
CO2+Ca2++2OH-=CaCO3↓+H2O
练习:向Na2CO3溶液中滴加HCl溶液至过量
开始滴加时:酸不足:
CO32- + H+ === HCO3-
酸过量时:
CO32- + 2H+ === H2O + CO2↑
四、与“量”有关的离子方程式的书写
2.量多量少型:谁“少”定谁为“1”
(1)少量Ca(HCO3)2和足量的NaOH反应
a.把“量少”的物质的化学计量数定为“1”;
b.依据少量物质中离子的物质的量,确定过量物质中实际参加反应的离子的物质的量。
Ca2+ + 2HCO3- + 2OH- === CaCO3↓ + CO32- + 2H2O
(2)少量NaOH和足量的Ca(HCO3)2反应
OH- + HCO3- + Ca2+ === CaCO3↓ + H2O
练习:(1)Ca(OH)2和NaHCO3(少量和过量)
(2)Ba(OH)2和NaHSO4(少量和过量)
四、与“量”有关的离子方程式的书写
3.离子配比型:谁“恰好”谁为主
(1)向NaHSO4溶液中滴加Ba(OH)2溶液至溶液恰好呈中性的离子方程式为:
(2)向NaHSO4溶液中滴加Ba(OH)2至Ba2+恰好沉淀时的离子方程式为:
Ba2+ + 2OH - + SO42- + 2H+ = BaSO4↓+ 2H2O
分析:OH -:H+ = 1 : 1
分析:Ba2+:SO42- = 1 : 1
Ba2+ + SO42- + OH- + H+ = BaSO4↓ + H2O
五、离子反应的应用
消除水中污染物
若一种污水中含有KCl,另一种污水中含有AgNO3,若将这两种污水按适当的比例混合,则发生离子反应:Ag++Cl-===AgCl↓。混合后的污水经过滤后再排放,不但消除了水污染,而且还能回收AgCl,再用这样的水灌溉农田又为植物提供了营养(K+和NO3?)。
?
离子反应在物质制备和分离、物质提纯和鉴定,以及消除水中污染物等方面都有广泛应用
自来水厂净水过程
小结
离子配比型
离子反应的应用
离子不能共存的条件
离子共存
如何判断是否共存---三看
检验离子的方法
离子检验
常见离子的检验
离子推断
坚持“四项基本原则”
物质提纯
不增不减、易分离、易复原
连续反应型
与“量”有关的离子方程式的书写
量多量少型
