人教版(2019)高中化学必修一 2.1 化学反应速率 课件(共34张PPT)
文档属性
| 名称 | 人教版(2019)高中化学必修一 2.1 化学反应速率 课件(共34张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-26 11:45:37 | ||
图片预览








文档简介
第二章 第一节化学反应速率
任务一:化学反应速率的计算及表达
知识回顾:
1.化学反应速率的表达式及单位。
2.注意事项。
3.不同物质表达反应速率的大小关系。
教材课后题p30-31
第3题、第4题
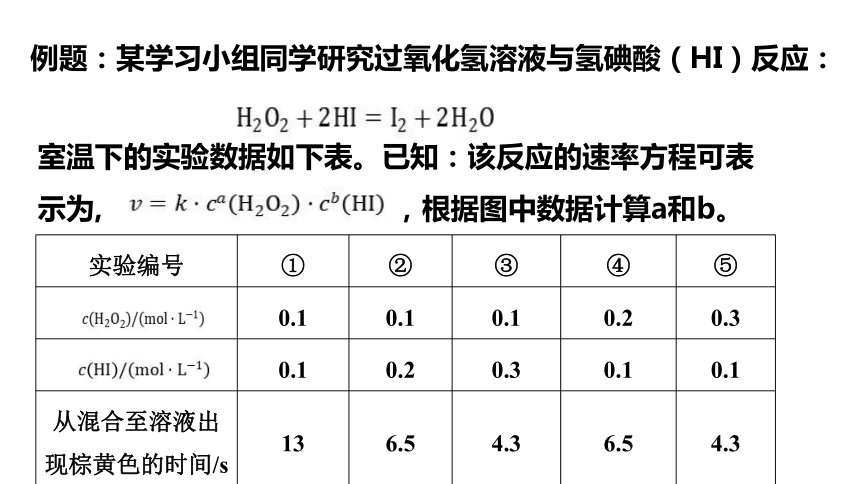
例题:某学习小组同学研究过氧化氢溶液与氢碘酸(HI)反应:
室温下的实验数据如下表。已知:该反应的速率方程可表示为, ,根据图中数据计算a和b。
实验编号
①
②
③
④
⑤
?
0.1
0.1
0.1
0.2
0.3
?
0.1
0.2
0.3
0.1
0.1
从混合至溶液出现棕黄色的时间/s
13
6.5
4.3
6.5
4.3
C
例题:在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) ? 2C(s)+xD(g) ΔH <0 ,5 s达到平衡。达平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是 ( )
A.x=1 B. B的转化率为20%
C.平衡时C的浓度为0.5mol·L-1
D.B的平均反应速率为0.2 mol·L-1·s-1
B
思考:哪些措施可以加快该反应的反应速率?
任务二:影响化学反应速率的因素分析
例题:在4 L绝热密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) ? 2C(s)+2D(g) ΔH<0 ,5 s达到平衡。达到平衡时, 生成了2 mol C, 经测定D的浓度为0.5 mol·L-1,判断下列说法是否正确
1.再充入1mol D,可加快反应速率
2.及时分离出C,可减慢反应速率
3.正速率变化可能先增大后减小
4.逆速率一直增大
5.再充入1molAr,可加快反应速率
6.随着反应的进行,体系的压强可能先减小后增大,有没有可能先增后减?
7.升高温度,可加快反应速率
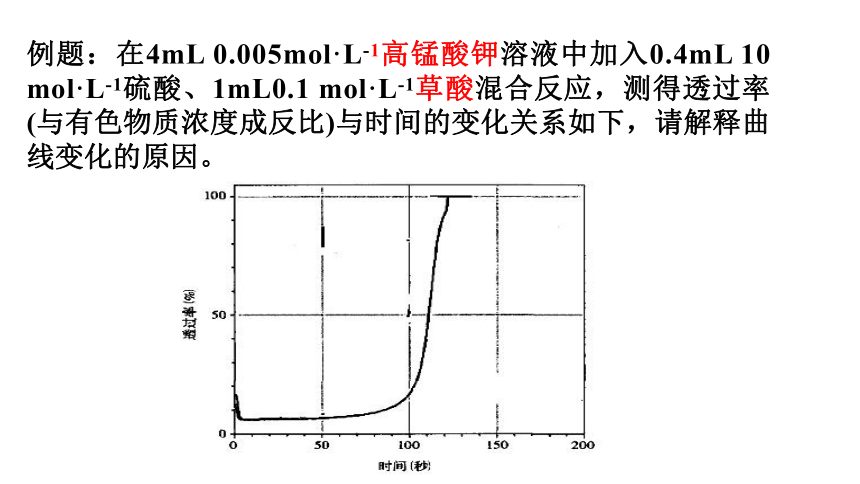
例题:在4mL 0.005mol·L-1高锰酸钾溶液中加入0.4mL 10 mol·L-1硫酸、1mL0.1 mol·L-1草酸混合反应,测得透过率(与有色物质浓度成反比)与时间的变化关系如下,请解释曲线变化的原因。
任务三:化学反应速率的测定
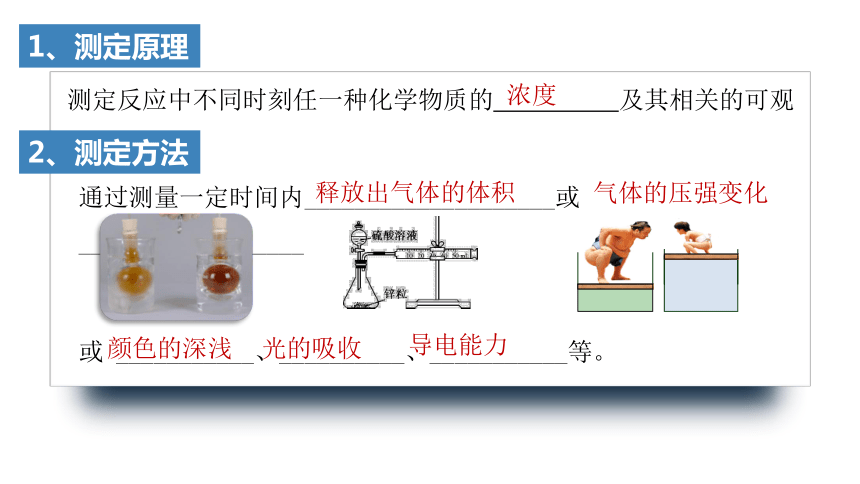
1、测定原理
测定反应中不同时刻任一种化学物质的 及其相关的可观测量。
浓度
2、测定方法
通过测量一定时间内____________________或 __________________
释放出气体的体积
气体的压强变化
或 ___________、__________、___________等。
颜色的深浅
光的吸收
导电能力
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验
编号
温度
(℃)
催化剂用量(g)
酸性KMnO4溶液
H2C2O4溶液
KMnO4
溶液褪色平均时间(min)
体积
(mL)
浓度
(mol·L-1)
体积
(mL)
浓度
(mol·L-1)
1
25
0.5
4
0.1
8
0.2
12.7
2
80
0.5
4
0.1
8
0.2
a
3
25
0.5
4
0.01
8
0.2
6.7
4
25
0
4
0.01
8
0.2
b
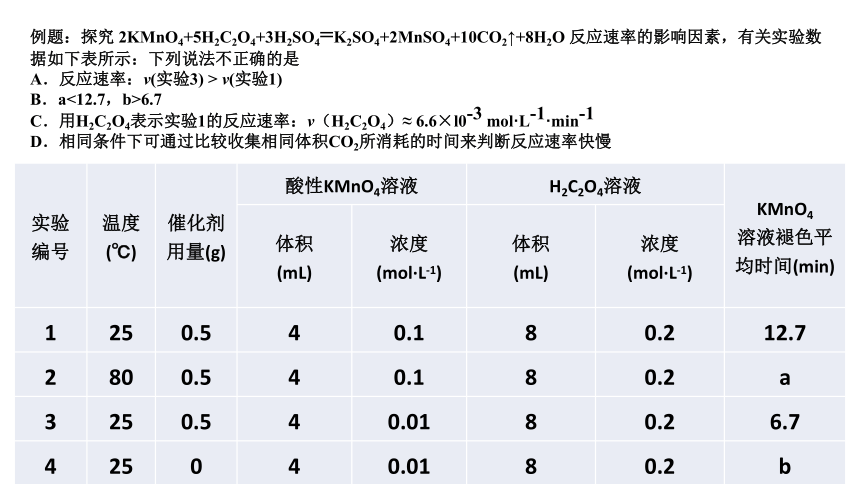
例题:探究 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O 反应速率的影响因素,有关实验数据如下表所示:下列说法不正确的是
A.反应速率:v(实验3) > v(实验1)
B.a<12.7,b>6.7
C.用H2C2O4表示实验1的反应速率:v(H2C2O4)≈ 6.6×l0-3 mol·L-1·min-1
D.相同条件下可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
例题 :硫代硫酸钠溶液与稀硫酸反应的化学方程式为
Na2S2O3+H2SO4 = Na2SO4+SO2↑+S↓+H2O
实验
反应温
度/℃
Na2S2O3溶液
稀硫酸
H2O
V/mL
V/mL
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
假设A组经过2分钟出现浑浊,请计算其反应速率。
例题:对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
水样\时间
0
5
10
15
20
25
Ⅰ(pH=2)
0.40
0.28
0.19
0.13
0.10
0.09
Ⅱ(pH=4)
0.40
0.31
0.24
0.20
0.18
0.16
Ⅲ(pH=4)
0.20
0.15
0.12
0.09
0.07
0.05
Ⅳ(pH=4,含Cu2+)
0.20
0.09
0.05
0.03
0.01
0
下列说法不正确的是
A.在0~20 min内,Ⅰ中M的分解速率为0.015 mol·Lˉ1·minˉ1
B.水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比Ⅱ大
D.由于Cu2+存在,Ⅳ中M的分解速率比Ⅰ快
D
例题:为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法错误的是
A.25℃时,在10~30min内,R的分解平均速率
为0.030 mol·L-1·min-1
B.对比30℃和10℃曲线,
在50min时,R的分解率相等
C.对比30℃和25℃曲线,
在0~50min内,能说明R的分
解平均速率随温度升高而增大
D.对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
D
任务四:影响化学反应速率的因素的微观解析
活化分子:在化学反应中,能量较高、有可能发生有效碰撞的分子。
活化分子百分数:
(活化分子数/反应物分子数)×100%
活化能:活化分子的平均能量与所有分子的平均能量之差。
有效碰撞:能够发生化学反应的碰撞。
重要概念
基元反应:反应物分子在碰撞中相互作用直接转化为生成物
问题:活化能与焓变有何关系?
反应物
生成物
能量
反应过程
Ea2
Ea1
逆反应活化能
正反应活化能
△H
活化分子:在化学反应中,能量较高、有可能发生有效碰撞的分子。
活化能:活化分子的平均能量与所有分子的平均能量之差。
有效碰撞:能够发生化学反应的碰撞。
重要概念
基元反应:反应物分子在碰撞中相互作用直接转化为生成物的反应
问题:能否用一段话描述基元反应、有效碰撞、活化分子、
活化能的关系?
一句话总结
一个反应要发生一般要经历哪些过程?
普通
分子
活化能
活化
分子
合理取向
的碰撞
有效
碰撞
新物质
能量
基元反应
浓度对反应速率的影响
外部
因素
活化
分子
百分数
单位体积中活化
分子数目
活化能
有效
碰撞
速率
浓度
增大
压强
增大
温度
升高
催化剂
压强对反应速率的影响
外部
因素
活化
分子
百分数
单位体积中活化
分子数目
活化能
有效
碰撞
速率
浓度
增大
压强
增大
温度
升高
催化剂
温度对反应速率的影响
外部
因素
活化
分子
百分数
单位体积中活化
分子数目
活化能
有效
碰撞
速率
浓度
增大
压强
增大
温度
升高
催化剂
反应物
生成物
能量
反应过程
无催化剂过渡态
Ea2
活化能
Ea1
有催化剂过渡态
Ea1
Ea2
﹤
外部
因素
活化
分子
百分数
单位体积中活化
分子数目
活化能
有效
碰撞
速率
浓度
增大
压强
增大
温度
升高
催化剂
反应物
生成物
能量
反应过程
无催化剂过渡态
Ea2
活化能
Ea1
有催化剂过渡态
Ea1
Ea2
﹤
5.多步基元反应,多个活化能,整个反应是由哪个或哪些活化能决定的呢?
2.两个基元反应的活化能大小如何?
3.能看出两个基元反应的热效应吗?
1.催化剂是如何作用,加快反应速率的?
4.使用催化剂是否影响整个反应的热效应?
有关催化剂的问题
6.p26的实验探究中,催化剂FeCl3溶液的浓度能否影响反应速率?固体催化剂呢?
A.在m催化剂作用下,该反应的活化能Ea=9.6×104J/mol
B.对该反应催化效能较高的催化剂是m
C.不改变其他条件,升高温度,会降低反应的活化能
D.可以根据该图像判断升高温度时平衡移动的方向
【例】已知阿仑尼乌斯公式是反应速率常数随温度变
化关系的经验公式,可写作 (????为反应速率常数,Ea为反应活化
能,R和C为大于0的常数),为探究????、????两种催化剂对某反应的催化效能,进
行了实验探究,依据实验数据获得曲线如图所示。下列说法正确的是 ( )
?
????. 对比图中直线m和n的斜率绝对值的大小可知,使用催化剂n时对应的????????较小,则对该反应催化效能较高的催化剂是n
?
????.图中????、????均为直线,斜率不发生变化,因此不改变其他条件,只升高温度,反应的活化能不变
?
????. 阿仑尼乌斯公式表示反应速率常数随温度的变化关系,无法根据该图像判断升高温度时平衡移动的方向
?
A、将坐标(7.2,56.2)和(7.5,27.4)代入经验公式中,得Ea=9.6×104J/mol
例题:已知分解1molH2O2放出热量98KJ.在含有少量I﹣的溶液中,H2O2分解机理为:
①H2O2+I﹣═H2O+IO﹣慢
②H2O2+IO﹣═H2O+O2+I﹣快
下列说法不正确的是( )
A.2H2O2═2H2O+O2的反应中,v(H2O2)=2v(O2)
B.反应速率与I﹣浓度有关
C.I﹣是该反应的催化剂
D.反应①活化能小于反应②的活化能
D
例题:已知反应2NO(g)+2H2(g)?N2(g)+2H2O(g)
△H=﹣752kJ?mol﹣1的反应机理如下:
①2NO(g)?N2O2(g) (快)
②N2O2(g)+H2(g)?N2O(g)+H2O(g) (慢)
③N2O(g)+H2(g)?N2(g)+H2O(g) (快)
下列有关说法错误的是( )
A.增大H2的浓度能增大单位体积内气体的活化分子数,有效碰撞次数增多,速率加快
B.该反应的速率主要取决于②的快慢
C.N2O2和N2O是该反应的催化剂
D.总反应中逆反应的活化能比正反应的活化能大
C
任务一:化学反应速率的计算及表达
知识回顾:
1.化学反应速率的表达式及单位。
2.注意事项。
3.不同物质表达反应速率的大小关系。
教材课后题p30-31
第3题、第4题
例题:某学习小组同学研究过氧化氢溶液与氢碘酸(HI)反应:
室温下的实验数据如下表。已知:该反应的速率方程可表示为, ,根据图中数据计算a和b。
实验编号
①
②
③
④
⑤
?
0.1
0.1
0.1
0.2
0.3
?
0.1
0.2
0.3
0.1
0.1
从混合至溶液出现棕黄色的时间/s
13
6.5
4.3
6.5
4.3
C
例题:在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) ? 2C(s)+xD(g) ΔH <0 ,5 s达到平衡。达平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是 ( )
A.x=1 B. B的转化率为20%
C.平衡时C的浓度为0.5mol·L-1
D.B的平均反应速率为0.2 mol·L-1·s-1
B
思考:哪些措施可以加快该反应的反应速率?
任务二:影响化学反应速率的因素分析
例题:在4 L绝热密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) ? 2C(s)+2D(g) ΔH<0 ,5 s达到平衡。达到平衡时, 生成了2 mol C, 经测定D的浓度为0.5 mol·L-1,判断下列说法是否正确
1.再充入1mol D,可加快反应速率
2.及时分离出C,可减慢反应速率
3.正速率变化可能先增大后减小
4.逆速率一直增大
5.再充入1molAr,可加快反应速率
6.随着反应的进行,体系的压强可能先减小后增大,有没有可能先增后减?
7.升高温度,可加快反应速率
例题:在4mL 0.005mol·L-1高锰酸钾溶液中加入0.4mL 10 mol·L-1硫酸、1mL0.1 mol·L-1草酸混合反应,测得透过率(与有色物质浓度成反比)与时间的变化关系如下,请解释曲线变化的原因。
任务三:化学反应速率的测定
1、测定原理
测定反应中不同时刻任一种化学物质的 及其相关的可观测量。
浓度
2、测定方法
通过测量一定时间内____________________或 __________________
释放出气体的体积
气体的压强变化
或 ___________、__________、___________等。
颜色的深浅
光的吸收
导电能力
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}实验
编号
温度
(℃)
催化剂用量(g)
酸性KMnO4溶液
H2C2O4溶液
KMnO4
溶液褪色平均时间(min)
体积
(mL)
浓度
(mol·L-1)
体积
(mL)
浓度
(mol·L-1)
1
25
0.5
4
0.1
8
0.2
12.7
2
80
0.5
4
0.1
8
0.2
a
3
25
0.5
4
0.01
8
0.2
6.7
4
25
0
4
0.01
8
0.2
b
例题:探究 2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O 反应速率的影响因素,有关实验数据如下表所示:下列说法不正确的是
A.反应速率:v(实验3) > v(实验1)
B.a<12.7,b>6.7
C.用H2C2O4表示实验1的反应速率:v(H2C2O4)≈ 6.6×l0-3 mol·L-1·min-1
D.相同条件下可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
例题 :硫代硫酸钠溶液与稀硫酸反应的化学方程式为
Na2S2O3+H2SO4 = Na2SO4+SO2↑+S↓+H2O
实验
反应温
度/℃
Na2S2O3溶液
稀硫酸
H2O
V/mL
V/mL
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
假设A组经过2分钟出现浑浊,请计算其反应速率。
例题:对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·Lˉ1)随时间(min)变化的有关实验数据见下表。
水样\时间
0
5
10
15
20
25
Ⅰ(pH=2)
0.40
0.28
0.19
0.13
0.10
0.09
Ⅱ(pH=4)
0.40
0.31
0.24
0.20
0.18
0.16
Ⅲ(pH=4)
0.20
0.15
0.12
0.09
0.07
0.05
Ⅳ(pH=4,含Cu2+)
0.20
0.09
0.05
0.03
0.01
0
下列说法不正确的是
A.在0~20 min内,Ⅰ中M的分解速率为0.015 mol·Lˉ1·minˉ1
B.水样酸性越强,M的分解速率越快
C.在0~25 min内,Ⅲ中M的分解百分率比Ⅱ大
D.由于Cu2+存在,Ⅳ中M的分解速率比Ⅰ快
D
例题:为研究某溶液中溶质R的分解速率的影响因素,分别用三份不同初始浓度的R溶液在不同温度下进行实验,c(R)随时间变化如图。下列说法错误的是
A.25℃时,在10~30min内,R的分解平均速率
为0.030 mol·L-1·min-1
B.对比30℃和10℃曲线,
在50min时,R的分解率相等
C.对比30℃和25℃曲线,
在0~50min内,能说明R的分
解平均速率随温度升高而增大
D.对比30℃和10℃曲线,在同一时刻,能说明R的分解速率随温度升高而增大
D
任务四:影响化学反应速率的因素的微观解析
活化分子:在化学反应中,能量较高、有可能发生有效碰撞的分子。
活化分子百分数:
(活化分子数/反应物分子数)×100%
活化能:活化分子的平均能量与所有分子的平均能量之差。
有效碰撞:能够发生化学反应的碰撞。
重要概念
基元反应:反应物分子在碰撞中相互作用直接转化为生成物
问题:活化能与焓变有何关系?
反应物
生成物
能量
反应过程
Ea2
Ea1
逆反应活化能
正反应活化能
△H
活化分子:在化学反应中,能量较高、有可能发生有效碰撞的分子。
活化能:活化分子的平均能量与所有分子的平均能量之差。
有效碰撞:能够发生化学反应的碰撞。
重要概念
基元反应:反应物分子在碰撞中相互作用直接转化为生成物的反应
问题:能否用一段话描述基元反应、有效碰撞、活化分子、
活化能的关系?
一句话总结
一个反应要发生一般要经历哪些过程?
普通
分子
活化能
活化
分子
合理取向
的碰撞
有效
碰撞
新物质
能量
基元反应
浓度对反应速率的影响
外部
因素
活化
分子
百分数
单位体积中活化
分子数目
活化能
有效
碰撞
速率
浓度
增大
压强
增大
温度
升高
催化剂
压强对反应速率的影响
外部
因素
活化
分子
百分数
单位体积中活化
分子数目
活化能
有效
碰撞
速率
浓度
增大
压强
增大
温度
升高
催化剂
温度对反应速率的影响
外部
因素
活化
分子
百分数
单位体积中活化
分子数目
活化能
有效
碰撞
速率
浓度
增大
压强
增大
温度
升高
催化剂
反应物
生成物
能量
反应过程
无催化剂过渡态
Ea2
活化能
Ea1
有催化剂过渡态
Ea1
Ea2
﹤
外部
因素
活化
分子
百分数
单位体积中活化
分子数目
活化能
有效
碰撞
速率
浓度
增大
压强
增大
温度
升高
催化剂
反应物
生成物
能量
反应过程
无催化剂过渡态
Ea2
活化能
Ea1
有催化剂过渡态
Ea1
Ea2
﹤
5.多步基元反应,多个活化能,整个反应是由哪个或哪些活化能决定的呢?
2.两个基元反应的活化能大小如何?
3.能看出两个基元反应的热效应吗?
1.催化剂是如何作用,加快反应速率的?
4.使用催化剂是否影响整个反应的热效应?
有关催化剂的问题
6.p26的实验探究中,催化剂FeCl3溶液的浓度能否影响反应速率?固体催化剂呢?
A.在m催化剂作用下,该反应的活化能Ea=9.6×104J/mol
B.对该反应催化效能较高的催化剂是m
C.不改变其他条件,升高温度,会降低反应的活化能
D.可以根据该图像判断升高温度时平衡移动的方向
【例】已知阿仑尼乌斯公式是反应速率常数随温度变
化关系的经验公式,可写作 (????为反应速率常数,Ea为反应活化
能,R和C为大于0的常数),为探究????、????两种催化剂对某反应的催化效能,进
行了实验探究,依据实验数据获得曲线如图所示。下列说法正确的是 ( )
?
????. 对比图中直线m和n的斜率绝对值的大小可知,使用催化剂n时对应的????????较小,则对该反应催化效能较高的催化剂是n
?
????.图中????、????均为直线,斜率不发生变化,因此不改变其他条件,只升高温度,反应的活化能不变
?
????. 阿仑尼乌斯公式表示反应速率常数随温度的变化关系,无法根据该图像判断升高温度时平衡移动的方向
?
A、将坐标(7.2,56.2)和(7.5,27.4)代入经验公式中,得Ea=9.6×104J/mol
例题:已知分解1molH2O2放出热量98KJ.在含有少量I﹣的溶液中,H2O2分解机理为:
①H2O2+I﹣═H2O+IO﹣慢
②H2O2+IO﹣═H2O+O2+I﹣快
下列说法不正确的是( )
A.2H2O2═2H2O+O2的反应中,v(H2O2)=2v(O2)
B.反应速率与I﹣浓度有关
C.I﹣是该反应的催化剂
D.反应①活化能小于反应②的活化能
D
例题:已知反应2NO(g)+2H2(g)?N2(g)+2H2O(g)
△H=﹣752kJ?mol﹣1的反应机理如下:
①2NO(g)?N2O2(g) (快)
②N2O2(g)+H2(g)?N2O(g)+H2O(g) (慢)
③N2O(g)+H2(g)?N2(g)+H2O(g) (快)
下列有关说法错误的是( )
A.增大H2的浓度能增大单位体积内气体的活化分子数,有效碰撞次数增多,速率加快
B.该反应的速率主要取决于②的快慢
C.N2O2和N2O是该反应的催化剂
D.总反应中逆反应的活化能比正反应的活化能大
C
