人教版(2019)高中化学选择性必修三 3.2.1 醇 课件(21张)
文档属性
| 名称 | 人教版(2019)高中化学选择性必修三 3.2.1 醇 课件(21张) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2025-08-27 00:00:00 | ||
图片预览





文档简介
(共21张PPT)
第三章 烃的衍生物
第二节 醇 酚
第一课时 醇
教学环节一:引入新课
你知道测酒仪的原理吗?
教学环节一:引入新课
学生活动1:【实验3-3】:如图3-10所示,在试管中加入酸性重铬酸钾溶液,然后滴加乙醇,充分振荡,观察实验现象”。
酸性重铬酸钾(K2Cr2O7)
(橙红色) (灰绿色)
教学环节一:引入新课
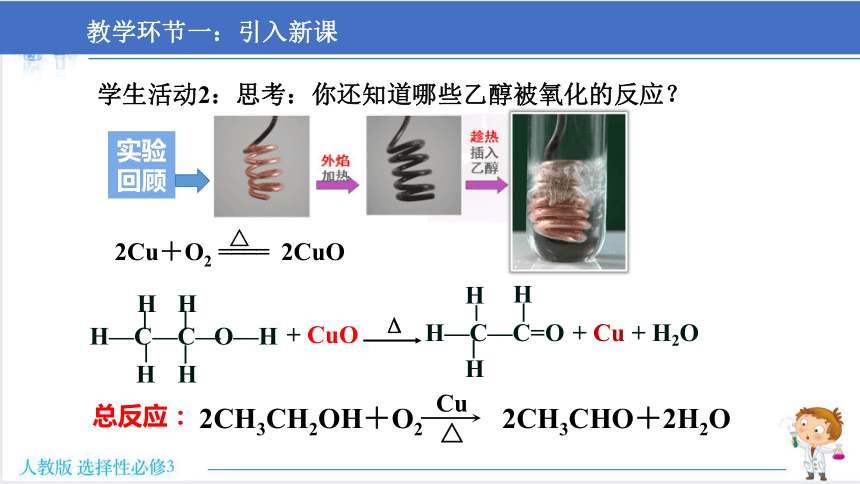
学生活动2:思考:你还知道哪些乙醇被氧化的反应?
实验实验
实验回顾
O—H
H
H—C—C—
H
H
H
+ CuO
H—C—C=O
H
H
H
+ Cu + H2O
Δ
总反应:
2Cu+O2 ==== 2CuO
△
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
△
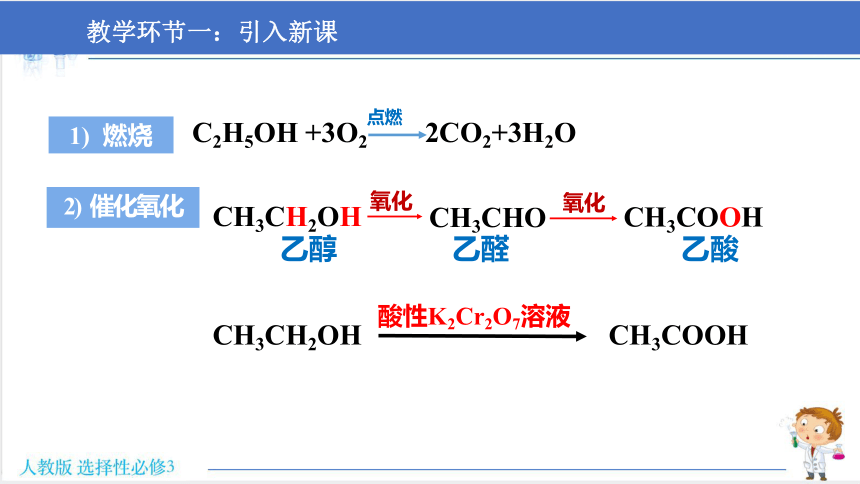
教学环节一:引入新课
C2H5OH +3O2 2CO2+3H2O
点燃
乙醇 乙醛 乙酸
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
CH3CH2OH
酸性K2Cr2O7溶液
CH3COOH
1) 燃烧
2) 催化氧化
教学环节二: 分析结构,预测性质
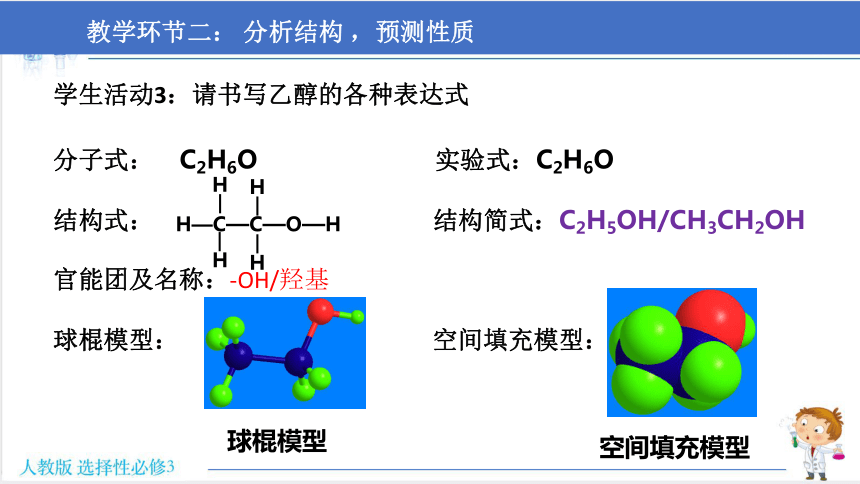
学生活动3:书写乙醇的各种表达式,搭建乙醇分子模型
分子式: 实验式:
结构式: 结构简式:
官能团及名称:
球棍模型: 空间填充模型:
教学环节二: 分析结构 ,预测性质
学生活动3:请书写乙醇的各种表达式
分子式: C2H6O 实验式:C2H6O
结构式: 结构简式:C2H5OH/CH3CH2OH
官能团及名称:-OH/羟基
球棍模型: 空间填充模型:
H—C—C—O—H
H
H
H
H
球棍模型
空间填充模型
教学环节二:分析结构 ,预测性质
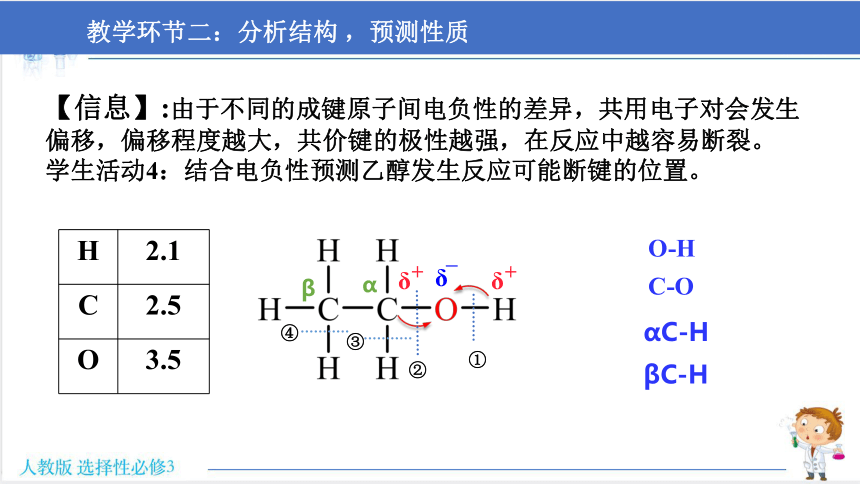
【信息】:由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移程度越大,共价键的极性越强,在反应中越容易断裂。
学生活动4:结合电负性预测乙醇发生反应可能断键的位置。
H 2.1
C 2.5
O 3.5
α
β
①
②
③
④
O-H
αC-H
βC-H
C-O
教学环节三:验证乙醇性质
学生活动5:回忆乙醇分别与钠和乙酸的反应,并解释断键的位置?
2CH3CH2 O H+2Na 2CH3CH2 ONa+H2
教学环节三: 验证乙醇性质
信息:乙醇与浓氢溴酸混合加热,产物的核磁共振氢谱和红外光谱如图,请根据分析书写方程式?
C-H
C-Br
学生活动6:CH3CH2OH+HBr
△
CH3CH2Br+H2O
教学环节三:验证乙醇性质
【实验3-2】:
在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL,放入几片碎瓷片,以避免混合液在受热时暴沸。加热混合液,使液体温度迅速升到170℃,将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
教学环节三: 验证乙醇性质
【思考1】:该实验中乙醇和浓硫酸会发生哪些反应?哪些物质能使酸性KMnO4溶液褪色?
【思考2】:为何使液体温度迅速升到170℃?
学生活动7:
教学环节三:验证乙醇性质
【思考2】:为何使液体温度迅速升到170℃?
因为140℃时乙醇发生分子间脱水,生成乙醚。
浓硫酸
140 ℃
CH3
CH2
OH
CH3
CH2
O H
H2O
CH3
CH2
CH3
CH2
O
乙醚
一种无色、易挥发的液体,沸点34.5 ℃,有特殊气味,具有麻醉作用。易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机化合物
教学环节三:验证乙醇性质
实验现象:
①产生气体:能使酸性KMnO4溶液、溴的CCl4溶液褪色
②烧瓶内液体颜色逐渐加深,最后变黑色
实验结论:
乙醇在浓硫酸作用下,加热到170 ℃,乙醇分子脱去一个水分子生成乙烯
学生活动8:书写反应方程式:
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
教学环节三:醇的概述
醇酚区别与联系:
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
CH3CHCH3
OH
OH
CH2OH
OH
CH3
1. 定义:
羟基与饱和碳原子相连的化合物称为醇
饱和一元醇通式:
CnH2n+1OH
教学环节四:醇类概述
2. 常见的醇
一元醇
CH3OH
甲醇
(木精、木醇)
剧毒
用于能源领域如汽车燃料
CH2CH2
OH OH
乙二醇
汽车用抗冻剂
二元醇
CH2CH CH2
OH OH OH
丙三醇(甘油)
吸湿性,护肤
三元醇
教学环节四:醇类概述
3.醇的物理性质
溶解性:乙醇与水任意比互溶,请解释原因?所有的醇都能与水任意比互溶吗?
随C数目增多,溶解性减小,羟基数目越多,溶解性越大;
教学环节四:醇类概述
相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。(醇分子间存在氢键的影响)
名称 结构简式 相对分子质量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
教学环节四:醇类概述
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
C数相同的醇:羟基越多,沸点越高!
教学环节四:醇类概述
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
饱和一元醇随C数增加,醇的沸点升高。
教学环节四:课堂评价
【思考1】:所有的醇都能发生催化氧化反应吗?产物都为醛吗?
学生活动9:
所有的醇都能发生消去反应吗?
【思考2】:
第三章 烃的衍生物
第二节 醇 酚
第一课时 醇
教学环节一:引入新课
你知道测酒仪的原理吗?
教学环节一:引入新课
学生活动1:【实验3-3】:如图3-10所示,在试管中加入酸性重铬酸钾溶液,然后滴加乙醇,充分振荡,观察实验现象”。
酸性重铬酸钾(K2Cr2O7)
(橙红色) (灰绿色)
教学环节一:引入新课
学生活动2:思考:你还知道哪些乙醇被氧化的反应?
实验实验
实验回顾
O—H
H
H—C—C—
H
H
H
+ CuO
H—C—C=O
H
H
H
+ Cu + H2O
Δ
总反应:
2Cu+O2 ==== 2CuO
△
2CH3CH2OH+O2 2CH3CHO+2H2O
Cu
△
教学环节一:引入新课
C2H5OH +3O2 2CO2+3H2O
点燃
乙醇 乙醛 乙酸
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
CH3CH2OH
酸性K2Cr2O7溶液
CH3COOH
1) 燃烧
2) 催化氧化
教学环节二: 分析结构,预测性质
学生活动3:书写乙醇的各种表达式,搭建乙醇分子模型
分子式: 实验式:
结构式: 结构简式:
官能团及名称:
球棍模型: 空间填充模型:
教学环节二: 分析结构 ,预测性质
学生活动3:请书写乙醇的各种表达式
分子式: C2H6O 实验式:C2H6O
结构式: 结构简式:C2H5OH/CH3CH2OH
官能团及名称:-OH/羟基
球棍模型: 空间填充模型:
H—C—C—O—H
H
H
H
H
球棍模型
空间填充模型
教学环节二:分析结构 ,预测性质
【信息】:由于不同的成键原子间电负性的差异,共用电子对会发生偏移,偏移程度越大,共价键的极性越强,在反应中越容易断裂。
学生活动4:结合电负性预测乙醇发生反应可能断键的位置。
H 2.1
C 2.5
O 3.5
α
β
①
②
③
④
O-H
αC-H
βC-H
C-O
教学环节三:验证乙醇性质
学生活动5:回忆乙醇分别与钠和乙酸的反应,并解释断键的位置?
2CH3CH2 O H+2Na 2CH3CH2 ONa+H2
教学环节三: 验证乙醇性质
信息:乙醇与浓氢溴酸混合加热,产物的核磁共振氢谱和红外光谱如图,请根据分析书写方程式?
C-H
C-Br
学生活动6:CH3CH2OH+HBr
△
CH3CH2Br+H2O
教学环节三:验证乙醇性质
【实验3-2】:
在圆底烧瓶中加入乙醇和浓硫酸(体积比约为1:3)的混合液20 mL,放入几片碎瓷片,以避免混合液在受热时暴沸。加热混合液,使液体温度迅速升到170℃,将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
教学环节三: 验证乙醇性质
【思考1】:该实验中乙醇和浓硫酸会发生哪些反应?哪些物质能使酸性KMnO4溶液褪色?
【思考2】:为何使液体温度迅速升到170℃?
学生活动7:
教学环节三:验证乙醇性质
【思考2】:为何使液体温度迅速升到170℃?
因为140℃时乙醇发生分子间脱水,生成乙醚。
浓硫酸
140 ℃
CH3
CH2
OH
CH3
CH2
O H
H2O
CH3
CH2
CH3
CH2
O
乙醚
一种无色、易挥发的液体,沸点34.5 ℃,有特殊气味,具有麻醉作用。易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机化合物
教学环节三:验证乙醇性质
实验现象:
①产生气体:能使酸性KMnO4溶液、溴的CCl4溶液褪色
②烧瓶内液体颜色逐渐加深,最后变黑色
实验结论:
乙醇在浓硫酸作用下,加热到170 ℃,乙醇分子脱去一个水分子生成乙烯
学生活动8:书写反应方程式:
浓H2SO4
170 ℃
CH2-CH2
H
OH
CH2=CH2↑ + H2O
教学环节三:醇的概述
醇酚区别与联系:
羟基(—OH)与烃基或苯环侧链上的碳原子相连的化合物称为醇。
羟基(—OH)与苯环直接相连的化合物称为酚。
CH3CHCH3
OH
OH
CH2OH
OH
CH3
1. 定义:
羟基与饱和碳原子相连的化合物称为醇
饱和一元醇通式:
CnH2n+1OH
教学环节四:醇类概述
2. 常见的醇
一元醇
CH3OH
甲醇
(木精、木醇)
剧毒
用于能源领域如汽车燃料
CH2CH2
OH OH
乙二醇
汽车用抗冻剂
二元醇
CH2CH CH2
OH OH OH
丙三醇(甘油)
吸湿性,护肤
三元醇
教学环节四:醇类概述
3.醇的物理性质
溶解性:乙醇与水任意比互溶,请解释原因?所有的醇都能与水任意比互溶吗?
随C数目增多,溶解性减小,羟基数目越多,溶解性越大;
教学环节四:醇类概述
相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。(醇分子间存在氢键的影响)
名称 结构简式 相对分子质量 沸点/℃
甲醇 CH3OH 32 65
乙烷 CH3CH3 30 -89
乙醇 CH3CH2OH 46 79
丙烷 CH3CH2CH3 44 -42
正丙醇 CH3CH2CH2OH 60 97
正丁烷 CH3CH2CH2CH3 58 -0.5
教学环节四:醇类概述
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
C数相同的醇:羟基越多,沸点越高!
教学环节四:醇类概述
名称 结构简式 熔点/℃ 沸点/℃
甲醇 CH3OH -97 65
乙醇 CH3CH2OH -117 79
正丙醇 CH3CH2CH2OH -126 97
正丁醇 CH3CH2CH2CH2OH -90 118
正戊醇 CH3CH2CH2CH2CH2OH -79 138
十八醇(硬脂醇) CH3(CH2)17OH 59 211
饱和一元醇随C数增加,醇的沸点升高。
教学环节四:课堂评价
【思考1】:所有的醇都能发生催化氧化反应吗?产物都为醛吗?
学生活动9:
所有的醇都能发生消去反应吗?
【思考2】:
