山东省德州市跃华学校2015-2016学年下学期高一(下)月考化学试卷(理科)(6月份)(解析版)
文档属性
| 名称 | 山东省德州市跃华学校2015-2016学年下学期高一(下)月考化学试卷(理科)(6月份)(解析版) |  | |
| 格式 | zip | ||
| 文件大小 | 167.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-05 22:33:52 | ||
图片预览


文档简介
2015-2016学年山东省德州市跃华学校高一(下)月考化学试卷(理科)(6月份)
一、选择题(每小题只有一个答案.共16题,每题3分,共48分)
1.下列说法中正确的是( )
A.石油的分馏和煤的干馏都是物理变化
B.油脂、淀粉、纤维素都是高分子化合物
C.酯类物质是形成水果香味的主要成分
D.纤维素和淀粉互为同分异构体
2.下列化学用语书写正确的是( )
A.丙酸的结构简式:CH3CH2COOH
B.甲烷的结构式:CH4
C.乙烯的结构简式:CH2CH2
D.乙醇的结构式:
3.下列与有机化合物结构、性质有关的叙述正确的是( )
A.苯与溴水在铁做催化剂的作用下可以发生取代反应
B.甲烷和苯都既能发生取代反应,又能使酸性KMnO4溶液退色
C.乙醇和乙酸分子中都含羟基,都既能与Na反应,又能与NaOH溶液反应
D.甲苯可与浓硝酸在一定条件下发生取代反应
4.常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A.C2H5OH
B.CH4
C.C2H4O
D.C3H8O2
5.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A.①③②④
B.①③④②
C.③④②①
D.③①②④
6.如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
选
项
M
N
P
A
锌
铜
稀硫酸
B
铜
铁
稀盐酸
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
A.A
B.B
C.C
D.D
7.下列反应中,属于加成反应的是( )
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.乙烯使溴水褪色
C.将苯滴入少量到溴水中,振荡后水层接近无色
D.乙烯使酸性高锰酸钾溶液褪色
8.现有三组溶液:①汽油和氯化钠溶液
②39%的乙醇溶液
⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
9.某有机物的结构简式如图,下列说法正确的是( )
A.该有机物的分子式为C11H15O3
B.该有机物不能发生取代反应
C.1
mol该物质与足量的钠反应可以生成1
mol氢气
D.1
mol该有机物可以与1
mol碳酸钠发生反应
10.巴豆酸的结构简式为CH3﹣CH═CH﹣COOH.现有①氯化氢、②溴水、③纯碱溶液、④丁醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )
A.只有②④⑤
B.只有①③④
C.只有①②③④
D.全部
11.进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
A.(CH3)2CHCH2CH2CH3
B.(CH3)2CHCH3
C.(CH3)2CH﹣CH(CH3)2
D.(CH3)3CCH2CH3
12.某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )
A.
甲装置:可用来证明碳的非金属性比硅强
B.
乙装置:橡皮管的作用是能使水顺利流下
C.
丙装置:用图示的方法不能检查此装置的气密性
D.
丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集NO
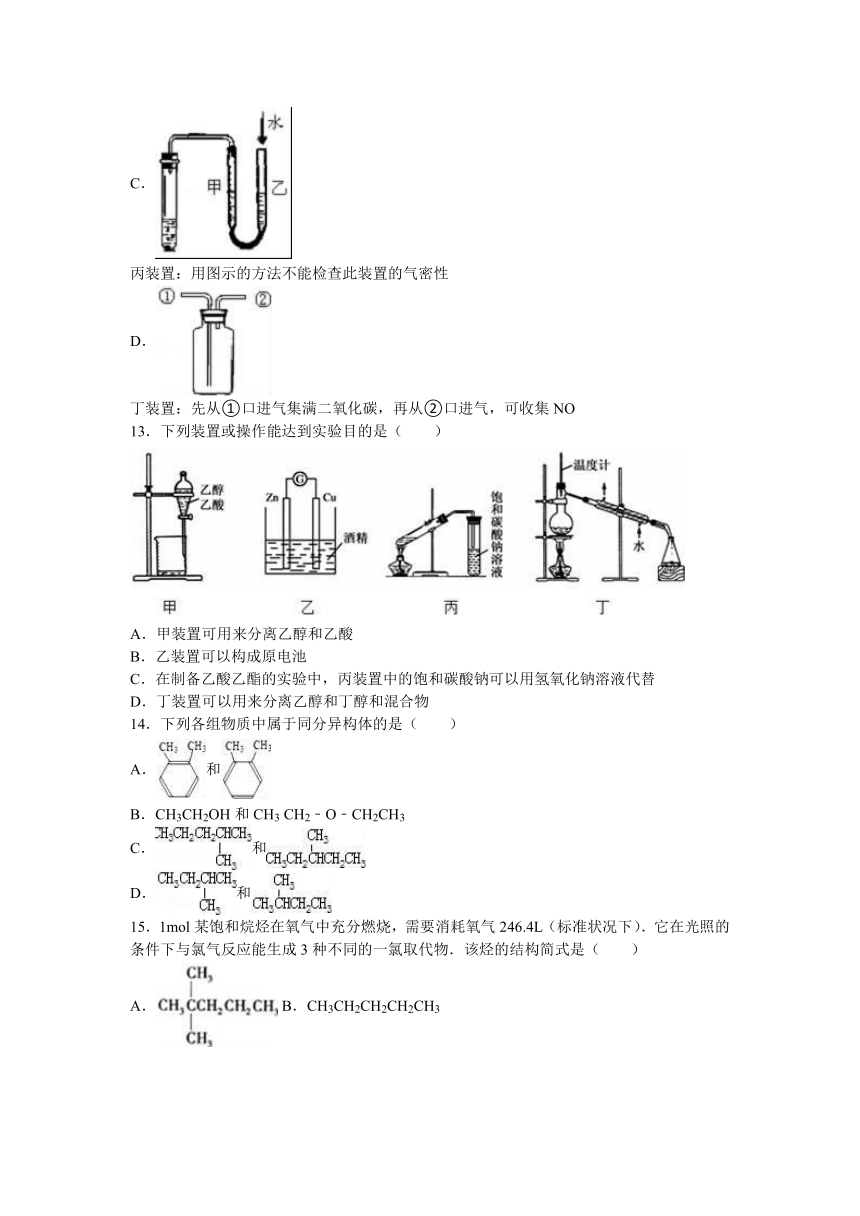
13.下列装置或操作能达到实验目的是( )
A.甲装置可用来分离乙醇和乙酸
B.乙装置可以构成原电池
C.在制备乙酸乙酯的实验中,丙装置中的饱和碳酸钠可以用氢氧化钠溶液代替
D.丁装置可以用来分离乙醇和丁醇和混合物
14.下列各组物质中属于同分异构体的是( )
A.和
B.CH3CH2OH和CH3
CH2﹣O﹣CH2CH3
C.和
D.和
15.1mol某饱和烷烃在氧气中充分燃烧,需要消耗氧气246.4L(标准状况下).它在光照的条件下与氯气反应能生成3种不同的一氯取代物.该烃的结构简式是( )
A.
B.CH3CH2CH2CH2CH3
C.
D.
16.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
A.电池工作时,锌失去电子,锌是负极
B.电池工作时,溶液中OH﹣向正极移动,K+、H+向负极移动
C.电池负极的电极反应式为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
二、解答题(共4小题,满分52分)
17.下面列出了几组物质,请将物质的合适组号填写在空格上.
①金刚石与C60;②O2与O3;③16O、17O和18O;
④CH4和CH3CH2CH3;⑤乙烯和乙烷;⑥葡糖糖和果糖
⑦和;⑧和;
(1)互为同位素的是 ;
(2)互为同素异形体的是 ;
(3)互为同系物的是 ;
(4)互为同分异构体的是 .
18.原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
(1)a和b不连接时,烧杯中发生反应的离子方程式是
(2)a和b用导线连接,Cu极为原电池 极(填“正”或“负”),电极反应式是;Zn极发生 (填“氧化”或“还原”)反应,溶液中H+移向 (填“Cu”或“Zn”)极.
(3)a和b用导线连接,若Zn片质量减轻了6.5g,则另一极上理论上产生气体 L(标况下).
(4)有同学向把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 .
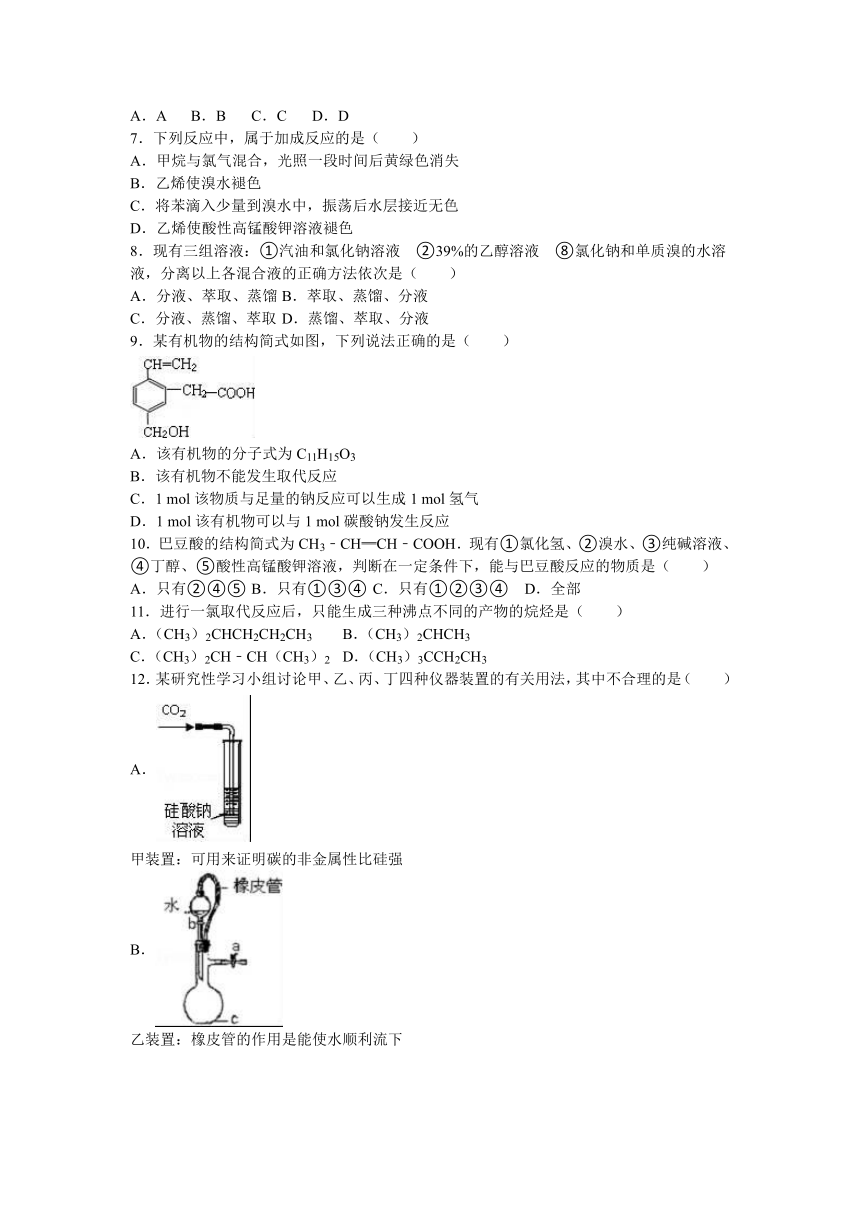
19.实验室中用二氧化锰和浓盐酸反应制备氯气.进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母):接 ;接 ;接 ;接 .
(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有 .
(3)写出用如图装置制备氯气的离子方程式 :
(4)A、B两组同学分别用两种方法制取氯气:A组用含146g
HCl的浓盐酸与足量的二氧化锰反应;B组用87g二氧化锰与足量的浓盐酸反应,则所得氯气的物质的量的关系为A B(填“>”、“<”或“=”)
(5)实验中饱和食盐水的作用是 :
(6)写出氯气尾气吸收的化学方程式: .
(7)如何验证氯气已经收集满?
20.A、B、C、D、E在一定条件下存在如下转化关系.其中A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平.E具有水果香味.(部分反应条件、产物被省略).
已知:2CH3CHO+O2→2CH3COOH.
(1)工业上,由石油获得石蜡油的方法是 ;由石蜡油获得A是 变化.(填“物理”或“化学”)
(2)B、D中所含官能团的名称为 、 .
(3)写出下列反应方程式,并表明反应类型
A→B: ;反应类型:
B→C: ;反应类型:
B+D→E: ;反应类型:
(4)在实验室制备E物质的过程中,饱和碳酸钠溶液的作用有: .
(5)在乙酸乙酯、乙醇、乙酸溶液共存的化学平衡体系中加入重水(D2O),经过足够长的时间后,可以发现除水外,体系中含有重氢的化合物是 .
A.乙酸
B.乙醇
C.乙酸、乙醇
D.乙酸乙酯.
2015-2016学年山东省德州市跃华学校高一(下)月考化学试卷(理科)(6月份)
参考答案与试题解析
一、选择题(每小题只有一个答案.共16题,每题3分,共48分)
1.下列说法中正确的是( )
A.石油的分馏和煤的干馏都是物理变化
B.油脂、淀粉、纤维素都是高分子化合物
C.酯类物质是形成水果香味的主要成分
D.纤维素和淀粉互为同分异构体
【考点】物理变化与化学变化的区别与联系;同分异构现象和同分异构体;有机高分子化合物的结构和性质.
【分析】A.煤的干馏是煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程;
B.油脂不是高分子化合物;
C.一些酯类物质具有水果香味;
D.纤维素和淀粉的聚合度不同.
【解答】解:A.石油分馏是分离几种不同沸点的混合物的一种方法,属于物理变化,煤的干馏是化学变化,煤的干馏是煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程,属于化学变化,故A错误;
B.油脂不是高分子化合物,淀粉、纤维素都是高分子化合物,故B错误;
C.一些酯类物质具有水果香味,形成水果香味的主要成分是酯类,故C正确;
D.纤维素和淀粉的聚合度不同,分子式不同,因此不是同分异构体,故D错误;
故选C.
【点评】本题考查化石能源的开发利用、常见有机物的结构和性质,题目难度不大,注意纤维素和淀粉的分子式虽然写法相同,但聚合物不同.
2.下列化学用语书写正确的是( )
A.丙酸的结构简式:CH3CH2COOH
B.甲烷的结构式:CH4
C.乙烯的结构简式:CH2CH2
D.乙醇的结构式:
【考点】电子式、化学式或化学符号及名称的综合;结构式;结构简式.
【分析】A.丙酸含﹣COOH,共3个C;
B.甲烷的分子式为CH4,为正四面体结构;
C.乙烯中含碳碳双键;
D.乙醇中含﹣OH.
【解答】解:A.丙酸含﹣COOH,共3个C,结构简式为CH3CH2COOH,故A正确;
B.甲烷的分子式为CH4,为正四面体结构,结构式为,故B错误;
C.乙烯中含碳碳双键,结构简式为CH2=CH2,故C错误;
D.乙醇中含﹣OH,结构式为,而为甲醚,故D错误;
故选A.
【点评】本题考查化学用语的综合应用,为高频考点,涉及结构式、结构简式等,把握有机物的结构、官能团为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.
3.下列与有机化合物结构、性质有关的叙述正确的是( )
A.苯与溴水在铁做催化剂的作用下可以发生取代反应
B.甲烷和苯都既能发生取代反应,又能使酸性KMnO4溶液退色
C.乙醇和乙酸分子中都含羟基,都既能与Na反应,又能与NaOH溶液反应
D.甲苯可与浓硝酸在一定条件下发生取代反应
【考点】有机物的结构和性质;有机化学反应的综合应用.
【分析】A.苯与溴水不反应;
B.甲烷和苯均与高锰酸钾不反应;
C.乙醇与NaOH不反应;
D.甲苯可与浓硝酸发生取代反应生成硝基甲苯.
【解答】解:A.苯与溴水不反应,苯与液溴在铁做催化剂的作用下可以发生取代反应,故A错误;
B.甲烷和苯均与高锰酸钾不反应,但均可发生取代反应,故B错误;
C.乙醇与NaOH不反应,乙酸与NaOH反应,但均与Na反应生成氢气,故C错误;
D.甲苯可与浓硝酸在浓硫酸作催化剂条件下发生取代反应生成硝基甲苯,苯环上H被取代,故D正确;
故选D.
【点评】本题考查有机物的结构与性质,侧重于学生的分析能力的考查,把握官能团与性质的关系、有机反应等为解答的关键,题目难度不大.
4.常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A.C2H5OH
B.CH4
C.C2H4O
D.C3H8O2
【考点】化学方程式的有关计算.
【分析】有机物燃烧的通式为CxHyOz+(x+﹣)O2→xCO2+H2O,以此计算.
【解答】解:有机物燃烧的通式为CxHyOz+(x+﹣)O2→xCO2+H2O,有机物均为1mol,则
A.消耗氧气为1mol×(2++)=3mol;
B.消耗氧气1mol×(1+)=2mol;
C.消耗氧气1mol×(2+﹣)=2.5mol;
D.消耗氧气1mol×(3+﹣)=4mol,
消耗氧气最多的是C3H8O2,
故选D.
【点评】本题考查化学反应的计算,为高频考点,把握有机物燃烧规律为解答的关键,侧重分析与计算能力的考查,注意通式法应用,题目难度不大.
5.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A.①③②④
B.①③④②
C.③④②①
D.③①②④
【考点】常见金属的活动性顺序及其应用.
【分析】组成原电池时,负极金属较为活泼,可根据电子、电流的流向以及反应时正负极的变化判断原电池的正负极,则可判断金属的活泼性强弱.
【解答】解:组成原电池时,负极金属较为活泼,
①②相连时,外电路电流从②流向①,说明①为负极,活泼性①>②;
①③相连时,③为正极,活泼性①>③;
②④相连时,②上有气泡逸出,应为原电池的正极,活泼性④>②;
③④相连时,③的质量减少,③为负极,活泼性③>④,
综上分析可知活泼性:①>③>④>②.
故选B.
【点评】本题考查金属活泼性的判断,侧重于原电池的考查,注意原电池的组成特点以及工作原理,题目难度不大.
6.如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
选
项
M
N
P
A
锌
铜
稀硫酸
B
铜
铁
稀盐酸
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
A.A
B.B
C.C
D.D
【考点】原电池和电解池的工作原理.
【分析】先判断该装置属于什么装置,再根据原电池中正负极反应的现象判断N电极,从而判断选项.
【解答】解:该装置没有外接电源,所以是原电池.原电池中,负极材料比正极材料活泼,且负极材料是随着反应的进行质量减少,正极质量增加或放出气泡.根据题意知,N极是负极,M是正极,且N极材料比M极活泼.
A、M极材料比N极活泼,故A错误.
B、M极上质量不增加,故B错误.
C、N极材料比M极活泼,且M极上有银析出,所以质量增加,符合题意,故C正确.
D、M极材料比N极活泼,故D错误.
故选C.
【点评】原电池正负极的判断方法:
1、根据电极材料的活泼性判断
负极:活泼性相对强的一极
正极:活泼性相对弱的一极
2、根据电子流向或电流的流向判断
负极:电子流出或电流流入的一极
正极:电子流入或电流流出的一极
3、根据溶液中离子移动的方向判断
负极:阴离子移向的一极
正极:阳离子移向的一极
4、根据两极的反应类型判断
负极:发生氧化反应的一极
正极:发生还原反应的一极
5、根据电极反应的现象判断
负极:溶解或减轻的一极
正极:增重或放出气泡的一极
7.下列反应中,属于加成反应的是( )
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.乙烯使溴水褪色
C.将苯滴入少量到溴水中,振荡后水层接近无色
D.乙烯使酸性高锰酸钾溶液褪色
【考点】有机物的结构和性质.
【分析】有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
常见能发生加成反应的物质往往含有C=C、C≡C、C=O等官能团,以此解答该题.
【解答】解:A.甲烷在光照条件下与氯气发生取代反应,故A错误;
B.乙烯含有碳碳双键,可与溴水发生加成反应1,2﹣二溴乙烷,故B正确;
C.溴水与苯不反应,为萃取现象,故C错误;
D.乙烯中含有碳碳双键,能够被酸性高锰酸钾溶液氧化,从而酸性高锰酸钾溶液褪色,该反应为氧化反应,故D错误.
故选B.
【点评】本题考查有机物的结构和性质,为高频考点,题目难度不大,侧重于有机物反应类型的判断,注意把握有机物的官能团的性质以及转化,注意相关基础知识的积累.
8.现有三组溶液:①汽油和氯化钠溶液
②39%的乙醇溶液
⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
【考点】物质的分离、提纯的基本方法选择与应用.
【分析】①汽油和氯化钠溶液,混合分层;②39%的乙醇溶液中乙醇与水的沸点不同;③单质溴不易溶于水,易溶于有机溶剂,以此来解答.
【解答】解:①汽油和氯化钠溶液,混合分层,则利用分液分离;
②39%的乙醇溶液中乙醇与水的沸点不同,则利用蒸馏分离;
③单质溴不易溶于水,易溶于有机溶剂,则分离氯化钠和单质溴的水溶液,选择有机溶剂萃取;
故选C.
【点评】本题考查混合物分离、提纯的方法及选择,为高频考点,把握物质的性质及性质差异、混合物分离方法为解答的关键,注重实验基础知识和基本技能的考查,注意有机物性质,题目难度不大.
9.某有机物的结构简式如图,下列说法正确的是( )
A.该有机物的分子式为C11H15O3
B.该有机物不能发生取代反应
C.1
mol该物质与足量的钠反应可以生成1
mol氢气
D.1
mol该有机物可以与1
mol碳酸钠发生反应
【考点】有机物的结构和性质.
【分析】由结构可知,分子中含碳碳双键、﹣COOH、﹣OH,结合烯烃、羧酸、醇的性质来解答.
【解答】解:A.由结构可知分子式为C11H12O3,故A错误;
B.含有羧基、羟基,可发生取代反应,故B错误;
C.含有羧基、羟基,都可与钠反应生成氢气,则1
mol该物质与足量的钠反应可以生成1
mol氢气,故C正确;
D.只有羧基与碳酸钠反应,如生成碳酸氢钠,则1
mol该有机物可以与1
mol碳酸钠发生反应,故D正确.
故选CD.
【点评】本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、羧酸、醇性质的考查,题目难度不大.
10.巴豆酸的结构简式为CH3﹣CH═CH﹣COOH.现有①氯化氢、②溴水、③纯碱溶液、④丁醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )
A.只有②④⑤
B.只有①③④
C.只有①②③④
D.全部
【考点】有机物的结构和性质.
【分析】CH3CH=CHCOOH中含碳碳双键、﹣COOH,结合烯烃、羧酸的性质来解答.
【解答】解:巴豆酸分子中含有碳碳双键和羧基,所以巴豆酸具有烯烃和羧酸的性质,与①氯化氢、②溴水发生加成反应,与⑤酸化的高锰酸钾溶液发生氧化反应,表现碳碳双键的性质;与③纯碱溶液发生复分解反应,与④丁醇发生酯化反应,
故选D.
【点评】本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意分析有机物中官能团的种类和性质是解题的关键所在.
11.进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
A.(CH3)2CHCH2CH2CH3
B.(CH3)2CHCH3
C.(CH3)2CH﹣CH(CH3)2
D.(CH3)3CCH2CH3
【考点】常见有机化合物的结构.
【分析】某烷烃发生氯代反应后,只能生成三种沸点不同的一氯代产物,则说明该有机物的一氯代物有3种;根据等效氢原子来判断各烷烃中氢原子的种类,有几种类型的氢原子就有几种一氯代物,据此进行解答.
【解答】解:A.(CH3)2CHCH2CH2CH3中有5种位置不同的氢,所以其一氯代物有5种,能生成5种沸点不同的产物,故A错误;
B.(CH3)2CHCH3中有2种位置不同的氢,所以其一氯代物有2种,能生成2种沸点不同的产物,故B错误;
C.(CH3)2CHCH(CH3)2含有2种等效氢,所以能生成2种沸点不同的有机物,故C错误;
D.(CH3)3CCH2CH3中有3种位置不同的氢,所以其一氯代物有3种,能生成3种沸点不同的产物,故D正确.
故选D.
【点评】本题考查了常见有机物的同分异构体的判断,难度不大,为高频考点,侧重于学生的分析能力的考查,注意掌握书写同分异构体的方法,明确判断有机物分子中等效氢原子的方法:①分子中同一甲基上连接的氢原子等效;②同一碳原子所连甲基上的氢原子等效;③处于镜面对称位置(相当于平面成像时,物与像的关系)上的氢原子等效.
12.某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )
A.
甲装置:可用来证明碳的非金属性比硅强
B.
乙装置:橡皮管的作用是能使水顺利流下
C.
丙装置:用图示的方法不能检查此装置的气密性
D.
丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集NO
【考点】化学实验方案的评价.
【分析】A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.利用压强差将液体顺利流下;
C.能产生压强差的装置能检验装置气密性;
D.常温下二氧化碳和NO不反应,可以采用排二氧化碳法收集NO.
【解答】解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,二氧化碳和硅酸钠溶液反应生成硅酸,说明碳酸酸性大于硅酸,碳酸、硅酸都是其最高价氧化物的水化物,所以非金属性C>Si,故A正确;
B.产生的气体通过橡皮管进入分液漏斗上部,导致分液漏斗上部和烧瓶内气体产生压强差,所以利用压强差将液体顺利流下,故B正确;
C.该装置能通过调节乙能产生压强差,所以能利用该装置检验装置气密性,故C错误;
D.常温下二氧化碳和NO不反应,可以采用排二氧化碳法收集NO,二氧化碳密度大于NO,所以该采用向下排二氧化碳法收集NO,则先从①口进气集满二氧化碳,再从②口进气,可收集NO,故D正确;
故选C.
【点评】本题考查化学实验方案评价,涉及气体收集、气密性检验、非金属性强弱判断等知识点,明确实验原理是解本题关键,会从实验操作规范性及物质性质进行评价,易错选项是D.
13.下列装置或操作能达到实验目的是( )
A.甲装置可用来分离乙醇和乙酸
B.乙装置可以构成原电池
C.在制备乙酸乙酯的实验中,丙装置中的饱和碳酸钠可以用氢氧化钠溶液代替
D.丁装置可以用来分离乙醇和丁醇和混合物
【考点】化学实验方案的评价.
【分析】A.乙酸和乙醇互溶,不能通过分液操作分离;
B.锌和铜都不与酒精反应,该装置无法构成原电池;
C.氢氧化钠溶液能够与乙酸乙酯反应,不能用氢氧化钠溶液取代饱和碳酸钠溶液;
D.根据蒸馏操作中温度计位置、冷凝管通水方向分析.
【解答】解:A.乙酸易溶于乙醇,无法通过分液的方法分离乙醇和乙酸,故A错误;
B.乙装置中缺少电解质溶液,无法构成原电池,故B错误;
C.NaOH能够与乙酸乙酯反应,不能用浓氢氧化钠溶液代替饱和碳酸钠溶液,故C错误;
D.图示装置中,冷凝管放在蒸馏烧瓶的支管口处,冷凝管采用逆向通水,该装置能够用来分离乙醇和丁醇和混合物,故D正确;
故选D.
【点评】本题考查了化学实验方案的设计与评价,题目难度中等,明确常见化学实验基本操作方法为解答关键,试题侧重基础知识的考查,有利于提高学生的分析、理解能力及化学实验能力.
14.下列各组物质中属于同分异构体的是( )
A.和
B.CH3CH2OH和CH3
CH2﹣O﹣CH2CH3
C.和
D.和
【考点】辨识简单有机化合物的同分异构体.
【分析】根据同分异构体是指分子式相同,但结构不同的化合物,据此解答.
【解答】解:A.和,分子式相同,结构相同,属于同种物质,故A错误;
B.CH3CH2OH和CH3
CH2﹣O﹣CH2CH3,分子式不同,不属于同分异构体,故B错误;
C.和,分子式相同,结构不同,属于同分异构体,故C正确;
D.和,分子式相同,结构相同,属于同种物质,故D错误;
故选C.
【点评】本题考查了同分异构体的判断、有机物的结构,难度不大,注意对同分异构体定义的理解.
15.1mol某饱和烷烃在氧气中充分燃烧,需要消耗氧气246.4L(标准状况下).它在光照的条件下与氯气反应能生成3种不同的一氯取代物.该烃的结构简式是( )
A.
B.CH3CH2CH2CH2CH3
C.
D.
【考点】有关有机物分子式确定的计算.
【分析】该饱和烷烃在光照的条件下与氯气反应能生成3种不同的一氯取代物,说明该饱和烷烃中含有3种类型的氢原子;消耗氧气的物质的量为:
=11mol,根据饱和烷烃燃烧的通式和题干中1mol烃燃烧时的耗氧量确定烃的化学式,根据计算结果对各选项进行判断.
【解答】解:该饱和烷烃在光照的条件下与氯气反应能生成3种不同的一氯取代物,说明该饱和烷烃中含有4种类型的氢原子;
消耗氧气的物质的量为:
=11mol,设该饱和烷烃的通式为CxH2x+2,1mol某饱和烷烃在氧气中充分燃烧,需要消耗氧气的物质的量=(x+)mol=11mol,解得:x=7,
所以该饱和烷烃是庚烷,且含有3种类型的氢原子,故B、D错误;
A.分子中含有5种类型的氢原子,故A错误;
C.分子中含有7个C,为庚烷,其结构简式中含有3种类型的氢原子,满足条件,故C正确;
故选C.
【点评】本题考查考有机物分子式、结构简式的确定,题目难度中等,通过计算确定有机物分子中含有碳原子数为解答关键,注意掌握判断等效H原子的方法,试题培养了学生的分析能力及灵活应用能力.
16.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
A.电池工作时,锌失去电子,锌是负极
B.电池工作时,溶液中OH﹣向正极移动,K+、H+向负极移动
C.电池负极的电极反应式为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
【考点】原电池和电解池的工作原理.
【分析】该原电池中,Zn失电子作负极、二氧化锰作正极,负极反应式为Zn﹣2e﹣+2OH﹣═Zn(OH)2,正极反应式为2MnO2+H2O+2e﹣=Mn2O3+2OH﹣,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.
【解答】解:A、原电池工作原理是,负极失电子,发生氧化反应,故A正确;
B、电池工作时,电子由负极流向正极,根据异性电荷相吸,溶液中K+、H+向正极移动,OH﹣向负极移动,故B错误;
C、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn﹣2e﹣+2OH﹣=Zn(OH)2,故C正确;
D、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则6.5gZn反应转移0.2mol电子,故D正确;
故选B.
【点评】本题考查了原电池、电解池工作原理,理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路.
二、解答题(共4小题,满分52分)
17.下面列出了几组物质,请将物质的合适组号填写在空格上.
①金刚石与C60;②O2与O3;③16O、17O和18O;
④CH4和CH3CH2CH3;⑤乙烯和乙烷;⑥葡糖糖和果糖
⑦和;⑧和;
(1)互为同位素的是 ③ ;
(2)互为同素异形体的是 ①② ;
(3)互为同系物的是 ④⑦ ;
(4)互为同分异构体的是 ⑥⑧ .
【考点】同位素及其应用;同素异形体;有机化合物的异构现象;芳香烃、烃基和同系物.
【分析】(1)同位素质子数相同,中子数不同的原子;
(2)同素异形体指的是由同种元素形成的结构不同的单质;
(3)同系物是指结构相似,即组成元素相同,官能团种类、个数相同,在分子组成上相差一个或若干个CH2原子团,即分子组成通式相同的物质;
(4)同分异构体是分子式相同,但结构不同的化合物.
【解答】解:①金刚石与C60都由碳元素形成的结构不同的单质,为同素异形体,
②O2与O3都由氧元素形成的结构不同的单质,为氧元素的同素异形体,
③16O、17O和18O质子数相同,中子数不同的原子,属于同位素.
④CH4和CH3CH2CH3,⑦和为烷烃结构,④分子组成上相差两个CH2原子团,⑦分子组成上相差一个CH2原子团,属于同系物.
⑤乙烯和乙烷,是化合物,分子式不同,结构不同既不是同分异构体,也不是同系物.
⑥葡糖糖和果糖,⑧和分子式相同结构不同为同分异构体,
(1)互为同位素的是③,故答案为:③;
(2)互为同素异形体的是①②,故答案为:①②;
(3)互为同系物的是④⑦,故答案为:④⑦;
(4)互为同分异构体的是⑥⑧,故答案为:⑥⑧.
【点评】本题考查了主要对几个带“同字”概念的考查及识别判断能力.注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体,掌握基础是解题关键,题目难度中等.
18.原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
(1)a和b不连接时,烧杯中发生反应的离子方程式是 Zn+2H+=Zn2++H2↑
(2)a和b用导线连接,Cu极为原电池 正 极(填“正”或“负”),电极反应式是;Zn极发生 氧化 (填“氧化”或“还原”)反应,溶液中H+移向 Cu (填“Cu”或“Zn”)极.
(3)a和b用导线连接,若Zn片质量减轻了6.5g,则另一极上理论上产生气体 2.24 L(标况下).
(4)有同学向把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? 否 (填“是”或“否”),理由是 此反应为非氧化还原反应,且反应吸热 .
【考点】原电池和电解池的工作原理.
【分析】(1)a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应;
(2)a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,电解质溶液中阳离子向正极移动;
(3)根据锌与转移电子之间的关系式计算;
(4)能设计成原电池的化学反应必须是能自发进行的放热的氧化还原反应.
【解答】解:(1)a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子反应方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(2)a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e﹣=H2↑;锌失电子发生氧化反应而作负极,放电时,电解质溶液中氢离子向正极铜电极移动,
故答案为:正;2H++2e﹣=H2↑;氧化;Cu;
(3)电子转移关系为:Zn~2e﹣~H2,锌片减少的质量为6.5g,其物质的量为0.1mol,产生氢气为0.1mol,在标况下的体积为2.24L,
故答案为:2.24L;
(4)该反应不是氧化还原反应,且是吸热反应,所以不能设计成原电池,
故答案为:否;此反应为非氧化还原反应,且反应吸热.
【点评】本题考查原电池原理、氧化还原反应的有关计算等知识点,明确能设计成原电池的反应特点,为易错点.
19.实验室中用二氧化锰和浓盐酸反应制备氯气.进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母):接 E﹣C ;接 D﹣A ;接 B﹣H ;接 G﹣F .
(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有 圆底烧瓶、分液漏斗 .
(3)写出用如图装置制备氯气的离子方程式 MnO2+2Cl﹣+4H+Mn2++Cl2↑+2H2O :
(4)A、B两组同学分别用两种方法制取氯气:A组用含146g
HCl的浓盐酸与足量的二氧化锰反应;B组用87g二氧化锰与足量的浓盐酸反应,则所得氯气的物质的量的关系为A < B(填“>”、“<”或“=”)
(5)实验中饱和食盐水的作用是 除去挥发出的HCl气体,抑制C12在水中的溶解 :
(6)写出氯气尾气吸收的化学方程式: Cl2+2NaOH=NaCl+NaClO+H2O .
(7)如何验证氯气已经收集满?
【考点】氯气的实验室制法.
【分析】(1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(2)发生装置是制备氯气的装置,需要圆底烧瓶、分液漏斗和酒精灯等;
(3)实验制备氯气气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(4)浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,以此解答该题;
(5)根据氯气、氯化氢的溶解性大小分析;
(6)氯气有毒,多余的氯气需要用氢氧化钠吸收;
(7)氯气为黄绿色气体,密度大于空气密度,依据集气瓶是否充满黄绿色气体判断;
【解答】解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;除杂装置中长导管进气、短导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接盛有饱和食盐水的装置后连接盛浓硫酸的装置;收集装置中,氯气的密度大于空气的,应该采用长进短出的方式,故导管连接顺序为:E﹣C﹣D﹣A﹣B﹣H﹣G﹣F,
故答案为:E﹣C;D﹣A;B﹣H;G﹣F;
(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有反应容器圆底烧瓶、添加浓盐酸的分液漏斗、加热需要的酒精灯等,所以用到的玻璃仪器除酒精灯外,还有圆底烧瓶、分液漏斗,
故答案为:圆底烧瓶、分液漏斗;
(3)气体发生装置中进行的反应是氯气的实验室制备,反应的离子方程式为:MnO2+2Cl﹣+4H+Mn2++Cl2↑+2H2O,
故答案为:MnO2+2Cl﹣+4H+Mn2++Cl2↑+2H2O;
(4)反应的化学方程式为:4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O,
A.n(HCl)==4mol,n(MnO2)==2mol,浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,所以生成的n(Cl2)<1mol;
B.n(MnO2)==1mol,由于浓盐酸足量,生成的n(Cl2)=1mol,所以所得C12的物质的量的关系,A<B,
故答案为:<;
(5)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl﹣+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,
故答案为:除去挥发出的HCl气体,抑制C12在水中的溶解;
(6)氯气是有毒的气体,氢氧化钠溶液和氯气反应,所以可用氢氧化钠溶液吸收多余的氯气,防止污染空气,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(7)氯气为黄绿色气体,密度大于空气密度,所以当收集满氯气时,集气瓶充满黄绿色气体,观察集气瓶是否充满黄绿色气体验证,
答:集气瓶充满黄绿色气体;
【点评】本题考查了氯气的实验室制法及其化学性质,题目难度中等,注意明确实验装置仪器的连接顺序为:实验发生装置→除杂装置→收集装置→尾气处理装置;还要掌握实验室制备气体的装置选择、实验除杂的方法选择及试剂作用、化学方程式的书写方法、反应现象判断等知识.
20.A、B、C、D、E在一定条件下存在如下转化关系.其中A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平.E具有水果香味.(部分反应条件、产物被省略).
已知:2CH3CHO+O2→2CH3COOH.
(1)工业上,由石油获得石蜡油的方法是 分离 ;由石蜡油获得A是 化学 变化.(填“物理”或“化学”)
(2)B、D中所含官能团的名称为 羟基 、 羧基 .
(3)写出下列反应方程式,并表明反应类型
A→B: CH2=CH2+H2OCH3CH2OH ;反应类型: 加成反应
B→C: 2CH3CH2OH+O22CH3CHO+2H2O ;反应类型: 氧化反应
B+D→E: CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O ;反应类型: 酯化反应或取代反应
(4)在实验室制备E物质的过程中,饱和碳酸钠溶液的作用有: 中和乙酸、溶解乙醇,降低乙酸乙酯溶解度,便于分层 .
(5)在乙酸乙酯、乙醇、乙酸溶液共存的化学平衡体系中加入重水(D2O),经过足够长的时间后,可以发现除水外,体系中含有重氢的化合物是 C .
A.乙酸
B.乙醇
C.乙酸、乙醇
D.乙酸乙酯.
【考点】有机物的推断.
【分析】A的产量通常衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水在一定条件下发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应酯化反应生成E为CH3COOCH2CH3.
【解答】解:A的产量通常衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水在一定条件下发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应酯化反应生成E为CH3COOCH2CH3.
(1)工业上,由石油分馏获得石蜡油,由石蜡油裂化获得乙烯,属于化学变化,
故答案为:分馏;化学;
(2)B为CH3CH2OH,含有官能团为羟基,D为CH3COOH,含有官能团为羧基,
故答案为:羟基;羧基;
(3)A→B是CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应的化学方程式为:CH2=CH2+H2OCH3CH2OH;
B→C是乙醇在Cu作催化剂条件下发生氧化反应生成CH3CHO,反应的化学方程式为:2CH3CH2OH+O22CH3CHO+2H2O;
反应B+D→E是乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯,反应方程式是:CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O,也属于取代反应,
故答案为:CH2=CH2+H2OCH3CH2OH,加成反应;
2CH3CH2OH+O22CH3CHO+2H2O,氧化反应;
CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O,酯化反应或取代反应;
(4)在实验室制备乙酸乙酯的过程中,饱和碳酸钠溶液的作用有:中和乙酸、溶解乙醇,降低乙酸乙酯溶解度,便于分层,
故答案为:中和乙酸、溶解乙醇,降低乙酸乙酯溶解度,便于分层;
(5)酯化反应中羧酸提供羟基,醇提供羟基氢,反应生成酯与水,且是可逆反应,在乙酸乙酯、乙醇、乙酸溶液共存的化学平衡体系中加入重水(D2O),经过足够长的时间后,可以发现除水外,体系中含有重氢的化合物是:乙酸、乙醇,
故答案为:C.
【点评】本题考查有机物推断,涉及烯烃、醇、醛、羧酸、酯之间的转化,注意乙酸乙酯之比中饱和碳酸钠溶液作用,酯化反应中羧酸提供羟基、醇提供羟基氢,注意基础知识的理解掌握.
一、选择题(每小题只有一个答案.共16题,每题3分,共48分)
1.下列说法中正确的是( )
A.石油的分馏和煤的干馏都是物理变化
B.油脂、淀粉、纤维素都是高分子化合物
C.酯类物质是形成水果香味的主要成分
D.纤维素和淀粉互为同分异构体
2.下列化学用语书写正确的是( )
A.丙酸的结构简式:CH3CH2COOH
B.甲烷的结构式:CH4
C.乙烯的结构简式:CH2CH2
D.乙醇的结构式:
3.下列与有机化合物结构、性质有关的叙述正确的是( )
A.苯与溴水在铁做催化剂的作用下可以发生取代反应
B.甲烷和苯都既能发生取代反应,又能使酸性KMnO4溶液退色
C.乙醇和乙酸分子中都含羟基,都既能与Na反应,又能与NaOH溶液反应
D.甲苯可与浓硝酸在一定条件下发生取代反应
4.常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A.C2H5OH
B.CH4
C.C2H4O
D.C3H8O2
5.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A.①③②④
B.①③④②
C.③④②①
D.③①②④
6.如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
选
项
M
N
P
A
锌
铜
稀硫酸
B
铜
铁
稀盐酸
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
A.A
B.B
C.C
D.D
7.下列反应中,属于加成反应的是( )
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.乙烯使溴水褪色
C.将苯滴入少量到溴水中,振荡后水层接近无色
D.乙烯使酸性高锰酸钾溶液褪色
8.现有三组溶液:①汽油和氯化钠溶液
②39%的乙醇溶液
⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
9.某有机物的结构简式如图,下列说法正确的是( )
A.该有机物的分子式为C11H15O3
B.该有机物不能发生取代反应
C.1
mol该物质与足量的钠反应可以生成1
mol氢气
D.1
mol该有机物可以与1
mol碳酸钠发生反应
10.巴豆酸的结构简式为CH3﹣CH═CH﹣COOH.现有①氯化氢、②溴水、③纯碱溶液、④丁醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )
A.只有②④⑤
B.只有①③④
C.只有①②③④
D.全部
11.进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
A.(CH3)2CHCH2CH2CH3
B.(CH3)2CHCH3
C.(CH3)2CH﹣CH(CH3)2
D.(CH3)3CCH2CH3
12.某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )
A.
甲装置:可用来证明碳的非金属性比硅强
B.
乙装置:橡皮管的作用是能使水顺利流下
C.
丙装置:用图示的方法不能检查此装置的气密性
D.
丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集NO
13.下列装置或操作能达到实验目的是( )
A.甲装置可用来分离乙醇和乙酸
B.乙装置可以构成原电池
C.在制备乙酸乙酯的实验中,丙装置中的饱和碳酸钠可以用氢氧化钠溶液代替
D.丁装置可以用来分离乙醇和丁醇和混合物
14.下列各组物质中属于同分异构体的是( )
A.和
B.CH3CH2OH和CH3
CH2﹣O﹣CH2CH3
C.和
D.和
15.1mol某饱和烷烃在氧气中充分燃烧,需要消耗氧气246.4L(标准状况下).它在光照的条件下与氯气反应能生成3种不同的一氯取代物.该烃的结构简式是( )
A.
B.CH3CH2CH2CH2CH3
C.
D.
16.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
A.电池工作时,锌失去电子,锌是负极
B.电池工作时,溶液中OH﹣向正极移动,K+、H+向负极移动
C.电池负极的电极反应式为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
二、解答题(共4小题,满分52分)
17.下面列出了几组物质,请将物质的合适组号填写在空格上.
①金刚石与C60;②O2与O3;③16O、17O和18O;
④CH4和CH3CH2CH3;⑤乙烯和乙烷;⑥葡糖糖和果糖
⑦和;⑧和;
(1)互为同位素的是 ;
(2)互为同素异形体的是 ;
(3)互为同系物的是 ;
(4)互为同分异构体的是 .
18.原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
(1)a和b不连接时,烧杯中发生反应的离子方程式是
(2)a和b用导线连接,Cu极为原电池 极(填“正”或“负”),电极反应式是;Zn极发生 (填“氧化”或“还原”)反应,溶液中H+移向 (填“Cu”或“Zn”)极.
(3)a和b用导线连接,若Zn片质量减轻了6.5g,则另一极上理论上产生气体 L(标况下).
(4)有同学向把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 .
19.实验室中用二氧化锰和浓盐酸反应制备氯气.进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母):接 ;接 ;接 ;接 .
(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有 .
(3)写出用如图装置制备氯气的离子方程式 :
(4)A、B两组同学分别用两种方法制取氯气:A组用含146g
HCl的浓盐酸与足量的二氧化锰反应;B组用87g二氧化锰与足量的浓盐酸反应,则所得氯气的物质的量的关系为A B(填“>”、“<”或“=”)
(5)实验中饱和食盐水的作用是 :
(6)写出氯气尾气吸收的化学方程式: .
(7)如何验证氯气已经收集满?
20.A、B、C、D、E在一定条件下存在如下转化关系.其中A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平.E具有水果香味.(部分反应条件、产物被省略).
已知:2CH3CHO+O2→2CH3COOH.
(1)工业上,由石油获得石蜡油的方法是 ;由石蜡油获得A是 变化.(填“物理”或“化学”)
(2)B、D中所含官能团的名称为 、 .
(3)写出下列反应方程式,并表明反应类型
A→B: ;反应类型:
B→C: ;反应类型:
B+D→E: ;反应类型:
(4)在实验室制备E物质的过程中,饱和碳酸钠溶液的作用有: .
(5)在乙酸乙酯、乙醇、乙酸溶液共存的化学平衡体系中加入重水(D2O),经过足够长的时间后,可以发现除水外,体系中含有重氢的化合物是 .
A.乙酸
B.乙醇
C.乙酸、乙醇
D.乙酸乙酯.
2015-2016学年山东省德州市跃华学校高一(下)月考化学试卷(理科)(6月份)
参考答案与试题解析
一、选择题(每小题只有一个答案.共16题,每题3分,共48分)
1.下列说法中正确的是( )
A.石油的分馏和煤的干馏都是物理变化
B.油脂、淀粉、纤维素都是高分子化合物
C.酯类物质是形成水果香味的主要成分
D.纤维素和淀粉互为同分异构体
【考点】物理变化与化学变化的区别与联系;同分异构现象和同分异构体;有机高分子化合物的结构和性质.
【分析】A.煤的干馏是煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程;
B.油脂不是高分子化合物;
C.一些酯类物质具有水果香味;
D.纤维素和淀粉的聚合度不同.
【解答】解:A.石油分馏是分离几种不同沸点的混合物的一种方法,属于物理变化,煤的干馏是化学变化,煤的干馏是煤在隔绝空气条件下加热、分解,生成焦炭(或半焦)、煤焦油、粗苯、煤气等产物的过程,属于化学变化,故A错误;
B.油脂不是高分子化合物,淀粉、纤维素都是高分子化合物,故B错误;
C.一些酯类物质具有水果香味,形成水果香味的主要成分是酯类,故C正确;
D.纤维素和淀粉的聚合度不同,分子式不同,因此不是同分异构体,故D错误;
故选C.
【点评】本题考查化石能源的开发利用、常见有机物的结构和性质,题目难度不大,注意纤维素和淀粉的分子式虽然写法相同,但聚合物不同.
2.下列化学用语书写正确的是( )
A.丙酸的结构简式:CH3CH2COOH
B.甲烷的结构式:CH4
C.乙烯的结构简式:CH2CH2
D.乙醇的结构式:
【考点】电子式、化学式或化学符号及名称的综合;结构式;结构简式.
【分析】A.丙酸含﹣COOH,共3个C;
B.甲烷的分子式为CH4,为正四面体结构;
C.乙烯中含碳碳双键;
D.乙醇中含﹣OH.
【解答】解:A.丙酸含﹣COOH,共3个C,结构简式为CH3CH2COOH,故A正确;
B.甲烷的分子式为CH4,为正四面体结构,结构式为,故B错误;
C.乙烯中含碳碳双键,结构简式为CH2=CH2,故C错误;
D.乙醇中含﹣OH,结构式为,而为甲醚,故D错误;
故选A.
【点评】本题考查化学用语的综合应用,为高频考点,涉及结构式、结构简式等,把握有机物的结构、官能团为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.
3.下列与有机化合物结构、性质有关的叙述正确的是( )
A.苯与溴水在铁做催化剂的作用下可以发生取代反应
B.甲烷和苯都既能发生取代反应,又能使酸性KMnO4溶液退色
C.乙醇和乙酸分子中都含羟基,都既能与Na反应,又能与NaOH溶液反应
D.甲苯可与浓硝酸在一定条件下发生取代反应
【考点】有机物的结构和性质;有机化学反应的综合应用.
【分析】A.苯与溴水不反应;
B.甲烷和苯均与高锰酸钾不反应;
C.乙醇与NaOH不反应;
D.甲苯可与浓硝酸发生取代反应生成硝基甲苯.
【解答】解:A.苯与溴水不反应,苯与液溴在铁做催化剂的作用下可以发生取代反应,故A错误;
B.甲烷和苯均与高锰酸钾不反应,但均可发生取代反应,故B错误;
C.乙醇与NaOH不反应,乙酸与NaOH反应,但均与Na反应生成氢气,故C错误;
D.甲苯可与浓硝酸在浓硫酸作催化剂条件下发生取代反应生成硝基甲苯,苯环上H被取代,故D正确;
故选D.
【点评】本题考查有机物的结构与性质,侧重于学生的分析能力的考查,把握官能团与性质的关系、有机反应等为解答的关键,题目难度不大.
4.常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是( )
A.C2H5OH
B.CH4
C.C2H4O
D.C3H8O2
【考点】化学方程式的有关计算.
【分析】有机物燃烧的通式为CxHyOz+(x+﹣)O2→xCO2+H2O,以此计算.
【解答】解:有机物燃烧的通式为CxHyOz+(x+﹣)O2→xCO2+H2O,有机物均为1mol,则
A.消耗氧气为1mol×(2++)=3mol;
B.消耗氧气1mol×(1+)=2mol;
C.消耗氧气1mol×(2+﹣)=2.5mol;
D.消耗氧气1mol×(3+﹣)=4mol,
消耗氧气最多的是C3H8O2,
故选D.
【点评】本题考查化学反应的计算,为高频考点,把握有机物燃烧规律为解答的关键,侧重分析与计算能力的考查,注意通式法应用,题目难度不大.
5.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池.①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活泼性由大到小的顺序是( )
A.①③②④
B.①③④②
C.③④②①
D.③①②④
【考点】常见金属的活动性顺序及其应用.
【分析】组成原电池时,负极金属较为活泼,可根据电子、电流的流向以及反应时正负极的变化判断原电池的正负极,则可判断金属的活泼性强弱.
【解答】解:组成原电池时,负极金属较为活泼,
①②相连时,外电路电流从②流向①,说明①为负极,活泼性①>②;
①③相连时,③为正极,活泼性①>③;
②④相连时,②上有气泡逸出,应为原电池的正极,活泼性④>②;
③④相连时,③的质量减少,③为负极,活泼性③>④,
综上分析可知活泼性:①>③>④>②.
故选B.
【点评】本题考查金属活泼性的判断,侧重于原电池的考查,注意原电池的组成特点以及工作原理,题目难度不大.
6.如图所示装置中,可观察到电流表指针偏转,M棒变粗,N棒变细.下表所列M、N、P物质中,可以组合成该装置的是( )
选
项
M
N
P
A
锌
铜
稀硫酸
B
铜
铁
稀盐酸
C
银
锌
硝酸银溶液
D
锌
铁
硝酸铁溶液
A.A
B.B
C.C
D.D
【考点】原电池和电解池的工作原理.
【分析】先判断该装置属于什么装置,再根据原电池中正负极反应的现象判断N电极,从而判断选项.
【解答】解:该装置没有外接电源,所以是原电池.原电池中,负极材料比正极材料活泼,且负极材料是随着反应的进行质量减少,正极质量增加或放出气泡.根据题意知,N极是负极,M是正极,且N极材料比M极活泼.
A、M极材料比N极活泼,故A错误.
B、M极上质量不增加,故B错误.
C、N极材料比M极活泼,且M极上有银析出,所以质量增加,符合题意,故C正确.
D、M极材料比N极活泼,故D错误.
故选C.
【点评】原电池正负极的判断方法:
1、根据电极材料的活泼性判断
负极:活泼性相对强的一极
正极:活泼性相对弱的一极
2、根据电子流向或电流的流向判断
负极:电子流出或电流流入的一极
正极:电子流入或电流流出的一极
3、根据溶液中离子移动的方向判断
负极:阴离子移向的一极
正极:阳离子移向的一极
4、根据两极的反应类型判断
负极:发生氧化反应的一极
正极:发生还原反应的一极
5、根据电极反应的现象判断
负极:溶解或减轻的一极
正极:增重或放出气泡的一极
7.下列反应中,属于加成反应的是( )
A.甲烷与氯气混合,光照一段时间后黄绿色消失
B.乙烯使溴水褪色
C.将苯滴入少量到溴水中,振荡后水层接近无色
D.乙烯使酸性高锰酸钾溶液褪色
【考点】有机物的结构和性质.
【分析】有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应是加成反应;
有机物中的原子或原子团被其他的原子或原子团所代替生成新的化合物的反应叫取代反应;
常见能发生加成反应的物质往往含有C=C、C≡C、C=O等官能团,以此解答该题.
【解答】解:A.甲烷在光照条件下与氯气发生取代反应,故A错误;
B.乙烯含有碳碳双键,可与溴水发生加成反应1,2﹣二溴乙烷,故B正确;
C.溴水与苯不反应,为萃取现象,故C错误;
D.乙烯中含有碳碳双键,能够被酸性高锰酸钾溶液氧化,从而酸性高锰酸钾溶液褪色,该反应为氧化反应,故D错误.
故选B.
【点评】本题考查有机物的结构和性质,为高频考点,题目难度不大,侧重于有机物反应类型的判断,注意把握有机物的官能团的性质以及转化,注意相关基础知识的积累.
8.现有三组溶液:①汽油和氯化钠溶液
②39%的乙醇溶液
⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏
B.萃取、蒸馏、分液
C.分液、蒸馏、萃取
D.蒸馏、萃取、分液
【考点】物质的分离、提纯的基本方法选择与应用.
【分析】①汽油和氯化钠溶液,混合分层;②39%的乙醇溶液中乙醇与水的沸点不同;③单质溴不易溶于水,易溶于有机溶剂,以此来解答.
【解答】解:①汽油和氯化钠溶液,混合分层,则利用分液分离;
②39%的乙醇溶液中乙醇与水的沸点不同,则利用蒸馏分离;
③单质溴不易溶于水,易溶于有机溶剂,则分离氯化钠和单质溴的水溶液,选择有机溶剂萃取;
故选C.
【点评】本题考查混合物分离、提纯的方法及选择,为高频考点,把握物质的性质及性质差异、混合物分离方法为解答的关键,注重实验基础知识和基本技能的考查,注意有机物性质,题目难度不大.
9.某有机物的结构简式如图,下列说法正确的是( )
A.该有机物的分子式为C11H15O3
B.该有机物不能发生取代反应
C.1
mol该物质与足量的钠反应可以生成1
mol氢气
D.1
mol该有机物可以与1
mol碳酸钠发生反应
【考点】有机物的结构和性质.
【分析】由结构可知,分子中含碳碳双键、﹣COOH、﹣OH,结合烯烃、羧酸、醇的性质来解答.
【解答】解:A.由结构可知分子式为C11H12O3,故A错误;
B.含有羧基、羟基,可发生取代反应,故B错误;
C.含有羧基、羟基,都可与钠反应生成氢气,则1
mol该物质与足量的钠反应可以生成1
mol氢气,故C正确;
D.只有羧基与碳酸钠反应,如生成碳酸氢钠,则1
mol该有机物可以与1
mol碳酸钠发生反应,故D正确.
故选CD.
【点评】本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重烯烃、羧酸、醇性质的考查,题目难度不大.
10.巴豆酸的结构简式为CH3﹣CH═CH﹣COOH.现有①氯化氢、②溴水、③纯碱溶液、④丁醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )
A.只有②④⑤
B.只有①③④
C.只有①②③④
D.全部
【考点】有机物的结构和性质.
【分析】CH3CH=CHCOOH中含碳碳双键、﹣COOH,结合烯烃、羧酸的性质来解答.
【解答】解:巴豆酸分子中含有碳碳双键和羧基,所以巴豆酸具有烯烃和羧酸的性质,与①氯化氢、②溴水发生加成反应,与⑤酸化的高锰酸钾溶液发生氧化反应,表现碳碳双键的性质;与③纯碱溶液发生复分解反应,与④丁醇发生酯化反应,
故选D.
【点评】本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目难度中等,注意分析有机物中官能团的种类和性质是解题的关键所在.
11.进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是( )
A.(CH3)2CHCH2CH2CH3
B.(CH3)2CHCH3
C.(CH3)2CH﹣CH(CH3)2
D.(CH3)3CCH2CH3
【考点】常见有机化合物的结构.
【分析】某烷烃发生氯代反应后,只能生成三种沸点不同的一氯代产物,则说明该有机物的一氯代物有3种;根据等效氢原子来判断各烷烃中氢原子的种类,有几种类型的氢原子就有几种一氯代物,据此进行解答.
【解答】解:A.(CH3)2CHCH2CH2CH3中有5种位置不同的氢,所以其一氯代物有5种,能生成5种沸点不同的产物,故A错误;
B.(CH3)2CHCH3中有2种位置不同的氢,所以其一氯代物有2种,能生成2种沸点不同的产物,故B错误;
C.(CH3)2CHCH(CH3)2含有2种等效氢,所以能生成2种沸点不同的有机物,故C错误;
D.(CH3)3CCH2CH3中有3种位置不同的氢,所以其一氯代物有3种,能生成3种沸点不同的产物,故D正确.
故选D.
【点评】本题考查了常见有机物的同分异构体的判断,难度不大,为高频考点,侧重于学生的分析能力的考查,注意掌握书写同分异构体的方法,明确判断有机物分子中等效氢原子的方法:①分子中同一甲基上连接的氢原子等效;②同一碳原子所连甲基上的氢原子等效;③处于镜面对称位置(相当于平面成像时,物与像的关系)上的氢原子等效.
12.某研究性学习小组讨论甲、乙、丙、丁四种仪器装置的有关用法,其中不合理的是( )
A.
甲装置:可用来证明碳的非金属性比硅强
B.
乙装置:橡皮管的作用是能使水顺利流下
C.
丙装置:用图示的方法不能检查此装置的气密性
D.
丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集NO
【考点】化学实验方案的评价.
【分析】A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸;
B.利用压强差将液体顺利流下;
C.能产生压强差的装置能检验装置气密性;
D.常温下二氧化碳和NO不反应,可以采用排二氧化碳法收集NO.
【解答】解:A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,二氧化碳和硅酸钠溶液反应生成硅酸,说明碳酸酸性大于硅酸,碳酸、硅酸都是其最高价氧化物的水化物,所以非金属性C>Si,故A正确;
B.产生的气体通过橡皮管进入分液漏斗上部,导致分液漏斗上部和烧瓶内气体产生压强差,所以利用压强差将液体顺利流下,故B正确;
C.该装置能通过调节乙能产生压强差,所以能利用该装置检验装置气密性,故C错误;
D.常温下二氧化碳和NO不反应,可以采用排二氧化碳法收集NO,二氧化碳密度大于NO,所以该采用向下排二氧化碳法收集NO,则先从①口进气集满二氧化碳,再从②口进气,可收集NO,故D正确;
故选C.
【点评】本题考查化学实验方案评价,涉及气体收集、气密性检验、非金属性强弱判断等知识点,明确实验原理是解本题关键,会从实验操作规范性及物质性质进行评价,易错选项是D.
13.下列装置或操作能达到实验目的是( )
A.甲装置可用来分离乙醇和乙酸
B.乙装置可以构成原电池
C.在制备乙酸乙酯的实验中,丙装置中的饱和碳酸钠可以用氢氧化钠溶液代替
D.丁装置可以用来分离乙醇和丁醇和混合物
【考点】化学实验方案的评价.
【分析】A.乙酸和乙醇互溶,不能通过分液操作分离;
B.锌和铜都不与酒精反应,该装置无法构成原电池;
C.氢氧化钠溶液能够与乙酸乙酯反应,不能用氢氧化钠溶液取代饱和碳酸钠溶液;
D.根据蒸馏操作中温度计位置、冷凝管通水方向分析.
【解答】解:A.乙酸易溶于乙醇,无法通过分液的方法分离乙醇和乙酸,故A错误;
B.乙装置中缺少电解质溶液,无法构成原电池,故B错误;
C.NaOH能够与乙酸乙酯反应,不能用浓氢氧化钠溶液代替饱和碳酸钠溶液,故C错误;
D.图示装置中,冷凝管放在蒸馏烧瓶的支管口处,冷凝管采用逆向通水,该装置能够用来分离乙醇和丁醇和混合物,故D正确;
故选D.
【点评】本题考查了化学实验方案的设计与评价,题目难度中等,明确常见化学实验基本操作方法为解答关键,试题侧重基础知识的考查,有利于提高学生的分析、理解能力及化学实验能力.
14.下列各组物质中属于同分异构体的是( )
A.和
B.CH3CH2OH和CH3
CH2﹣O﹣CH2CH3
C.和
D.和
【考点】辨识简单有机化合物的同分异构体.
【分析】根据同分异构体是指分子式相同,但结构不同的化合物,据此解答.
【解答】解:A.和,分子式相同,结构相同,属于同种物质,故A错误;
B.CH3CH2OH和CH3
CH2﹣O﹣CH2CH3,分子式不同,不属于同分异构体,故B错误;
C.和,分子式相同,结构不同,属于同分异构体,故C正确;
D.和,分子式相同,结构相同,属于同种物质,故D错误;
故选C.
【点评】本题考查了同分异构体的判断、有机物的结构,难度不大,注意对同分异构体定义的理解.
15.1mol某饱和烷烃在氧气中充分燃烧,需要消耗氧气246.4L(标准状况下).它在光照的条件下与氯气反应能生成3种不同的一氯取代物.该烃的结构简式是( )
A.
B.CH3CH2CH2CH2CH3
C.
D.
【考点】有关有机物分子式确定的计算.
【分析】该饱和烷烃在光照的条件下与氯气反应能生成3种不同的一氯取代物,说明该饱和烷烃中含有3种类型的氢原子;消耗氧气的物质的量为:
=11mol,根据饱和烷烃燃烧的通式和题干中1mol烃燃烧时的耗氧量确定烃的化学式,根据计算结果对各选项进行判断.
【解答】解:该饱和烷烃在光照的条件下与氯气反应能生成3种不同的一氯取代物,说明该饱和烷烃中含有4种类型的氢原子;
消耗氧气的物质的量为:
=11mol,设该饱和烷烃的通式为CxH2x+2,1mol某饱和烷烃在氧气中充分燃烧,需要消耗氧气的物质的量=(x+)mol=11mol,解得:x=7,
所以该饱和烷烃是庚烷,且含有3种类型的氢原子,故B、D错误;
A.分子中含有5种类型的氢原子,故A错误;
C.分子中含有7个C,为庚烷,其结构简式中含有3种类型的氢原子,满足条件,故C正确;
故选C.
【点评】本题考查考有机物分子式、结构简式的确定,题目难度中等,通过计算确定有机物分子中含有碳原子数为解答关键,注意掌握判断等效H原子的方法,试题培养了学生的分析能力及灵活应用能力.
16.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)下列说法中错误的是( )
A.电池工作时,锌失去电子,锌是负极
B.电池工作时,溶液中OH﹣向正极移动,K+、H+向负极移动
C.电池负极的电极反应式为:Zn﹣2e﹣+2OH﹣═Zn(OH)2
D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
【考点】原电池和电解池的工作原理.
【分析】该原电池中,Zn失电子作负极、二氧化锰作正极,负极反应式为Zn﹣2e﹣+2OH﹣═Zn(OH)2,正极反应式为2MnO2+H2O+2e﹣=Mn2O3+2OH﹣,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,据此分析解答.
【解答】解:A、原电池工作原理是,负极失电子,发生氧化反应,故A正确;
B、电池工作时,电子由负极流向正极,根据异性电荷相吸,溶液中K+、H+向正极移动,OH﹣向负极移动,故B错误;
C、负极失电子,发生氧化反应,所以负极的电极反应式为:Zn﹣2e﹣+2OH﹣=Zn(OH)2,故C正确;
D、由Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s)可知,65gZn反应转移电子为2mol,则6.5gZn反应转移0.2mol电子,故D正确;
故选B.
【点评】本题考查了原电池、电解池工作原理,理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路.
二、解答题(共4小题,满分52分)
17.下面列出了几组物质,请将物质的合适组号填写在空格上.
①金刚石与C60;②O2与O3;③16O、17O和18O;
④CH4和CH3CH2CH3;⑤乙烯和乙烷;⑥葡糖糖和果糖
⑦和;⑧和;
(1)互为同位素的是 ③ ;
(2)互为同素异形体的是 ①② ;
(3)互为同系物的是 ④⑦ ;
(4)互为同分异构体的是 ⑥⑧ .
【考点】同位素及其应用;同素异形体;有机化合物的异构现象;芳香烃、烃基和同系物.
【分析】(1)同位素质子数相同,中子数不同的原子;
(2)同素异形体指的是由同种元素形成的结构不同的单质;
(3)同系物是指结构相似,即组成元素相同,官能团种类、个数相同,在分子组成上相差一个或若干个CH2原子团,即分子组成通式相同的物质;
(4)同分异构体是分子式相同,但结构不同的化合物.
【解答】解:①金刚石与C60都由碳元素形成的结构不同的单质,为同素异形体,
②O2与O3都由氧元素形成的结构不同的单质,为氧元素的同素异形体,
③16O、17O和18O质子数相同,中子数不同的原子,属于同位素.
④CH4和CH3CH2CH3,⑦和为烷烃结构,④分子组成上相差两个CH2原子团,⑦分子组成上相差一个CH2原子团,属于同系物.
⑤乙烯和乙烷,是化合物,分子式不同,结构不同既不是同分异构体,也不是同系物.
⑥葡糖糖和果糖,⑧和分子式相同结构不同为同分异构体,
(1)互为同位素的是③,故答案为:③;
(2)互为同素异形体的是①②,故答案为:①②;
(3)互为同系物的是④⑦,故答案为:④⑦;
(4)互为同分异构体的是⑥⑧,故答案为:⑥⑧.
【点评】本题考查了主要对几个带“同字”概念的考查及识别判断能力.注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体,掌握基础是解题关键,题目难度中等.
18.原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置.
(1)a和b不连接时,烧杯中发生反应的离子方程式是 Zn+2H+=Zn2++H2↑
(2)a和b用导线连接,Cu极为原电池 正 极(填“正”或“负”),电极反应式是;Zn极发生 氧化 (填“氧化”或“还原”)反应,溶液中H+移向 Cu (填“Cu”或“Zn”)极.
(3)a和b用导线连接,若Zn片质量减轻了6.5g,则另一极上理论上产生气体 2.24 L(标况下).
(4)有同学向把Ba(OH)28H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? 否 (填“是”或“否”),理由是 此反应为非氧化还原反应,且反应吸热 .
【考点】原电池和电解池的工作原理.
【分析】(1)a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应;
(2)a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,电解质溶液中阳离子向正极移动;
(3)根据锌与转移电子之间的关系式计算;
(4)能设计成原电池的化学反应必须是能自发进行的放热的氧化还原反应.
【解答】解:(1)a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子反应方程式为:Zn+2H+=Zn2++H2↑,
故答案为:Zn+2H+=Zn2++H2↑;
(2)a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e﹣=H2↑;锌失电子发生氧化反应而作负极,放电时,电解质溶液中氢离子向正极铜电极移动,
故答案为:正;2H++2e﹣=H2↑;氧化;Cu;
(3)电子转移关系为:Zn~2e﹣~H2,锌片减少的质量为6.5g,其物质的量为0.1mol,产生氢气为0.1mol,在标况下的体积为2.24L,
故答案为:2.24L;
(4)该反应不是氧化还原反应,且是吸热反应,所以不能设计成原电池,
故答案为:否;此反应为非氧化还原反应,且反应吸热.
【点评】本题考查原电池原理、氧化还原反应的有关计算等知识点,明确能设计成原电池的反应特点,为易错点.
19.实验室中用二氧化锰和浓盐酸反应制备氯气.进行此实验,所用仪器如图:
(1)连接上述仪器的正确顺序(填各接口处的字母):接 E﹣C ;接 D﹣A ;接 B﹣H ;接 G﹣F .
(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有 圆底烧瓶、分液漏斗 .
(3)写出用如图装置制备氯气的离子方程式 MnO2+2Cl﹣+4H+Mn2++Cl2↑+2H2O :
(4)A、B两组同学分别用两种方法制取氯气:A组用含146g
HCl的浓盐酸与足量的二氧化锰反应;B组用87g二氧化锰与足量的浓盐酸反应,则所得氯气的物质的量的关系为A < B(填“>”、“<”或“=”)
(5)实验中饱和食盐水的作用是 除去挥发出的HCl气体,抑制C12在水中的溶解 :
(6)写出氯气尾气吸收的化学方程式: Cl2+2NaOH=NaCl+NaClO+H2O .
(7)如何验证氯气已经收集满?
【考点】氯气的实验室制法.
【分析】(1)根据实验发生装置→除杂装置→收集装置→尾气处理装置排序;
(2)发生装置是制备氯气的装置,需要圆底烧瓶、分液漏斗和酒精灯等;
(3)实验制备氯气气的反应为二氧化锰和浓盐酸加热反应生成氯化锰、氯气和水;
(4)浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,以此解答该题;
(5)根据氯气、氯化氢的溶解性大小分析;
(6)氯气有毒,多余的氯气需要用氢氧化钠吸收;
(7)氯气为黄绿色气体,密度大于空气密度,依据集气瓶是否充满黄绿色气体判断;
【解答】解:(1)实验装置的连接顺序为:发生装置→除杂装置→收集装置→尾气处理装置;除杂装置中长导管进气、短导管出气;因为饱和食盐水中有水,浓硫酸有吸水性,所以先连接盛有饱和食盐水的装置后连接盛浓硫酸的装置;收集装置中,氯气的密度大于空气的,应该采用长进短出的方式,故导管连接顺序为:E﹣C﹣D﹣A﹣B﹣H﹣G﹣F,
故答案为:E﹣C;D﹣A;B﹣H;G﹣F;
(2)在制备氯气的发生装置中,用到的玻璃仪器除酒精灯外,还有反应容器圆底烧瓶、添加浓盐酸的分液漏斗、加热需要的酒精灯等,所以用到的玻璃仪器除酒精灯外,还有圆底烧瓶、分液漏斗,
故答案为:圆底烧瓶、分液漏斗;
(3)气体发生装置中进行的反应是氯气的实验室制备,反应的离子方程式为:MnO2+2Cl﹣+4H+Mn2++Cl2↑+2H2O,
故答案为:MnO2+2Cl﹣+4H+Mn2++Cl2↑+2H2O;
(4)反应的化学方程式为:4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O,
A.n(HCl)==4mol,n(MnO2)==2mol,浓盐酸与MnO2发生化学反应,随着反应的进行,盐酸的浓度降低,还原性减弱,稀盐酸与MnO2不反应,所以生成的n(Cl2)<1mol;
B.n(MnO2)==1mol,由于浓盐酸足量,生成的n(Cl2)=1mol,所以所得C12的物质的量的关系,A<B,
故答案为:<;
(5)氯化氢极易溶于水,氯气能溶于水,且与水反应,Cl2+H2O=H++Cl﹣+HClO,食盐水溶液中的氯离子抑制氯气的溶解,降低氯气的溶解度,
故答案为:除去挥发出的HCl气体,抑制C12在水中的溶解;
(6)氯气是有毒的气体,氢氧化钠溶液和氯气反应,所以可用氢氧化钠溶液吸收多余的氯气,防止污染空气,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(7)氯气为黄绿色气体,密度大于空气密度,所以当收集满氯气时,集气瓶充满黄绿色气体,观察集气瓶是否充满黄绿色气体验证,
答:集气瓶充满黄绿色气体;
【点评】本题考查了氯气的实验室制法及其化学性质,题目难度中等,注意明确实验装置仪器的连接顺序为:实验发生装置→除杂装置→收集装置→尾气处理装置;还要掌握实验室制备气体的装置选择、实验除杂的方法选择及试剂作用、化学方程式的书写方法、反应现象判断等知识.
20.A、B、C、D、E在一定条件下存在如下转化关系.其中A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平.E具有水果香味.(部分反应条件、产物被省略).
已知:2CH3CHO+O2→2CH3COOH.
(1)工业上,由石油获得石蜡油的方法是 分离 ;由石蜡油获得A是 化学 变化.(填“物理”或“化学”)
(2)B、D中所含官能团的名称为 羟基 、 羧基 .
(3)写出下列反应方程式,并表明反应类型
A→B: CH2=CH2+H2OCH3CH2OH ;反应类型: 加成反应
B→C: 2CH3CH2OH+O22CH3CHO+2H2O ;反应类型: 氧化反应
B+D→E: CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O ;反应类型: 酯化反应或取代反应
(4)在实验室制备E物质的过程中,饱和碳酸钠溶液的作用有: 中和乙酸、溶解乙醇,降低乙酸乙酯溶解度,便于分层 .
(5)在乙酸乙酯、乙醇、乙酸溶液共存的化学平衡体系中加入重水(D2O),经过足够长的时间后,可以发现除水外,体系中含有重氢的化合物是 C .
A.乙酸
B.乙醇
C.乙酸、乙醇
D.乙酸乙酯.
【考点】有机物的推断.
【分析】A的产量通常衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水在一定条件下发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应酯化反应生成E为CH3COOCH2CH3.
【解答】解:A的产量通常衡量一个国家的石油化工水平,则A为CH2=CH2,乙烯与水在一定条件下发生加成反应生成B为CH3CH2OH,乙醇在Cu作催化剂条件下发生氧化反应生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3CH2OH和CH3COOH在浓硫酸作用下反应酯化反应生成E为CH3COOCH2CH3.
(1)工业上,由石油分馏获得石蜡油,由石蜡油裂化获得乙烯,属于化学变化,
故答案为:分馏;化学;
(2)B为CH3CH2OH,含有官能团为羟基,D为CH3COOH,含有官能团为羧基,
故答案为:羟基;羧基;
(3)A→B是CH2=CH2与水在一定条件下发生加成反应生成CH3CH2OH,反应的化学方程式为:CH2=CH2+H2OCH3CH2OH;
B→C是乙醇在Cu作催化剂条件下发生氧化反应生成CH3CHO,反应的化学方程式为:2CH3CH2OH+O22CH3CHO+2H2O;
反应B+D→E是乙醇与乙酸在浓硫酸、加热条件下生成乙酸乙酯,反应方程式是:CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O,也属于取代反应,
故答案为:CH2=CH2+H2OCH3CH2OH,加成反应;
2CH3CH2OH+O22CH3CHO+2H2O,氧化反应;
CH3CH2OH+CH3COOHCH3COOCH2CH3+H2O,酯化反应或取代反应;
(4)在实验室制备乙酸乙酯的过程中,饱和碳酸钠溶液的作用有:中和乙酸、溶解乙醇,降低乙酸乙酯溶解度,便于分层,
故答案为:中和乙酸、溶解乙醇,降低乙酸乙酯溶解度,便于分层;
(5)酯化反应中羧酸提供羟基,醇提供羟基氢,反应生成酯与水,且是可逆反应,在乙酸乙酯、乙醇、乙酸溶液共存的化学平衡体系中加入重水(D2O),经过足够长的时间后,可以发现除水外,体系中含有重氢的化合物是:乙酸、乙醇,
故答案为:C.
【点评】本题考查有机物推断,涉及烯烃、醇、醛、羧酸、酯之间的转化,注意乙酸乙酯之比中饱和碳酸钠溶液作用,酯化反应中羧酸提供羟基、醇提供羟基氢,注意基础知识的理解掌握.
同课章节目录
