苏教版化学选修二2.2《氯碱生产》课件 (共33张PPT)
文档属性
| 名称 | 苏教版化学选修二2.2《氯碱生产》课件 (共33张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 337.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-18 23:19:26 | ||
图片预览











文档简介
课件33张PPT。第二单元 氯碱生产1.电解饱和食盐水的方程式?阴极与阳极产物是什么?2.电解饱和食盐水,若使电解质溶液恢复到原来的状态,需加一定量的盐酸溶液,请问阳极产物是什么物质?
提示 由于加盐酸溶液电解质溶液才复原,说明电解分两个阶段,第一阶段电解饱和NaCl,第二阶段电解水,阳极产物为Cl2和O2。
1.了解氯碱生产的主要原理、重要设备、流程和意义,认识实际化工生产技术问题的复杂性,增强技术意识。
2.从氯碱工业流程与技术了解化学在工农业生产中的具体应用,认识化学学科发展对化工生产技术进步的促进作用,认识化学工业在国民经济发展中的地位。1. 氯碱工业
氯碱工业是利用电解饱和食盐水生产 、 和 为基础的工业体系。电解饱和食盐水的原料比较丰富:在 和
中,食盐含量很高;在有些地区,地下也蕴藏着丰富的 。氯气烧碱氢气海水大陆盐湖食盐矿2.电解饱和食盐水
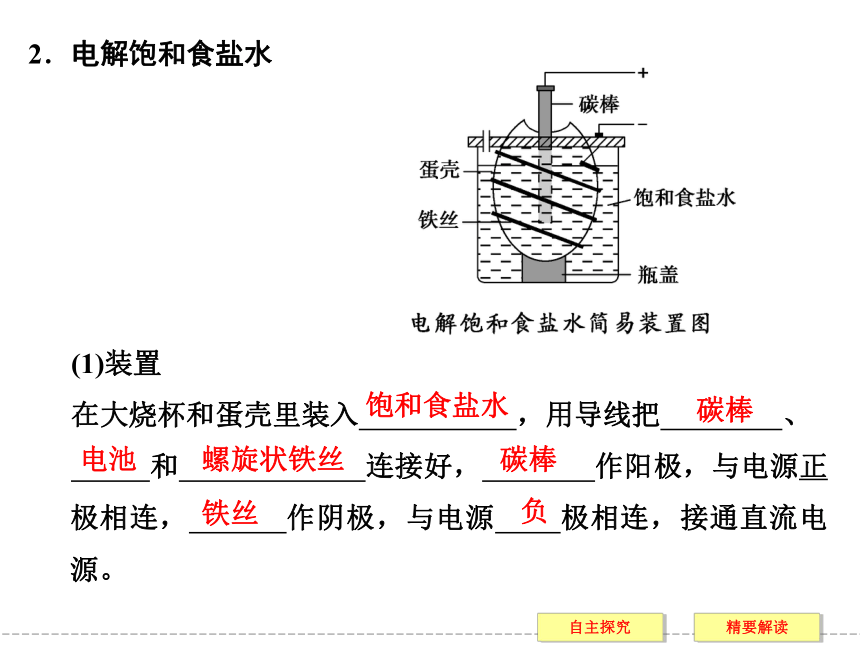
(1)装置
在大烧杯和蛋壳里装入 ,用导线把 、
和 连接好, 作阳极,与电源正极相连, 作阴极,与电源 极相连,接通直流电源。饱和食盐水碳棒电池螺旋状铁丝碳棒铁丝负(2)现象及产物的检验
看到气泡产生后,用 分别检验蛋壳内碳棒周围、烧杯溶液上方的气体,观察实现现象。蛋壳内碳棒周围的气体使湿润的淀粉碘化钾试纸变蓝,说明阳极生成的气体为 。而烧杯溶液上方的气体遇到湿润的淀粉碘化钾试纸 。
用导管收集烧杯内产生的气体点燃,燃烧并产生 ,说明阴极生成了 。分别在蛋壳和烧杯的溶液中滴入 ,只有烧杯内的溶液变红色,说明阴极生成了 。湿润的淀粉碘化钾试纸氯气不变蓝淡蓝色火焰氢气酚酞溶液氢氧化钠氧化 还原 2Cl--2e-===Cl2↑ 2H++2e-===H2↑ 提纯 BaCl2、NaOH、Na2CO3,过滤,盐酸 BaCl2、Na2CO3、NaOH,过滤,盐酸 NaOH、BaCl2、Na2CO3、过滤、盐酸 2.食盐水的电解工艺
(1)隔膜法电解工艺——石棉隔膜电解槽。
电解槽用石棉隔膜隔成 和 ,用 作阳极, 作阴极。石棉隔膜能阻止 通过,但不能阻止 通过。从阳极室向电解槽中注入经净化的 ,保持食盐水的液面高于阴极室液面,使电解液从阳极室流向阴极室。在阳极上, 被氧化生成 溶解在电解液中直至饱和,其余从阳极室放出;在阴极上,H+放电产生的 从阴极室放出。在阴极室形成的
有少量渗透到阳极室,跟溶解在里面的氯气发生反应生成 。阴极室阳极室石墨铁丝网气体水分子和离子饱和食盐水Cl-氯气氢气NaOH次氯酸盐及氯酸盐(2)离子膜电解技术——离子交换膜电解槽。
本方法采用阳离子交换膜代替前面介绍的石棉隔膜,电解时,经过净化精制的纯盐水不断送入 ,向阴极室不断加入 。阳离子交换膜具有很好的 ,它只允许阳极室的 透过交换膜进入阴极室。在阴极室放电产生 。OH- 透过交换膜进入阳极室。在阳极室,Cl-失去电子形成 ,交换膜阻止 从阳极室迁移到阴极室。OH-与从阳极室渗入的Na+形成 ,产生的NaOH比较纯。阳极室稀NaOH溶液选择性Na+、H+氢气不能Cl2Cl2NaOH 以石墨为电极电解饱和NaCl溶液,阴、阳两极的电极反应?两极区pH如何变化?【慎思1】 隔膜与离子交换膜有何区别?【慎思2】 溶液中的离子在阴阳极上放电能力如何?
提示 阳极:活性电极>Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
阴极:S2->I->Br->Cl->OH->含氧酸根>F-
电解质溶液恢复到原来状态,加入物质的原则是什么?
提示 少什么加什么,少多少加多少【慎思3】 【慎思4】 这样处理后的盐水仍含有一些Ca2+、Mg2+等金属离子,由于这些阳离子在碱性环境中会生成沉淀,损坏离子交换膜,因此该盐水还需送入阳离子交换塔,进一步通过阳离子交换树脂除去Ca2+、Mg2+等。这时的精制盐水就可以送往电解槽中进行电解了。(1)判断BaCl2已过量的方法是________________。
(2)第④步中,相关的离子方程式是___________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_______________________________。
(4)为检验精盐纯度,需配制100 mL 0.2 mol·L-1NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是______。
解析 加入BaCl2、NaOH、Na2CO3等沉淀剂后,产生BaSO4、Mg(OH)2、BaCO3、CaCO3沉淀,还有过量Na2CO3,需加入盐酸使Na2CO3转变成NaCl。但如果先加盐酸再过滤,Mg(OH)2、BaCO3、CaCO3都可能溶解,造成产品纯度不高。
离子除杂要注意以下几点:①试剂的选择 ②试剂的添加顺序 ③恰当的操作(过滤、渗析、萃取、蒸馏等)
解析 由于每步所加试剂过量,故前边的过量部分试剂要用后面的试剂除去,D项中BaCl2过量时Ba2+无法除去,故D错误。
答案 D②作用:既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH溶液作用而影响烧碱的质量。
(2)图示。 关于电解NaCl水溶液,下列叙述正确的是( )。
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液移到烧杯中,充分搅拌
后溶液呈中性【例2】答案 B
NaCl溶液中,阳离子放电顺序为H+>Na+,阴离子放电顺序为Cl->OH-,电解NaCl溶液属放氢生碱型故pH>7。 下列有关工业生产的叙述正确的是 ( )。
A.合成氨生产过程中将NH3液化分离,可加快正反应速
率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转
化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴
极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极
析出铜的质量小【体验2】解析 本题的C、D两个选项涉及了电解池的应用,其实都是考查电解原理,电解饱和食盐水阴极室产生的是H2,Cl2在阳极上生成,所以C错;电解精炼铜时要注意粗铜中含Zn、Fe、Ni、Ag、Pt、Au等,阳极开始放电的是Zn、Fe、Ni,而阴极上始终是Cu2+得电子生成Cu,所以同一时间内阳极溶解铜的质量比阴极析出铜的质量小,D对。
答案 D答案 C
氧化还原反应中,氧化剂得到的电子总数等于还原剂失去的电子总数。对于一个串联电路,每个电极上电子转移数是相等的,即得失电子守恒。 将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为 ( )。
A.4×10-3 mol·L-1 B.2×10-3 mol·L-1
C.1×10-3 mol·L-1 D.1×10-7 mol·L-1【体验3】答案 A
提示 由于加盐酸溶液电解质溶液才复原,说明电解分两个阶段,第一阶段电解饱和NaCl,第二阶段电解水,阳极产物为Cl2和O2。
1.了解氯碱生产的主要原理、重要设备、流程和意义,认识实际化工生产技术问题的复杂性,增强技术意识。
2.从氯碱工业流程与技术了解化学在工农业生产中的具体应用,认识化学学科发展对化工生产技术进步的促进作用,认识化学工业在国民经济发展中的地位。1. 氯碱工业
氯碱工业是利用电解饱和食盐水生产 、 和 为基础的工业体系。电解饱和食盐水的原料比较丰富:在 和
中,食盐含量很高;在有些地区,地下也蕴藏着丰富的 。氯气烧碱氢气海水大陆盐湖食盐矿2.电解饱和食盐水
(1)装置
在大烧杯和蛋壳里装入 ,用导线把 、
和 连接好, 作阳极,与电源正极相连, 作阴极,与电源 极相连,接通直流电源。饱和食盐水碳棒电池螺旋状铁丝碳棒铁丝负(2)现象及产物的检验
看到气泡产生后,用 分别检验蛋壳内碳棒周围、烧杯溶液上方的气体,观察实现现象。蛋壳内碳棒周围的气体使湿润的淀粉碘化钾试纸变蓝,说明阳极生成的气体为 。而烧杯溶液上方的气体遇到湿润的淀粉碘化钾试纸 。
用导管收集烧杯内产生的气体点燃,燃烧并产生 ,说明阴极生成了 。分别在蛋壳和烧杯的溶液中滴入 ,只有烧杯内的溶液变红色,说明阴极生成了 。湿润的淀粉碘化钾试纸氯气不变蓝淡蓝色火焰氢气酚酞溶液氢氧化钠氧化 还原 2Cl--2e-===Cl2↑ 2H++2e-===H2↑ 提纯 BaCl2、NaOH、Na2CO3,过滤,盐酸 BaCl2、Na2CO3、NaOH,过滤,盐酸 NaOH、BaCl2、Na2CO3、过滤、盐酸 2.食盐水的电解工艺
(1)隔膜法电解工艺——石棉隔膜电解槽。
电解槽用石棉隔膜隔成 和 ,用 作阳极, 作阴极。石棉隔膜能阻止 通过,但不能阻止 通过。从阳极室向电解槽中注入经净化的 ,保持食盐水的液面高于阴极室液面,使电解液从阳极室流向阴极室。在阳极上, 被氧化生成 溶解在电解液中直至饱和,其余从阳极室放出;在阴极上,H+放电产生的 从阴极室放出。在阴极室形成的
有少量渗透到阳极室,跟溶解在里面的氯气发生反应生成 。阴极室阳极室石墨铁丝网气体水分子和离子饱和食盐水Cl-氯气氢气NaOH次氯酸盐及氯酸盐(2)离子膜电解技术——离子交换膜电解槽。
本方法采用阳离子交换膜代替前面介绍的石棉隔膜,电解时,经过净化精制的纯盐水不断送入 ,向阴极室不断加入 。阳离子交换膜具有很好的 ,它只允许阳极室的 透过交换膜进入阴极室。在阴极室放电产生 。OH- 透过交换膜进入阳极室。在阳极室,Cl-失去电子形成 ,交换膜阻止 从阳极室迁移到阴极室。OH-与从阳极室渗入的Na+形成 ,产生的NaOH比较纯。阳极室稀NaOH溶液选择性Na+、H+氢气不能Cl2Cl2NaOH 以石墨为电极电解饱和NaCl溶液,阴、阳两极的电极反应?两极区pH如何变化?【慎思1】 隔膜与离子交换膜有何区别?【慎思2】 溶液中的离子在阴阳极上放电能力如何?
提示 阳极:活性电极>Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
阴极:S2->I->Br->Cl->OH->含氧酸根>F-
电解质溶液恢复到原来状态,加入物质的原则是什么?
提示 少什么加什么,少多少加多少【慎思3】 【慎思4】 这样处理后的盐水仍含有一些Ca2+、Mg2+等金属离子,由于这些阳离子在碱性环境中会生成沉淀,损坏离子交换膜,因此该盐水还需送入阳离子交换塔,进一步通过阳离子交换树脂除去Ca2+、Mg2+等。这时的精制盐水就可以送往电解槽中进行电解了。(1)判断BaCl2已过量的方法是________________。
(2)第④步中,相关的离子方程式是___________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_______________________________。
(4)为检验精盐纯度,需配制100 mL 0.2 mol·L-1NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是______。
解析 加入BaCl2、NaOH、Na2CO3等沉淀剂后,产生BaSO4、Mg(OH)2、BaCO3、CaCO3沉淀,还有过量Na2CO3,需加入盐酸使Na2CO3转变成NaCl。但如果先加盐酸再过滤,Mg(OH)2、BaCO3、CaCO3都可能溶解,造成产品纯度不高。
离子除杂要注意以下几点:①试剂的选择 ②试剂的添加顺序 ③恰当的操作(过滤、渗析、萃取、蒸馏等)
解析 由于每步所加试剂过量,故前边的过量部分试剂要用后面的试剂除去,D项中BaCl2过量时Ba2+无法除去,故D错误。
答案 D②作用:既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH溶液作用而影响烧碱的质量。
(2)图示。 关于电解NaCl水溶液,下列叙述正确的是( )。
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液移到烧杯中,充分搅拌
后溶液呈中性【例2】答案 B
NaCl溶液中,阳离子放电顺序为H+>Na+,阴离子放电顺序为Cl->OH-,电解NaCl溶液属放氢生碱型故pH>7。 下列有关工业生产的叙述正确的是 ( )。
A.合成氨生产过程中将NH3液化分离,可加快正反应速
率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转
化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴
极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极
析出铜的质量小【体验2】解析 本题的C、D两个选项涉及了电解池的应用,其实都是考查电解原理,电解饱和食盐水阴极室产生的是H2,Cl2在阳极上生成,所以C错;电解精炼铜时要注意粗铜中含Zn、Fe、Ni、Ag、Pt、Au等,阳极开始放电的是Zn、Fe、Ni,而阴极上始终是Cu2+得电子生成Cu,所以同一时间内阳极溶解铜的质量比阴极析出铜的质量小,D对。
答案 D答案 C
氧化还原反应中,氧化剂得到的电子总数等于还原剂失去的电子总数。对于一个串联电路,每个电极上电子转移数是相等的,即得失电子守恒。 将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化),此时溶液中氢离子浓度约为 ( )。
A.4×10-3 mol·L-1 B.2×10-3 mol·L-1
C.1×10-3 mol·L-1 D.1×10-7 mol·L-1【体验3】答案 A
同课章节目录
- 专题一 多样化的水处理技术
- 第一单元 水的净化与污水处理
- 第二单元 硬水软化
- 第三单元 海水淡化
- 专题二 从自然资源到化学品
- 第一单元 氨的合成
- 第二单元 氯碱生产
- 第三单元 硫酸工业
- 第四单元 镁和铝的冶炼
- 专题三 让有机反应为人类造福
- 第一单元 有机药物制备
- 第二单元 合成洗涤济的生产
- 第三单元 纤维素的化学加工
- 第四单元 有机高分子合成
- 专题四 材料加工与性能优化
- 第一单元 材料的加工处理
- 第二单元 材料组成的优化
- 第三单元 复合材料的制造
- 专题五 为现代农业技术添翼
- 第一单元 土壤酸碱性的改良
- 第二单元 化肥的生产与合理使用
- 第三单元 无土栽培技术
- 第四单元 化学农药的发展
- 专题六 从污染防治到绿色化学
- 第一单元 环境污染的化学防治
- 第二单元 绿色化学与可持续发展
