人教版高一化学必修一 2.3 氧化还原反应 课件 (共28张PPT)
文档属性
| 名称 | 人教版高一化学必修一 2.3 氧化还原反应 课件 (共28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-20 09:16:09 | ||
图片预览





文档简介
课件28张PPT。第3节 氧化还原反应
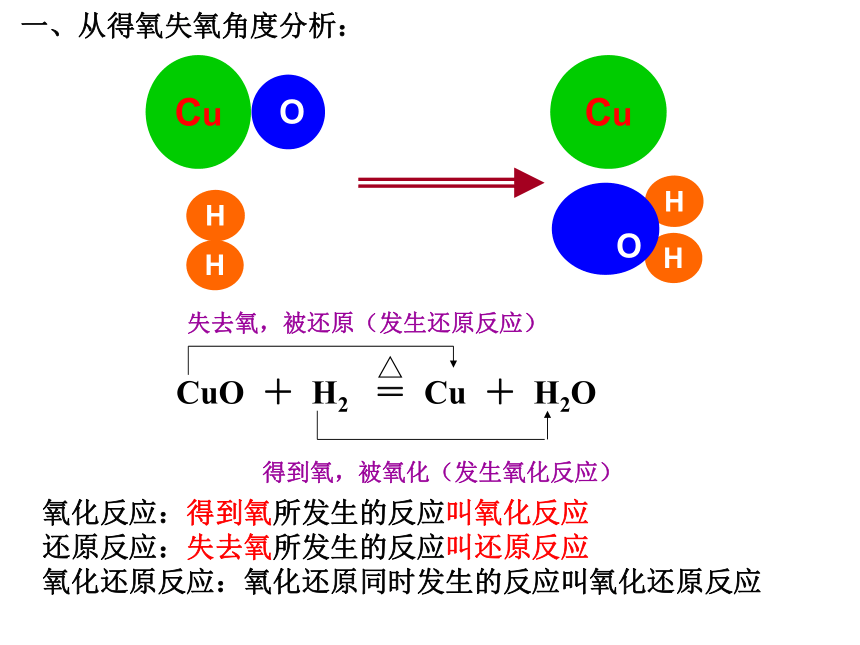
得到氧,被氧化(发生氧化反应)△ CuO + H2 = Cu + H2O 失去氧,被还原(发生还原反应)Cu OHHCuHH
O一、从得氧失氧角度分析:氧化反应:得到氧所发生的反应叫氧化反应
还原反应:失去氧所发生的反应叫还原反应
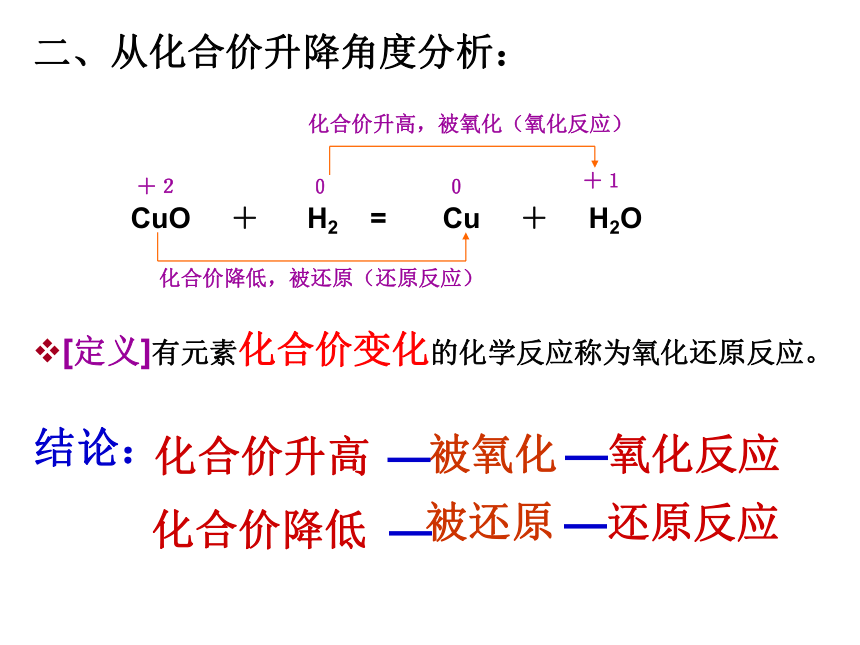
氧化还原反应:氧化还原同时发生的反应叫氧化还原反应判断下列反应是否氧化还原反应1.2CuO+C 2Cu+CO22.Fe2O3+3CO 2Fe+3CO2高温高温3、Fe +CuSO4 = FeSO4 +Cu[问题]以上反应除了包含有得氧失氧的变化之外, 还包含有什么变化?+20化合价降低,被氧化(氧化反应)+30化合价降低+2+4化合价升高0+1化合价升高,被还原(还原反应),被氧化(氧化反应),被还原(还原反应)Fe2O3 + 3CO = 2Fe + 3CO2高温Fe +CuSO4 = FeSO4 +Cu化合价降低化合价升高共同特征:有化合价的升降(变化)+200+1化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 = Cu + H2O[定义]有元素化合价变化的化学反应称为氧化还原反应。二、从化合价升降角度分析:[问题]下列反应是否属于氧化还原反应?
2Na+Cl2 = 2NaCl
2H2+Cl2 = 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
[问题]化合价的升降是什么原因引起的?离子化合物:NaCl 离子键得失电子失电子得电子电子对偏移吸引力强吸引力弱氧化还原反应◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
考考你:下列反应是否属于氧化还原反应?属于四大反应类型的哪一种?(1)Zn + H2SO4== ZnSO4 + H2↑
(2)CaCO3==CaO+CO2↑
(3)CaO + H2O==Ca(OH)2
高温
(4)3C+2Fe2O3==4Fe+3CO2↑
(5)Cl2+H2O==HCl+HClO
(6)2KClO3===2KCl+3O2↑
(7) H2+Cl2 == 2HCl通过观察上述反应,你得到什么结论?△点燃置换反应。氧化还原分解反应。非氧化还原化合反应。非氧化还原置换反应。氧化还原氧化还原分解反应。氧化还原化合反应。氧化还原讨论:试用几种交叉分类法氧化还原反应与基本反应类型的关系1.下列各类反应中,全部是氧化还原反应的是 ( )
A.分解反应 B.化合反应
C.置换反应 D.复分解反应 【课堂练习】C【小结】氧化还原反应标志(判断的标准):化合价的升降 氧化还原反应本质:电子的转移(得失或偏移) 氧化剂:氧化还原反应里得到电子的物质。氧化剂从还原剂处得到电子自身被还原变成还原产物。 还原剂:在氧化还原反应里,失去电子的物质。还原剂失去电子自身被氧化变成氧化产物。 Zn + 2HCl = ZnCl2 + H2MnO2+4HCl浓 MnCl2+Cl2↑+2H2O2KClO3 2KCl+3O2↑三、双线桥法表示氧化还原反应中电子转移的情况:例1:CuO +H2 = Cu + H2O得2e-,化合价降低,被还原失2e-,化合价升高,被氧化重点:(1)双箭号(从反应物指向生成物)
(2)箭号起、止所指为同一种元素
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数) 还原剂: 失去电子,作还原剂,化合价升高,
还原剂被氧化,发生氧化反应
氧化剂:得到电子,作氧化剂,化合价降低,
氧化剂被还原,发生还原反应
用双线桥表示电子转移情况,并指出氧化剂和还原剂1、Fe + CuSO4 = FeSO4 + Cu
2、MnO2 +4HCl(浓)==MnCl2 +Cl2 ↑ +2H2O
3、2H2S + SO2 = 3S + 2H2O
4、3Cu +8HNO3(稀)= 3Cu(NO3)2 + 2NO↑+ 4H2O
⑵用单线桥表示电子转移情况 表示氧化剂和还原剂之间元素的电子转移情况时,将氧化剂中降价元素与还原剂中升价元素用直线连接起来,箭头从还原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法” 重点:(1)单箭号(在反应物之间)
(2)箭号起点为失电子元素,终点为得电子元素
(从还原剂指向氧化剂)
(3)只标转移电子总数,不标得与失。
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应失ne-,化合价升高,被氧化,发生氧化反应氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物氧化性、还原性强弱的比较:已知①2FeCl2+Cl2= 2FeCl3
②2FeCl3+2KI=2FeCl2+2KCl+I2
判断氧化性的强弱:
判断还原性的强弱: Ⅱ.下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl= CaCl2 + CO2↑ + H2O
B. Na2O + H2O = 2NaOH
C. 2KMnO4 = K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl = MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 = Fe3O4
CuSO4·5H2O = CuSO4 + 5H2O
CDE练习2:下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.氧化还原反应中一定有电子的得失
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
E.元素由化合态变为游离态,该元素一定被还原
F. 金属阳离子被还原后,一定得到该元素的单质
G.金属只有还原性,非金属只有氧化性
H.有单质参加的化学反应不一定都是氧化还原反应
I.在氧化还原反应中,一种元素被氧化,则一定有另一种元素被还原。
J.反应中不一定所有元素的化合价都变化。2K2Cr2O7+3C2H6O+8H2SO4=
2K2SO4+2Cr2(SO4)3+3C2H4O2+11H2O (1)判断该反应是不是氧化还原反应_____ (3)若该反应为氧化还原反应,则__ ___ 发生氧化反应, ________发生还原反应是K2Cr2O7C2H6O第1课时课后作业答案1-5:CCCDD 6-10:CBBBD
11-15:BBCDD
16.(1)BE (2)CE (3)F (4)D
17. ②③④⑤ ③ ④第2课时课后作业答案1-5 C C B A A 6-9 D B D D 9.(1)CuO+CO=Cu+CO2 氧化剂__CuO 还原剂_CO_
(2) 2KClO3=2KCl+3O2↑ 氧化剂_KClO3还原剂KClO3
(3 氧化剂SO2 还原剂H2S
10、用双线桥表示出电子的转移方向和数目:
?
3Cu +8HNO3 =3Cu(NO3)2 +2NO +4H2O
?
(1)被氧化的元素是 Cu ,被还原的元素是 N ;
(2)氧化剂是 HNO3 ,还原剂是 Cu ;
(3)发生氧化反应的是 Cu ,发生还原反应的是 HNO3 。
(4)若有5.6L(标准状况)NO生成,则转移的电子的物质的量是 0.75 mol,被还原的硝酸为 0.25 mol。
得到氧,被氧化(发生氧化反应)△ CuO + H2 = Cu + H2O 失去氧,被还原(发生还原反应)Cu OHHCuHH
O一、从得氧失氧角度分析:氧化反应:得到氧所发生的反应叫氧化反应
还原反应:失去氧所发生的反应叫还原反应
氧化还原反应:氧化还原同时发生的反应叫氧化还原反应判断下列反应是否氧化还原反应1.2CuO+C 2Cu+CO22.Fe2O3+3CO 2Fe+3CO2高温高温3、Fe +CuSO4 = FeSO4 +Cu[问题]以上反应除了包含有得氧失氧的变化之外, 还包含有什么变化?+20化合价降低,被氧化(氧化反应)+30化合价降低+2+4化合价升高0+1化合价升高,被还原(还原反应),被氧化(氧化反应),被还原(还原反应)Fe2O3 + 3CO = 2Fe + 3CO2高温Fe +CuSO4 = FeSO4 +Cu化合价降低化合价升高共同特征:有化合价的升降(变化)+200+1化合价降低,被还原(还原反应)化合价升高,被氧化(氧化反应)CuO + H2 = Cu + H2O[定义]有元素化合价变化的化学反应称为氧化还原反应。二、从化合价升降角度分析:[问题]下列反应是否属于氧化还原反应?
2Na+Cl2 = 2NaCl
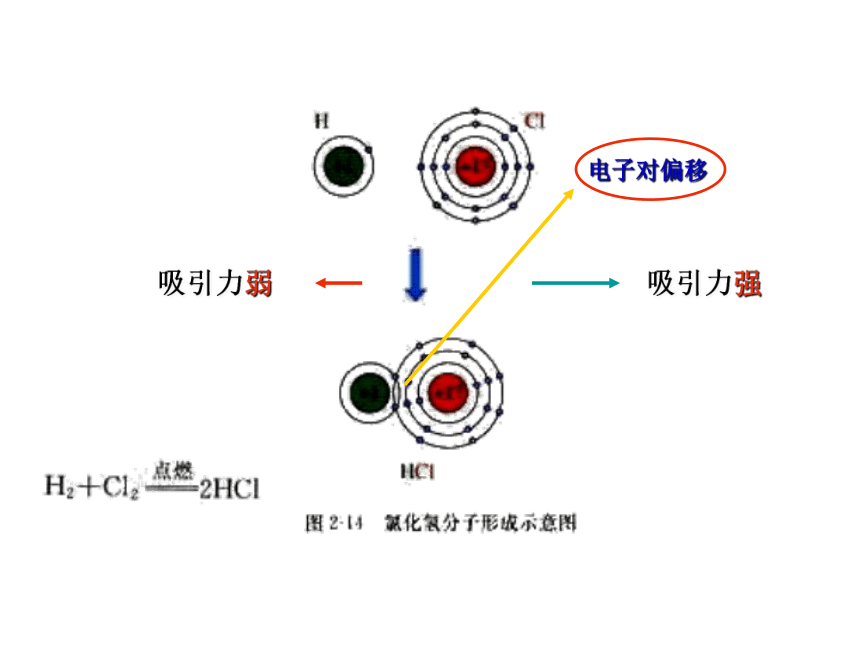
2H2+Cl2 = 2HCl
可见,从化合价升降角度不但可以
分析有得氧失氧的化学反应,也可以分
析没有得氧失氧的化学反应,扩大了概
念的适用范围。
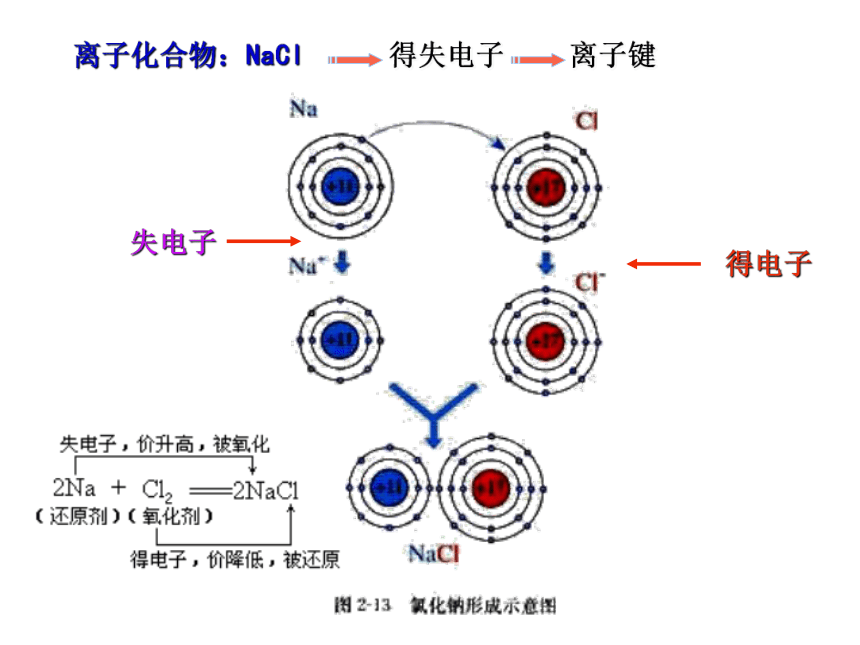
[问题]化合价的升降是什么原因引起的?离子化合物:NaCl 离子键得失电子失电子得电子电子对偏移吸引力强吸引力弱氧化还原反应◆从得氧失氧角度分析
一种物质得到氧被氧化,同时另一种物质失去氧被还原
的化学反应是氧化还原反应。
特点:局限于得氧失氧的反应,是氧化还原反应的表观现象。
◆从化合价升降角度分析
有元素化合价升降的化学反应是氧化还原反应。
特点:可作为氧化还原反应的判断依据。
◆从电子转移角度分析
有电子转移(得失或偏移)的化学反应是氧化还原反应。
特点:揭示氧化还原反应的本质。
考考你:下列反应是否属于氧化还原反应?属于四大反应类型的哪一种?(1)Zn + H2SO4== ZnSO4 + H2↑
(2)CaCO3==CaO+CO2↑
(3)CaO + H2O==Ca(OH)2
高温
(4)3C+2Fe2O3==4Fe+3CO2↑
(5)Cl2+H2O==HCl+HClO
(6)2KClO3===2KCl+3O2↑
(7) H2+Cl2 == 2HCl通过观察上述反应,你得到什么结论?△点燃置换反应。氧化还原分解反应。非氧化还原化合反应。非氧化还原置换反应。氧化还原氧化还原分解反应。氧化还原化合反应。氧化还原讨论:试用几种交叉分类法氧化还原反应与基本反应类型的关系1.下列各类反应中,全部是氧化还原反应的是 ( )
A.分解反应 B.化合反应
C.置换反应 D.复分解反应 【课堂练习】C【小结】氧化还原反应标志(判断的标准):化合价的升降 氧化还原反应本质:电子的转移(得失或偏移) 氧化剂:氧化还原反应里得到电子的物质。氧化剂从还原剂处得到电子自身被还原变成还原产物。 还原剂:在氧化还原反应里,失去电子的物质。还原剂失去电子自身被氧化变成氧化产物。 Zn + 2HCl = ZnCl2 + H2MnO2+4HCl浓 MnCl2+Cl2↑+2H2O2KClO3 2KCl+3O2↑三、双线桥法表示氧化还原反应中电子转移的情况:例1:CuO +H2 = Cu + H2O得2e-,化合价降低,被还原失2e-,化合价升高,被氧化重点:(1)双箭号(从反应物指向生成物)
(2)箭号起、止所指为同一种元素
(3)标出得与失电子及总数(氧化剂得电子总数等于还原剂失电子总数) 还原剂: 失去电子,作还原剂,化合价升高,
还原剂被氧化,发生氧化反应
氧化剂:得到电子,作氧化剂,化合价降低,
氧化剂被还原,发生还原反应
用双线桥表示电子转移情况,并指出氧化剂和还原剂1、Fe + CuSO4 = FeSO4 + Cu
2、MnO2 +4HCl(浓)==MnCl2 +Cl2 ↑ +2H2O
3、2H2S + SO2 = 3S + 2H2O
4、3Cu +8HNO3(稀)= 3Cu(NO3)2 + 2NO↑+ 4H2O
⑵用单线桥表示电子转移情况 表示氧化剂和还原剂之间元素的电子转移情况时,将氧化剂中降价元素与还原剂中升价元素用直线连接起来,箭头从还原剂指向氧化剂,线上标出电子转移总数,称为“单线桥法” 重点:(1)单箭号(在反应物之间)
(2)箭号起点为失电子元素,终点为得电子元素
(从还原剂指向氧化剂)
(3)只标转移电子总数,不标得与失。
氧化剂 + 还原剂 = 还原产物 + 氧化产物
得ne-,化合价降低,被还原,发生还原反应失ne-,化合价升高,被氧化,发生氧化反应氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物氧化性、还原性强弱的比较:已知①2FeCl2+Cl2= 2FeCl3
②2FeCl3+2KI=2FeCl2+2KCl+I2
判断氧化性的强弱:
判断还原性的强弱: Ⅱ.下列反应中属于氧化还原反应的是( )
A CaCO3 + 2HCl= CaCl2 + CO2↑ + H2O
B. Na2O + H2O = 2NaOH
C. 2KMnO4 = K2MnO4 + MnO2 + O2↑
D. MnO2 + 4HCl = MnCl2 + 2H2O + Cl2↑
E. 3Fe + 2O2 = Fe3O4
CuSO4·5H2O = CuSO4 + 5H2O
CDE练习2:下列说法正确的是( )
A.氧化还原反应的本质是元素化合价发生变化
B.氧化还原反应中一定有电子的得失
C.物质所含元素化合价升高的反应是还原反应
D.氧化反应和还原反应是同时发生的
E.元素由化合态变为游离态,该元素一定被还原
F. 金属阳离子被还原后,一定得到该元素的单质
G.金属只有还原性,非金属只有氧化性
H.有单质参加的化学反应不一定都是氧化还原反应
I.在氧化还原反应中,一种元素被氧化,则一定有另一种元素被还原。
J.反应中不一定所有元素的化合价都变化。2K2Cr2O7+3C2H6O+8H2SO4=
2K2SO4+2Cr2(SO4)3+3C2H4O2+11H2O (1)判断该反应是不是氧化还原反应_____ (3)若该反应为氧化还原反应,则__ ___ 发生氧化反应, ________发生还原反应是K2Cr2O7C2H6O第1课时课后作业答案1-5:CCCDD 6-10:CBBBD
11-15:BBCDD
16.(1)BE (2)CE (3)F (4)D
17. ②③④⑤ ③ ④第2课时课后作业答案1-5 C C B A A 6-9 D B D D 9.(1)CuO+CO=Cu+CO2 氧化剂__CuO 还原剂_CO_
(2) 2KClO3=2KCl+3O2↑ 氧化剂_KClO3还原剂KClO3
(3 氧化剂SO2 还原剂H2S
10、用双线桥表示出电子的转移方向和数目:
?
3Cu +8HNO3 =3Cu(NO3)2 +2NO +4H2O
?
(1)被氧化的元素是 Cu ,被还原的元素是 N ;
(2)氧化剂是 HNO3 ,还原剂是 Cu ;
(3)发生氧化反应的是 Cu ,发生还原反应的是 HNO3 。
(4)若有5.6L(标准状况)NO生成,则转移的电子的物质的量是 0.75 mol,被还原的硝酸为 0.25 mol。
