人教版高一化学必修一 4.2 富集在海水中的元素-氯 课件 (共32张ppt)
文档属性
| 名称 | 人教版高一化学必修一 4.2 富集在海水中的元素-氯 课件 (共32张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-20 00:00:00 | ||
图片预览











文档简介
课件32张PPT。富集在海水中的元素--氯2009年9月16日晚,委内瑞拉一辆装载氯气的货车翻车,大量氯气泄露导致100多人中毒,8人死亡 新闻链接新闻链接京沪高速淮安段货车相撞发生液氯泄漏事故,造成较多人员中毒,大面积农作物受损 重庆市天原化工厂发生氯气泄漏爆炸事故。重庆市区15万人被迫连夜进行大转移。新闻链接氯气给大家的初步印象如何? 谈一谈中毒的地方多、人数多、事件多,说明了什么问题? 氯气的用途广泛,生产、生活需要它 有毒!想一想一、氯气的物理性质色、态:密 度: 气 味: 加压易液化,液氯用钢瓶储存黄绿色气体密度比空气大 有刺激性气味,有毒 水溶性: 可溶(1体积水溶解约2体积氯气)闻氯气的方法是:
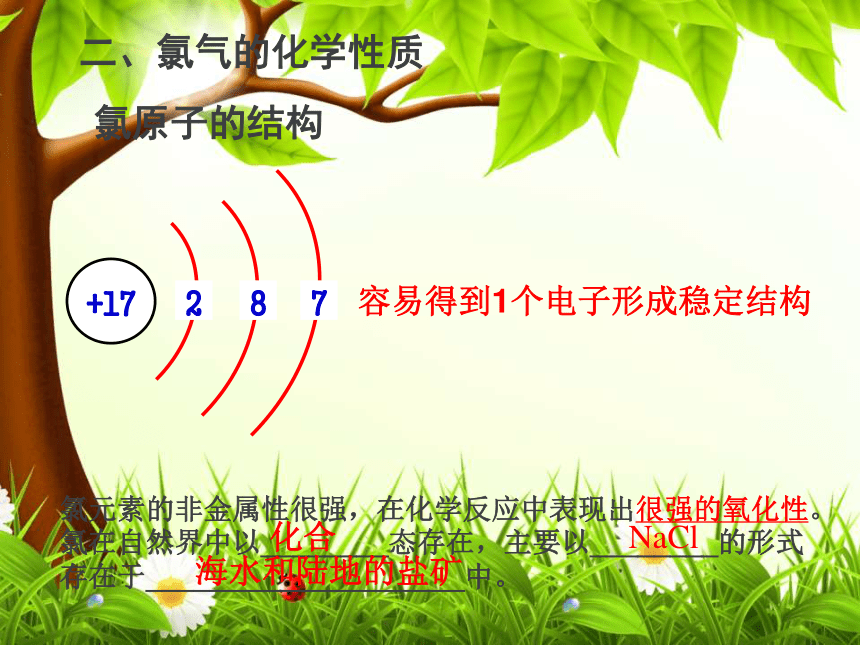
用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。注意: 这是闻各种气体气味的方法二、氯气的化学性质氯原子的结构容易得到1个电子形成稳定结构氯元素的非金属性很强,在化学反应中表现出很强的氧化性。氯在自然界中以________态存在,主要以________的形式存在于____________________中。
化合NaCl海水和陆地的盐矿1、氯气与金属反应剧烈燃烧,火焰呈黄色,产生大量白烟剧烈燃烧,产生棕黄色烟,溶液呈棕色剧烈燃烧,产生棕色的烟,溶液呈蓝绿色钠在氯气中燃烧铁在氯气中燃烧铜在氯气中燃烧
思考:为什么液氯可以保存在钢瓶中?干燥的氯气在常温下不与铁反应,所以可用钢瓶储存氯气。?【小结】氯气的化学性质非常_______,具有很强的_________性,在一定的条件下几乎与所有的金属反应,且与Cu、Fe等变价金属反应时,均生成_____价金属氯化物。活泼氧化性高
2、Cl2与非金属的反应:
H2在Cl2中安静燃烧,发出苍白色火焰,瓶口呈白雾状淡蓝色火焰剧烈反应,发生爆炸,产生白雾H2 + Cl2 === 2HCl点燃 光照 H2 + Cl2 === 2HCl12小组讨论完成:
(1)为什么H2在Cl2中能安静燃烧,而在混合后光照会爆炸?工业上生产盐酸又应该采取哪种反应条件呢?
?
?
纯净的H2在Cl2中燃烧,瞬间只有导管口处的少量氢分子与氯分子化合,产生的少量热能及时散发出去,故可安静燃烧。而光照条件下混合气中大量的氯分子和氢分子迅速化合,短时间内产生大量的热,无法及时散去,使气体体积急剧膨胀,产生爆炸。因而工业上用H2和Cl2合成盐酸应选择点燃做条件而不能用光照作反应条件。(2)通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?是否所有燃烧都要有氧气参加?
(3)“点燃”和“燃烧”有何区别?
燃烧不一定要有O2参加,任何发光发热的剧烈化学反应都称之为燃烧。燃烧都是氧化还原反应。点燃是一种反应条件(加热亦同)。燃烧是一种剧烈的化学反应现象,特点是有发光发热的现象。不要将两者混为一谈。活动探究pH试纸均变红,滴有氯水的pH试纸中间还会变白氯水中含有H+,显酸性,氯水具有漂白性,盐酸无漂白性出现白色浑浊氯水中含有Cl—干燥的有色布条不褪色,湿润的有色布条褪色氯气与水反应生成一种具有漂白性的物质3、Cl2与还原性盐类的反应:
(1)卤素间的置换反应
①将Cl2分别通入KBr溶液和KI溶液中:
?
②将溴水滴入KI溶液中:
思考:为什么可以用湿润的淀粉KI试纸检验Cl2?
?(2)将Cl2通入FeCl2溶液中:
现象:____________________________,
方程式:_____________________________
(3)Cl2分别与Na2SO3溶液和Na2S溶液的反应:
Cl2+Na2S=2NaCl +S ↓
Cl2+2KBr=2KCl+Br2,Cl2+2KI=2KCl+I2Br2+2KI=2KBr+I2溶液由浅绿色变为黄色 2FeCl2+Cl2=2FeCl33、氯气与水反应(次氯酸)次氯酸(HClO):可作漂白剂、用来杀菌消毒等强氧化性不稳定性酸 性酸性较弱,属于一元弱酸4、Cl2与水的反应
探究1:氯气与水反应吗?
探究2:氯水中含有哪些微粒?
①提出假设:氯水中可能含有分子________
离子__________
Cl2、H2O、HClOH+、Cl-、ClO- 结论:氯水中含有的微粒有:
思考1:氯水放久了,其成分会发生哪些变化?发生了什么化学变化?
思考2:氯水应怎样保存?
思考3:氯水与液氯是同一种物质吗?由于2HClO==2HCl+ O 2↑ 氯水最终会变成稀盐酸溶液 棕色瓶,避光保存 光分子:Cl2、H2O、HClO离子:H+、Cl-、ClO- 液氯与氯水的区别?新制氯水与久置氯水的区别?纯净物混合物分子:离子:Cl2 ,HClO,H2OH+,Cl-,ClO-分子:H2O离子:H+,Cl-新制氯水有氧化性,无酸性无漂白性有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置氯水只有Cl2分子只有酸性配制下列溶液时不能用自来水,为什么?
AgNO3(aq)、 Na2SO3 (aq)、 FeCl2 (aq)、 Na2CO3 (aq) 、NaOH (aq) 、 KI (aq)4、氯气与碱的反应Cl2+ 2NaOH = NaCl + NaClO +H2O
次氯酸钠工业生产中和实验室常用氢氧化钠溶液吸收氯气尾气,避免污染。抽取NaOH溶液的针筒内气体颜色消失氯气能与氢氧化钠反应活动探究2Cl2+ 2Ca(OH)2=Ca(ClO)2 + CaCl2 + 2H2O
次氯酸钙漂白粉的生产原理Ca(ClO)2+ CO2+ H2O= CaCO3+ 2HClO漂白粉的使用原理思考1、以上反应说明了次氯酸的酸性怎样? 2、如何保存漂白粉? 3. 家庭中使用漂白粉时,为了加快漂白
速度,提高漂白效果,可加入少量 。
醋酸思考1、为什么用石灰乳与氯气反应制漂白粉,而不用澄清石灰水? 2、次氯酸能杀菌、消毒,为什么不直接用它做漂白剂,而是把它制成漂白粉? 次氯酸盐(NaClO)的性质强氧化性:无论是酸性、碱性、中性溶液中,都有强氧化性。
写出下列离子反应方程式:
(1)次氯酸钠溶液与硫酸亚铁的酸性溶液
(2)次氯酸钠溶液与碘化钾的酸性溶液
(3)次氯酸钠溶液与硫化钠溶液
(4)次氯酸钠溶液与亚硫酸钠溶液
三、Cl2的实验室制法:
1、反应原理: MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
?2、请指出上述反应的氧化剂、还原剂、氧化产物、还原产物,并用双线桥标出电子转移的情况和数目。
[资料卡片]:
(1)反应物中的盐酸一定要用浓盐酸,盐酸一旦变稀,反应将不再进行。
(2)氧化剂MnO2也可用其他氧化剂代替,如KMnO4、KClO3等。
3、反应装置图:四、氯离子(Cl-)的检验:
[实验4-6] 在下列溶液中各滴入几滴AgNO3溶液,观察现象。然后再分别加入少量稀HNO3,观察现象。
思考:检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
小结检验Cl-的方法:
白色沉淀白色沉淀白色沉淀白色沉淀无现象沉淀不溶解沉淀不溶解沉淀不溶解沉淀溶解无现象排除CO32-等的干扰先在被检测的溶液滴入少量稀硝酸使其酸化,再加入滴入硝酸银溶液Ag+ + Cl-==AgCl
Ag+ + Cl-==AgCl
2Ag+ +CO32-=Ag2CO3291—5:BCDBD 6—11:DDDACD
12:小于 ①加热中有部分HCl挥发而损失
②反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2
13:(1)干燥有色布条不褪色,潮湿有色布条褪色
(2)NaOH Cl2 +2NaOH==NaCl +NaClO +H2O
Ca(ClO)2 C 14:(1)HBr KMnO4 Br2
(3)1 5 (4)Cl2 +2HBr== Br2 +2HCl 2:5
15、(1)NaOH刚好消耗完,酚酞未被氧化
(2) Cl2里面的成分具有强氧化性将酚酞氧化,酚酞失效。往最后得到的无色溶液中加入过量的NaOH溶液,若溶液出现红色,则说明酚酞未被氧化,褪色原因为第一种。反之,则说明酚酞被氯水氧化,褪色原因为第二种。
301—5:BCDBD 6—11:DDDACD
12:小于 ①加热中有部分HCl挥发而损失
②反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2
13:(1)干燥有色布条不褪色,潮湿有色布条褪色
(2)NaOH Cl2 +2NaOH==NaCl +NaClO +H2O
Ca(ClO)2 C 14:(1)HBr KMnO4 Br2
(3)1 5 (4)Cl2 +2HBr== Br2 +2HCl 2:5
15、(1)NaOH刚好消耗完,酚酞未被氧化
(2) Cl2里面的成分具有强氧化性将酚酞氧化,酚酞失效。往最后得到的无色溶液中加入过量的NaOH溶液,若溶液出现红色,则说明酚酞未被氧化,褪色原因为第一种。反之,则说明酚酞被氯水氧化,褪色原因为第二种。
311—5:BCDBD 6—11:DDDACD
12:小于 ①加热中有部分HCl挥发而损失
②反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2
13:(1)干燥有色布条不褪色,潮湿有色布条褪色
(2)NaOH Cl2 +2NaOH==NaCl +NaClO +H2O
Ca(ClO)2 C 14:(1)HBr KMnO4 Br2
(3)1 5 (4)Cl2 +2HBr== Br2 +2HCl 2:5
15、(1)NaOH刚好消耗完,酚酞未被氧化
(2) Cl2里面的成分具有强氧化性将酚酞氧化,酚酞失效。往最后得到的无色溶液中加入过量的NaOH溶液,若溶液出现红色,则说明酚酞未被氧化,褪色原因为第一种。反之,则说明酚酞被氯水氧化,褪色原因为第二种。
321—5:BCDBD 6—11:DDDACD
12:小于 ①加热中有部分HCl挥发而损失
②反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2
13:(1)干燥有色布条不褪色,潮湿有色布条褪色
(2)NaOH Cl2 +2NaOH==NaCl +NaClO +H2O
Ca(ClO)2 C 14:(1)HBr KMnO4 Br2
(3)1 5 (4)Cl2 +2HBr== Br2 +2HCl 2:5
15、(1)NaOH刚好消耗完,酚酞未被氧化
(2) Cl2里面的成分具有强氧化性将酚酞氧化,酚酞失效。往最后得到的无色溶液中加入过量的NaOH溶液,若溶液出现红色,则说明酚酞未被氧化,褪色原因为第一种。反之,则说明酚酞被氯水氧化,褪色原因为第二种。
用手轻轻地在瓶口扇动,仅使极少量的氯气飘进鼻孔。注意: 这是闻各种气体气味的方法二、氯气的化学性质氯原子的结构容易得到1个电子形成稳定结构氯元素的非金属性很强,在化学反应中表现出很强的氧化性。氯在自然界中以________态存在,主要以________的形式存在于____________________中。
化合NaCl海水和陆地的盐矿1、氯气与金属反应剧烈燃烧,火焰呈黄色,产生大量白烟剧烈燃烧,产生棕黄色烟,溶液呈棕色剧烈燃烧,产生棕色的烟,溶液呈蓝绿色钠在氯气中燃烧铁在氯气中燃烧铜在氯气中燃烧
思考:为什么液氯可以保存在钢瓶中?干燥的氯气在常温下不与铁反应,所以可用钢瓶储存氯气。?【小结】氯气的化学性质非常_______,具有很强的_________性,在一定的条件下几乎与所有的金属反应,且与Cu、Fe等变价金属反应时,均生成_____价金属氯化物。活泼氧化性高
2、Cl2与非金属的反应:
H2在Cl2中安静燃烧,发出苍白色火焰,瓶口呈白雾状淡蓝色火焰剧烈反应,发生爆炸,产生白雾H2 + Cl2 === 2HCl点燃 光照 H2 + Cl2 === 2HCl12小组讨论完成:
(1)为什么H2在Cl2中能安静燃烧,而在混合后光照会爆炸?工业上生产盐酸又应该采取哪种反应条件呢?
?
?
纯净的H2在Cl2中燃烧,瞬间只有导管口处的少量氢分子与氯分子化合,产生的少量热能及时散发出去,故可安静燃烧。而光照条件下混合气中大量的氯分子和氢分子迅速化合,短时间内产生大量的热,无法及时散去,使气体体积急剧膨胀,产生爆炸。因而工业上用H2和Cl2合成盐酸应选择点燃做条件而不能用光照作反应条件。(2)通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?是否所有燃烧都要有氧气参加?
(3)“点燃”和“燃烧”有何区别?
燃烧不一定要有O2参加,任何发光发热的剧烈化学反应都称之为燃烧。燃烧都是氧化还原反应。点燃是一种反应条件(加热亦同)。燃烧是一种剧烈的化学反应现象,特点是有发光发热的现象。不要将两者混为一谈。活动探究pH试纸均变红,滴有氯水的pH试纸中间还会变白氯水中含有H+,显酸性,氯水具有漂白性,盐酸无漂白性出现白色浑浊氯水中含有Cl—干燥的有色布条不褪色,湿润的有色布条褪色氯气与水反应生成一种具有漂白性的物质3、Cl2与还原性盐类的反应:
(1)卤素间的置换反应
①将Cl2分别通入KBr溶液和KI溶液中:
?
②将溴水滴入KI溶液中:
思考:为什么可以用湿润的淀粉KI试纸检验Cl2?
?(2)将Cl2通入FeCl2溶液中:
现象:____________________________,
方程式:_____________________________
(3)Cl2分别与Na2SO3溶液和Na2S溶液的反应:
Cl2+Na2S=2NaCl +S ↓
Cl2+2KBr=2KCl+Br2,Cl2+2KI=2KCl+I2Br2+2KI=2KBr+I2溶液由浅绿色变为黄色 2FeCl2+Cl2=2FeCl33、氯气与水反应(次氯酸)次氯酸(HClO):可作漂白剂、用来杀菌消毒等强氧化性不稳定性酸 性酸性较弱,属于一元弱酸4、Cl2与水的反应
探究1:氯气与水反应吗?
探究2:氯水中含有哪些微粒?
①提出假设:氯水中可能含有分子________
离子__________
Cl2、H2O、HClOH+、Cl-、ClO- 结论:氯水中含有的微粒有:
思考1:氯水放久了,其成分会发生哪些变化?发生了什么化学变化?
思考2:氯水应怎样保存?
思考3:氯水与液氯是同一种物质吗?由于2HClO==2HCl+ O 2↑ 氯水最终会变成稀盐酸溶液 棕色瓶,避光保存 光分子:Cl2、H2O、HClO离子:H+、Cl-、ClO- 液氯与氯水的区别?新制氯水与久置氯水的区别?纯净物混合物分子:离子:Cl2 ,HClO,H2OH+,Cl-,ClO-分子:H2O离子:H+,Cl-新制氯水有氧化性,无酸性无漂白性有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置氯水只有Cl2分子只有酸性配制下列溶液时不能用自来水,为什么?
AgNO3(aq)、 Na2SO3 (aq)、 FeCl2 (aq)、 Na2CO3 (aq) 、NaOH (aq) 、 KI (aq)4、氯气与碱的反应Cl2+ 2NaOH = NaCl + NaClO +H2O
次氯酸钠工业生产中和实验室常用氢氧化钠溶液吸收氯气尾气,避免污染。抽取NaOH溶液的针筒内气体颜色消失氯气能与氢氧化钠反应活动探究2Cl2+ 2Ca(OH)2=Ca(ClO)2 + CaCl2 + 2H2O
次氯酸钙漂白粉的生产原理Ca(ClO)2+ CO2+ H2O= CaCO3+ 2HClO漂白粉的使用原理思考1、以上反应说明了次氯酸的酸性怎样? 2、如何保存漂白粉? 3. 家庭中使用漂白粉时,为了加快漂白
速度,提高漂白效果,可加入少量 。
醋酸思考1、为什么用石灰乳与氯气反应制漂白粉,而不用澄清石灰水? 2、次氯酸能杀菌、消毒,为什么不直接用它做漂白剂,而是把它制成漂白粉? 次氯酸盐(NaClO)的性质强氧化性:无论是酸性、碱性、中性溶液中,都有强氧化性。
写出下列离子反应方程式:
(1)次氯酸钠溶液与硫酸亚铁的酸性溶液
(2)次氯酸钠溶液与碘化钾的酸性溶液
(3)次氯酸钠溶液与硫化钠溶液
(4)次氯酸钠溶液与亚硫酸钠溶液
三、Cl2的实验室制法:
1、反应原理: MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
?2、请指出上述反应的氧化剂、还原剂、氧化产物、还原产物,并用双线桥标出电子转移的情况和数目。
[资料卡片]:
(1)反应物中的盐酸一定要用浓盐酸,盐酸一旦变稀,反应将不再进行。
(2)氧化剂MnO2也可用其他氧化剂代替,如KMnO4、KClO3等。
3、反应装置图:四、氯离子(Cl-)的检验:
[实验4-6] 在下列溶液中各滴入几滴AgNO3溶液,观察现象。然后再分别加入少量稀HNO3,观察现象。
思考:检验Cl-时,为什么滴加AgNO3溶液后还要再加稀硝酸呢?
小结检验Cl-的方法:
白色沉淀白色沉淀白色沉淀白色沉淀无现象沉淀不溶解沉淀不溶解沉淀不溶解沉淀溶解无现象排除CO32-等的干扰先在被检测的溶液滴入少量稀硝酸使其酸化,再加入滴入硝酸银溶液Ag+ + Cl-==AgCl
Ag+ + Cl-==AgCl
2Ag+ +CO32-=Ag2CO3291—5:BCDBD 6—11:DDDACD
12:小于 ①加热中有部分HCl挥发而损失
②反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2
13:(1)干燥有色布条不褪色,潮湿有色布条褪色
(2)NaOH Cl2 +2NaOH==NaCl +NaClO +H2O
Ca(ClO)2 C 14:(1)HBr KMnO4 Br2
(3)1 5 (4)Cl2 +2HBr== Br2 +2HCl 2:5
15、(1)NaOH刚好消耗完,酚酞未被氧化
(2) Cl2里面的成分具有强氧化性将酚酞氧化,酚酞失效。往最后得到的无色溶液中加入过量的NaOH溶液,若溶液出现红色,则说明酚酞未被氧化,褪色原因为第一种。反之,则说明酚酞被氯水氧化,褪色原因为第二种。
301—5:BCDBD 6—11:DDDACD
12:小于 ①加热中有部分HCl挥发而损失
②反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2
13:(1)干燥有色布条不褪色,潮湿有色布条褪色
(2)NaOH Cl2 +2NaOH==NaCl +NaClO +H2O
Ca(ClO)2 C 14:(1)HBr KMnO4 Br2
(3)1 5 (4)Cl2 +2HBr== Br2 +2HCl 2:5
15、(1)NaOH刚好消耗完,酚酞未被氧化
(2) Cl2里面的成分具有强氧化性将酚酞氧化,酚酞失效。往最后得到的无色溶液中加入过量的NaOH溶液,若溶液出现红色,则说明酚酞未被氧化,褪色原因为第一种。反之,则说明酚酞被氯水氧化,褪色原因为第二种。
311—5:BCDBD 6—11:DDDACD
12:小于 ①加热中有部分HCl挥发而损失
②反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2
13:(1)干燥有色布条不褪色,潮湿有色布条褪色
(2)NaOH Cl2 +2NaOH==NaCl +NaClO +H2O
Ca(ClO)2 C 14:(1)HBr KMnO4 Br2
(3)1 5 (4)Cl2 +2HBr== Br2 +2HCl 2:5
15、(1)NaOH刚好消耗完,酚酞未被氧化
(2) Cl2里面的成分具有强氧化性将酚酞氧化,酚酞失效。往最后得到的无色溶液中加入过量的NaOH溶液,若溶液出现红色,则说明酚酞未被氧化,褪色原因为第一种。反之,则说明酚酞被氯水氧化,褪色原因为第二种。
321—5:BCDBD 6—11:DDDACD
12:小于 ①加热中有部分HCl挥发而损失
②反应中HCl消耗同时生成水,浓盐酸逐渐变为稀盐酸,稀盐酸不能与MnO2反应生成Cl2
13:(1)干燥有色布条不褪色,潮湿有色布条褪色
(2)NaOH Cl2 +2NaOH==NaCl +NaClO +H2O
Ca(ClO)2 C 14:(1)HBr KMnO4 Br2
(3)1 5 (4)Cl2 +2HBr== Br2 +2HCl 2:5
15、(1)NaOH刚好消耗完,酚酞未被氧化
(2) Cl2里面的成分具有强氧化性将酚酞氧化,酚酞失效。往最后得到的无色溶液中加入过量的NaOH溶液,若溶液出现红色,则说明酚酞未被氧化,褪色原因为第一种。反之,则说明酚酞被氯水氧化,褪色原因为第二种。
