人教版高一化学必修一 3.1金属的化学性质 课件 (共25张PPT)
文档属性
| 名称 | 人教版高一化学必修一 3.1金属的化学性质 课件 (共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-20 00:00:00 | ||
图片预览







文档简介
课件25张PPT。第三章
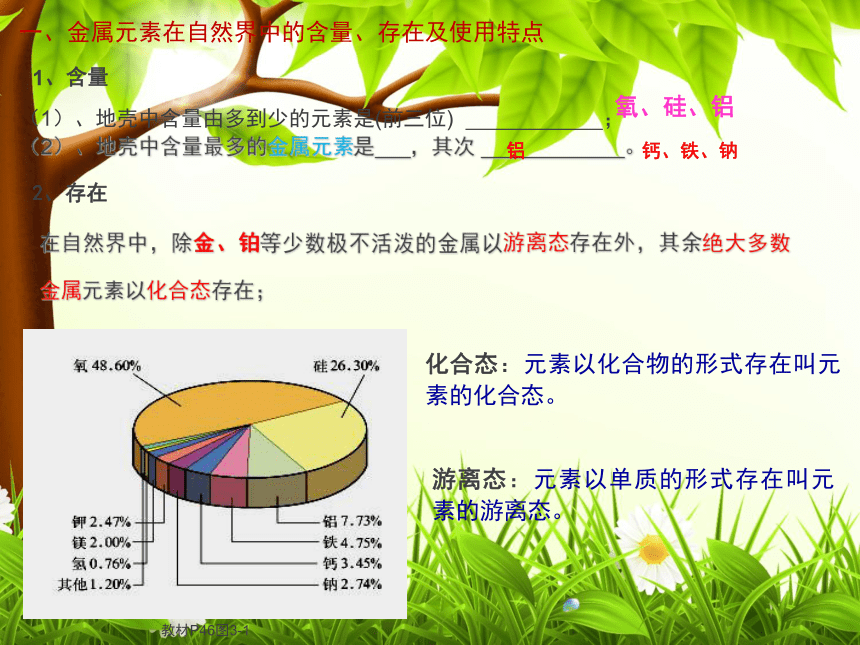
金属及其化合物第一节 金属的化学性质一、金属元素在自然界中的含量、存在及使用特点1、含量在自然界中,除金、铂等少数极不活泼的金属以游离态存在外,其余绝大多数金属元素以化合态存在;化合态:元素以化合物的形式存在叫元素的化合态。游离态:元素以单质的形式存在叫元素的游离态。(1)、地壳中含量由多到少的元素是(前三位) ;
(2)、地壳中含量最多的金属元素是 ,其次 。2、存在氧、硅、铝铝钙、铁、钠 小结:地球上的金属以单质形式存在的是极少数(如 Ag、Pt、Au)。银白色 Ag金黄色 Au以游离态存在于自然界中的金属 常见的矿石赤铁矿
主要成分是Fe2O3黄铁矿
主要成分是FeS2菱铁矿
主要成分是FeCO3铝土矿
主要成分是Al2O3 绝大多数金属是
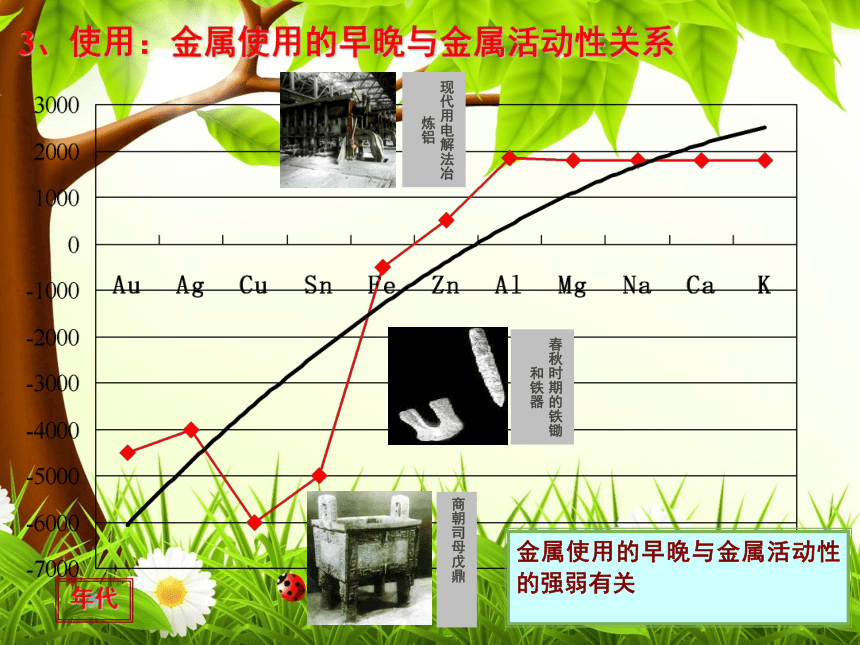
以化合态存在于自然界3、使用:金属使用的早晚与金属活动性关系2、颜色3、良好的导电、导热性。绝大多数金属都是银白色,具有金属光泽,少数金属具有特殊颜色如铜是紫红色,金是金黄色。金属都不透明。4、具有较好的延展性延性:拉成细丝的性质;
展性:压成薄片的性质。1、在常温下的状态除汞是液体外,其他在常温下是固体。二、金属单质的物理性质通性5、密度,熔沸点,硬度差异大; 下列关于金属的叙述中正确的是 ( )
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.常温下所有金属都能与酸反应
D.金属元素在自然界中都是以化合态存在的我理解了B思考与交流2.分析下列照片,写出反应的化学方程式。若是离子反应,写出离子方程式。若是氧化还原反应,标出电子转移的方向和数目,指出氧化剂、还原剂、氧化产物、还原产物等。P46 请标出下列反应的电子转移方向和数目,并指出氧化剂和还原剂。 点燃
2Mg + O2 = 2MgOMg + 2HCl = MgCl2+ H2↑2Al + 3CuSO4= Al2(SO4)3+ 3Cu Cu + 2AgNO3 = Cu(NO3)2 + 2Ag 6e-2e-2e-4e-氧化剂还原剂还原剂氧化剂还原剂氧化剂还原剂氧化剂思考与交流3、画出 Na、Mg、Al 的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系?钠镁铝的原子结构特点:最外层电子少于4个,在反应中容易失去最外层上的电子(使其次外层成为最外层而达到相对稳定结构),表现出较强的还原性。(做还原剂)
三、金属的原子结构特点最外层电子通常都少于4个,在反应中容易失去最外层上的电子(使其次外层成为最外层而达到相对稳定结构),表现出较强的还原性。(做还原剂)
1、与氧气及其他非金属单质反应2、与酸反应3、与盐反应具体表现1、与氧气的反应 结论:钠很活泼,常温下能与氧气反应生成碱性氧化物—氧化钠(Na2O)从煤油中取一小块金属钠,用刀切去一端的外皮,观察实验现象。(一)、金属与非金属的反应(1)、钠与氧气反应物理性质:光亮的银白色、密度比煤油大、质软。*感悟:反应物相同,反应条件不同,产物不同。结论:钠与氧气在点燃或加热的条件下反应生成特殊的氧化物(过氧化物)—过氧化钠: Na2O2 ①常温时4Na + O2 == 2Na2O(白色)②加热或点燃时-1失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原失去4e-,化合价升高,被氧化得到4e-,化合价降低,被还原结论:钠的化学性质很活泼,在常温或加热的条件下都能跟氧气反应。(条件不同,现象不同,产物不同。)不稳定稳定△小结:钠与氧气反应2Na +O2 == Na2O2 (淡黄色)还原剂氧化剂氧化剂还原剂②镁条在氧气中燃烧生成MgO①在常温下,镁与空气里的氧气起反应,生成一层致密而坚固的氧化物薄膜,从而使金属镁失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有一定的抗腐蚀的性能。这也是为什么在点燃镁条前,常用砂纸打磨的原因。
2Mg + O2 == 2MgO (2)、镁与氧气反应(一)、金属与非金属反应现象:镁条在空气中剧烈燃烧,发出耀眼的强光,生成白色粉末状固体。②铝箔在氧气中燃烧生成Al2O3①在常温下,铝与空气里的氧气起反应,生成一层致密而坚固的氧化物薄膜,从而使金属铝失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以铝有一定的抗腐蚀的性能。正因为如此,铝成为一种应用非常广泛的金属材料。
4Al +3O2 == 2Al2O3(3)、铝与氧气反应(一)、金属与非金属反应现象:铝箔在氧气中剧烈燃烧,放出大量的热,发出耀眼的白光,生成白色粉末状固体。 现象:铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着。②铁丝在氧气中燃烧生成Fe3O4(一)、金属与非金属反应①铁与氧气在常温下在潮湿的环境中缓慢反应,生成疏松氧化层—三氧化二铁(红褐色Fe2O3)
4Fe + 3O2 == 2Fe2O3 (铁生锈) (4)、铁与氧气反应现象:铁丝在氧气中剧烈燃烧,发出耀眼的强光,火星四射,放出大量的热,生成黑色固体。(5)铜与氧气反应①在常温条件下不反应
②在加热或点燃的条件下反应生成黑色粉末状固体氧化铜2、与氯气反应(方程式)3、与硫反应(方程式)(一)、金属与非金属的反应我理解了A 1、铝和铁谁更活泼?将一根铝线和一根铁线放 在野外哪个更容易生锈?思考: 铁线更容易生锈。因为铁表面的氧化膜较疏松,不能阻止内部金属继续被氧化。银白色金属钠
(Na) 表面变暗
(生成Na2O) 出现白色固体
(生成NaOH)表面变成溶液 (NaOH潮解)白色粉末状物质
(生成Na2CO3) 白色块状物
(生成Na2CO3·10H2O)与O2反应风化与CO2反应与H2O反应吸H2ONa 长时间暴露空气,最后生成什么物质?①⑤④③②2、金属钠露置在空气中会发生怎样的变化呢?2Na+2H2O==2NaOH+H2↑
4Na+O2==2Na2O
Na2O+H2O==2NaOH
2NaOH+CO2==Na2CO3+H2O
Na2CO3+10H2O==Na2CO3 ·10H2O
Na2CO3 ·10H2O== Na2CO3+10H2O写出相应的化学方程式(6个)
(2)、地壳中含量最多的金属元素是 ,其次 。2、存在氧、硅、铝铝钙、铁、钠 小结:地球上的金属以单质形式存在的是极少数(如 Ag、Pt、Au)。银白色 Ag金黄色 Au以游离态存在于自然界中的金属 常见的矿石赤铁矿
主要成分是Fe2O3黄铁矿
主要成分是FeS2菱铁矿
主要成分是FeCO3铝土矿
主要成分是Al2O3 绝大多数金属是
以化合态存在于自然界3、使用:金属使用的早晚与金属活动性关系2、颜色3、良好的导电、导热性。绝大多数金属都是银白色,具有金属光泽,少数金属具有特殊颜色如铜是紫红色,金是金黄色。金属都不透明。4、具有较好的延展性延性:拉成细丝的性质;
展性:压成薄片的性质。1、在常温下的状态除汞是液体外,其他在常温下是固体。二、金属单质的物理性质通性5、密度,熔沸点,硬度差异大; 下列关于金属的叙述中正确的是 ( )
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.常温下所有金属都能与酸反应
D.金属元素在自然界中都是以化合态存在的我理解了B思考与交流2.分析下列照片,写出反应的化学方程式。若是离子反应,写出离子方程式。若是氧化还原反应,标出电子转移的方向和数目,指出氧化剂、还原剂、氧化产物、还原产物等。P46 请标出下列反应的电子转移方向和数目,并指出氧化剂和还原剂。 点燃
2Mg + O2 = 2MgOMg + 2HCl = MgCl2+ H2↑2Al + 3CuSO4= Al2(SO4)3+ 3Cu Cu + 2AgNO3 = Cu(NO3)2 + 2Ag 6e-2e-2e-4e-氧化剂还原剂还原剂氧化剂还原剂氧化剂还原剂氧化剂思考与交流3、画出 Na、Mg、Al 的原子结构示意图,分析它们的原子结构有什么特点,与金属的化学性质有什么联系?钠镁铝的原子结构特点:最外层电子少于4个,在反应中容易失去最外层上的电子(使其次外层成为最外层而达到相对稳定结构),表现出较强的还原性。(做还原剂)
三、金属的原子结构特点最外层电子通常都少于4个,在反应中容易失去最外层上的电子(使其次外层成为最外层而达到相对稳定结构),表现出较强的还原性。(做还原剂)
1、与氧气及其他非金属单质反应2、与酸反应3、与盐反应具体表现1、与氧气的反应 结论:钠很活泼,常温下能与氧气反应生成碱性氧化物—氧化钠(Na2O)从煤油中取一小块金属钠,用刀切去一端的外皮,观察实验现象。(一)、金属与非金属的反应(1)、钠与氧气反应物理性质:光亮的银白色、密度比煤油大、质软。*感悟:反应物相同,反应条件不同,产物不同。结论:钠与氧气在点燃或加热的条件下反应生成特殊的氧化物(过氧化物)—过氧化钠: Na2O2 ①常温时4Na + O2 == 2Na2O(白色)②加热或点燃时-1失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原失去4e-,化合价升高,被氧化得到4e-,化合价降低,被还原结论:钠的化学性质很活泼,在常温或加热的条件下都能跟氧气反应。(条件不同,现象不同,产物不同。)不稳定稳定△小结:钠与氧气反应2Na +O2 == Na2O2 (淡黄色)还原剂氧化剂氧化剂还原剂②镁条在氧气中燃烧生成MgO①在常温下,镁与空气里的氧气起反应,生成一层致密而坚固的氧化物薄膜,从而使金属镁失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以镁有一定的抗腐蚀的性能。这也是为什么在点燃镁条前,常用砂纸打磨的原因。
2Mg + O2 == 2MgO (2)、镁与氧气反应(一)、金属与非金属反应现象:镁条在空气中剧烈燃烧,发出耀眼的强光,生成白色粉末状固体。②铝箔在氧气中燃烧生成Al2O3①在常温下,铝与空气里的氧气起反应,生成一层致密而坚固的氧化物薄膜,从而使金属铝失去光泽。由于这层氧化物薄膜能阻止金属的继续氧化,所以铝有一定的抗腐蚀的性能。正因为如此,铝成为一种应用非常广泛的金属材料。
4Al +3O2 == 2Al2O3(3)、铝与氧气反应(一)、金属与非金属反应现象:铝箔在氧气中剧烈燃烧,放出大量的热,发出耀眼的白光,生成白色粉末状固体。 现象:铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着。②铁丝在氧气中燃烧生成Fe3O4(一)、金属与非金属反应①铁与氧气在常温下在潮湿的环境中缓慢反应,生成疏松氧化层—三氧化二铁(红褐色Fe2O3)
4Fe + 3O2 == 2Fe2O3 (铁生锈) (4)、铁与氧气反应现象:铁丝在氧气中剧烈燃烧,发出耀眼的强光,火星四射,放出大量的热,生成黑色固体。(5)铜与氧气反应①在常温条件下不反应
②在加热或点燃的条件下反应生成黑色粉末状固体氧化铜2、与氯气反应(方程式)3、与硫反应(方程式)(一)、金属与非金属的反应我理解了A 1、铝和铁谁更活泼?将一根铝线和一根铁线放 在野外哪个更容易生锈?思考: 铁线更容易生锈。因为铁表面的氧化膜较疏松,不能阻止内部金属继续被氧化。银白色金属钠
(Na) 表面变暗
(生成Na2O) 出现白色固体
(生成NaOH)表面变成溶液 (NaOH潮解)白色粉末状物质
(生成Na2CO3) 白色块状物
(生成Na2CO3·10H2O)与O2反应风化与CO2反应与H2O反应吸H2ONa 长时间暴露空气,最后生成什么物质?①⑤④③②2、金属钠露置在空气中会发生怎样的变化呢?2Na+2H2O==2NaOH+H2↑
4Na+O2==2Na2O
Na2O+H2O==2NaOH
2NaOH+CO2==Na2CO3+H2O
Na2CO3+10H2O==Na2CO3 ·10H2O
Na2CO3 ·10H2O== Na2CO3+10H2O写出相应的化学方程式(6个)
