人教版高一化学必修一2.3 氧化还原反应(共28张PPT)
文档属性
| 名称 | 人教版高一化学必修一2.3 氧化还原反应(共28张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-20 00:00:00 | ||
图片预览






文档简介
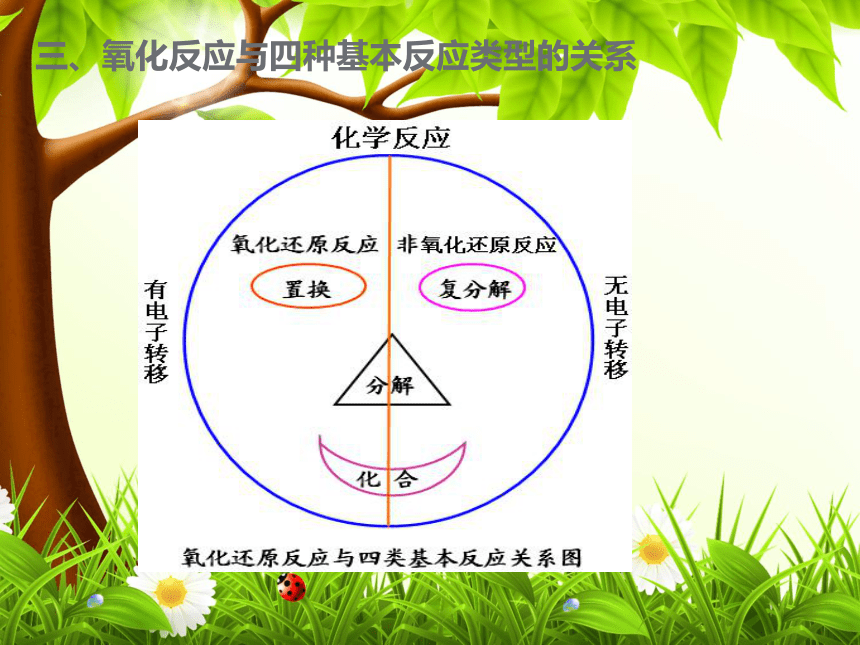
课件28张PPT。氧化还原反应2CuO + C 2Cu + CO2↑高温失去氧,被还原,发生还原反应得到氧,被氧化,发生氧化反应一、从得氧失氧的角度定义:一种物质得到氧元素被氧化,另一种物质失去氧元素被还原的反应叫做氧化还原反应。+20化合价升高,被氧化,发生氧化反应0+4化合价降低,被还原,发生还原反应+10化合价升高,被氧化,发生氧化反应0+2化合价降低,被还原,发生还原反应+20化合价升高,被氧化,发生氧化反应0+1化合价降低,被还原,发生还原反应二、从化合价的角度定义:反应前后化合价发生变化的反应叫做氧化还原反应。
化合价升高——氧化反应
化合价降低——还原反应从氧化还原反应和四种基本反应类型的角度将下列方程式进行分类。
化学反应 反应类型 是否氧化还原
Na+2H2O=NaOH+H2↑
CaCO3==CaO+CO2↑
3Cl2+2Fe==2FeCl3
HCl+NaOH==NaCl+H2O
CO2+H2O==H2CO3
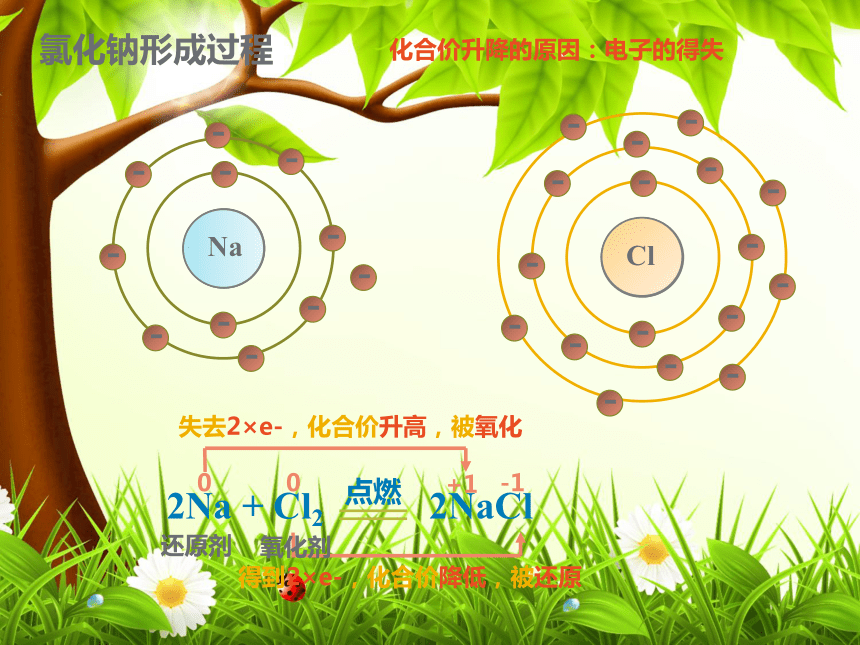
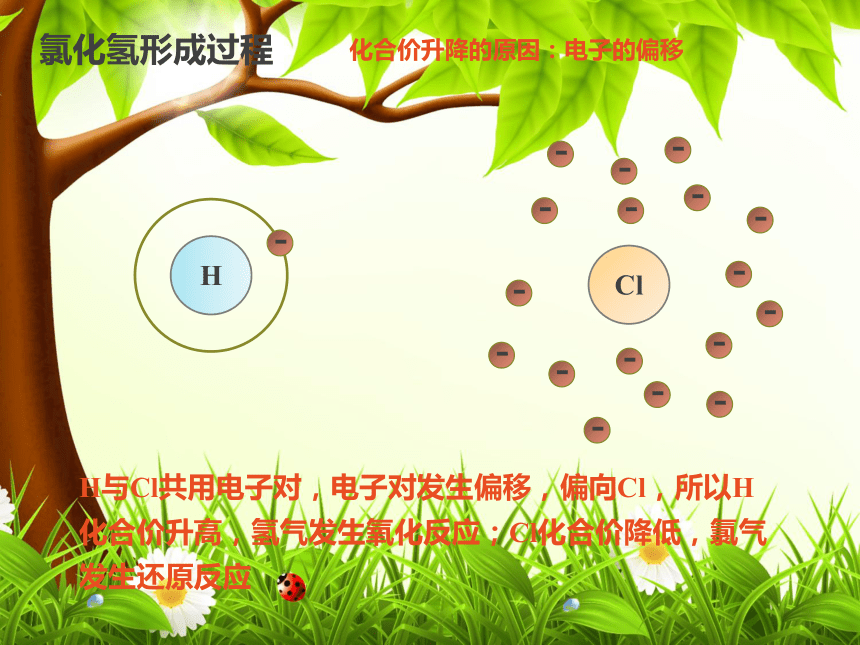
2H2O2 2H2O + O2↑三、氧化反应与四种基本反应类型的关系置换反应是分解反应否化合反应是复分解反应否化合反应否MnO2分解反应是高温三、氧化反应与四种基本反应类型的关系2Na + Cl2 2NaCl点燃0+1化合价升高,被氧化,发生氧化反应0-1化合价降低,被还原,发生还原反应四、氧化还原反应的实质(1)化合价升降的原因是什么?(2)阅读课本P36第3段、第4段,讨论钠和氯气的氧化还原反应的发生过程是怎样的?思考与交流氯化钠形成过程2Na + Cl2 2NaCl点燃0+1失去2×e-,化合价升高,被氧化0-1得到2×e-,化合价降低,被还原还原剂氧化剂化合价升降的原因:电子的得失H2 + Cl2 2HCl点燃0+1化合价升高,被氧化,发生氧化反应0-1化合价降低,被还原,发生还原反应思考与交流阅读课本P36第5段、P37第1段,讨论氢气和氯气的氧化还原反应的发生过程是怎样的,与钠和氯气的反应有何异同?Cl氯化氢形成过程H与Cl共用电子对,电子对发生偏移,偏向Cl,所以H化合价升高,氢气发生氧化反应;Cl化合价降低,氯气发生还原反应化合价升降的原因:电子的偏移化合价 → 电子→被 →发生 反应→作 剂
化合价 → 电子→被 →发生 反应→作 剂
氧化还原反应:
1、特征:元素的化合价有升降
2、本质:有电子转移(电子得失或电子对偏移)归纳总结升高失去氧化氧化还原降低得到还原还原氧化五、氧化还原反应的相关概念氧化剂:反应中 电子的物质,所含元素化合价 ,具有 性。
还原剂:反应中 电子的物质,所含元素化合价 ,具有 性。
氧化产物:还原剂 电子(或所含元素化合价 )后的生成物。
还原产物:氧化剂 电子(或所含元素化合价 )后的生成物。得到降低氧化失去升高还原失去升高得到得到氧化还原反应中各概念间的关系记忆口诀:
升失氧化还原剂,
降得还原氧化剂。1、3NO2+H2O=2HNO3+NO
2、Mg+2HCl=MgCl2+H2↑
3、Fe+CuCl2=Cu+FeCl2
4、Cl2+2NaOH=NaClO+NaCl+H2O
5、2Fe+3Cl2===2FeCl3
6、Fe+S==FeS
7、MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
8、2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2 ↑ +8H2O
9、H2S+H2SO4(浓)=S↓+SO2↑+2H2O点燃△△【思考】结合常见氧化剂和还原剂及氧化还原反应知识分析,元素处于最高价态、最低价态、中间价态时分别具有什么性质? 还原氧化还原氧化S2-、Cl-、Fe、ZnSO2、Cl2、Fe2+KMnO4、F2、Fe3+物质氧化性、还原性相对强弱的比较【方法一】根据氧化还原反应方程式在同一氧化还原反应中,
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物 氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。1、请指出反应Fe+CuCl2 = FeCl2+Cu 中有关物质的氧化性、还原性的强弱
氧化性:CuCl2 FeCl2 还原性:Fe Cu
2、根据反应式:(1)2Fe3++2I-=2Fe2++I2,
(2) Br2+2Fe2+=2Br-+2Fe3+,
可判断出离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I-
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-练习>>B物质氧化性、还原性相对强弱的比较【方法二】根据金属活动顺序表比较判断【例】下列说法中正确的是( )
A、还原性强弱:Fe > Cu> H2
B、氧化性强弱:Cu2+ > H+> Fe3+
C、得电子越多的物质,氧化性越强
D、夺电子越强的物质,氧化性越强D物质氧化性、还原性相对强弱的比较【方法三】根据氧化还原反应的程度氧化性Cl2>S 不同氧化剂和相同还原剂作用时,还原剂化合价升高数值越大,氧化剂的氧化性越强。 Fe + S ? FeS 反应的条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。如
MnO2+4HCl MnCl2+Cl2↑+2H2O
KMnO4+16HCl=== 2KCl+2MnCl2+5Cl2↑+8H2O
氧化性:KMnO4> MnO2物质氧化性、还原性相对强弱的比较【方法四】根据反应的条件及反应的程度常见氧化剂和还原剂物质氧化性、还原性强弱比较:
根据氧化还原反应方程式:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物
根据元素活动性顺序比较:金属单质还原性越强,其对应的金属阳离子氧化性越弱
根据氧化还原反应的程度比较:
4. 根据反应的条件及反应的剧烈程度比较:
MnO2+4HCl MnCl2+Cl2↑+2H2O
KMnO4+16HCl=== 2KCl+2MnCl2+5Cl2↑+8H2O
氧化性:KMnO4> MnO2氧化性Cl2>S点燃
2Fe +3Cl2=== 2FeCl3 Fe + S ? FeS课时训练115.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2 = 2FeCl3+4FeI3
B.Cl2+FeI2 = FeCl2+I2
C.Co2O3+6HCl = 2CoCl2+Cl2↑+3H2O
D.2Fe3++2I- = 2Fe2++I2
A先后规律:氧化还原反应中,强者优先,即氧化性(或还原性)强,优先反应。
双线桥单线桥不交叉规律:同种元素不同价态之间,相邻价态之间不反应,发生反应时化合价向中间靠拢,但不交叉。(只靠近,不交叉,相邻价态不反应)。守恒规律:化合价升高总数=化合价降低总数,即电子得失守恒。氧化还原反应的基本规律:
化合价升高总数=化合价降低总数,即电子得失守恒
价态规律:元素处于最高价只具有氧化性,处于最低价只具有还原性,中间价态既有氧化性又有还原性。
先后规律:氧化还原反应中,强者优先,即氧化性(或还原性)强,优先反应。
不交叉规律:同种元素不同价态之间,相邻价态之间不反应,发生反应时化合价向中间靠拢,但不交叉。(只靠近,不交叉,相邻价态不反应) C+ HNO3(浓) NO2 + CO2 + H2O
氧化还原反应方程式的配平0+5+4+4化合价升高4化合价降低1(1)标:标出反应前后有化合价变化的元素的化合价(2)等:通过求最小公倍数法使化合价升降总数相等(3)定:确定氧化剂、还原剂、氧化产物、还原产物的系数(4)平:观察法配平其他物质的系数(5)查:检查质量、电荷、得失电子是否分别守恒 ×1×411442(1)全部参与氧化还原反应
NH3 + O2 — NO + H2O
(2)部分参与氧化还原反应:
Cu+ HNO3(稀) — Cu(NO3)2+ NO↑+ H2O
(3)一种反应物中多种元素参加反应:
KClO3 KCl+ O2
(4)归中反应
H2S + SO2 — S↓ + H2O
(5)歧化反应:
Na2O2+ H2O— NaOH+ O2↑
(6)离子氧化还原反应方程式的配平
MnO4- + H2O2 + H+ — Mn2+ + O2 ↑+ H2O
氧化还原反应方程式的配平(7)缺项配平
所谓缺项方程式,即某些反应物或生成物的化学式未写出,它们一般为水(H2O)、酸(H+)、碱(OH-)
KI + KIO3+ H2SO4 == I2+ K2SO4+ 。氧化还原反应的计算计算公式:
氧化剂物质的量×变价元素原子个数×化合价的变化值=还原剂物质的量×变价元素原子个数×化合价的变化值例8 用0.1mol/L的Na2SO3溶液30mL ,恰好将
2×10-3mol的XO4- 还原,则元素X在还原产物中的化合价是( )
A.+1 B. +2 C.+3 D. +4
D
化合价升高——氧化反应
化合价降低——还原反应从氧化还原反应和四种基本反应类型的角度将下列方程式进行分类。
化学反应 反应类型 是否氧化还原
Na+2H2O=NaOH+H2↑
CaCO3==CaO+CO2↑
3Cl2+2Fe==2FeCl3
HCl+NaOH==NaCl+H2O
CO2+H2O==H2CO3
2H2O2 2H2O + O2↑三、氧化反应与四种基本反应类型的关系置换反应是分解反应否化合反应是复分解反应否化合反应否MnO2分解反应是高温三、氧化反应与四种基本反应类型的关系2Na + Cl2 2NaCl点燃0+1化合价升高,被氧化,发生氧化反应0-1化合价降低,被还原,发生还原反应四、氧化还原反应的实质(1)化合价升降的原因是什么?(2)阅读课本P36第3段、第4段,讨论钠和氯气的氧化还原反应的发生过程是怎样的?思考与交流氯化钠形成过程2Na + Cl2 2NaCl点燃0+1失去2×e-,化合价升高,被氧化0-1得到2×e-,化合价降低,被还原还原剂氧化剂化合价升降的原因:电子的得失H2 + Cl2 2HCl点燃0+1化合价升高,被氧化,发生氧化反应0-1化合价降低,被还原,发生还原反应思考与交流阅读课本P36第5段、P37第1段,讨论氢气和氯气的氧化还原反应的发生过程是怎样的,与钠和氯气的反应有何异同?Cl氯化氢形成过程H与Cl共用电子对,电子对发生偏移,偏向Cl,所以H化合价升高,氢气发生氧化反应;Cl化合价降低,氯气发生还原反应化合价升降的原因:电子的偏移化合价 → 电子→被 →发生 反应→作 剂
化合价 → 电子→被 →发生 反应→作 剂
氧化还原反应:
1、特征:元素的化合价有升降
2、本质:有电子转移(电子得失或电子对偏移)归纳总结升高失去氧化氧化还原降低得到还原还原氧化五、氧化还原反应的相关概念氧化剂:反应中 电子的物质,所含元素化合价 ,具有 性。
还原剂:反应中 电子的物质,所含元素化合价 ,具有 性。
氧化产物:还原剂 电子(或所含元素化合价 )后的生成物。
还原产物:氧化剂 电子(或所含元素化合价 )后的生成物。得到降低氧化失去升高还原失去升高得到得到氧化还原反应中各概念间的关系记忆口诀:
升失氧化还原剂,
降得还原氧化剂。1、3NO2+H2O=2HNO3+NO
2、Mg+2HCl=MgCl2+H2↑
3、Fe+CuCl2=Cu+FeCl2
4、Cl2+2NaOH=NaClO+NaCl+H2O
5、2Fe+3Cl2===2FeCl3
6、Fe+S==FeS
7、MnO2+4HCl(浓)==MnCl2+Cl2↑+2H2O
8、2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2 ↑ +8H2O
9、H2S+H2SO4(浓)=S↓+SO2↑+2H2O点燃△△【思考】结合常见氧化剂和还原剂及氧化还原反应知识分析,元素处于最高价态、最低价态、中间价态时分别具有什么性质? 还原氧化还原氧化S2-、Cl-、Fe、ZnSO2、Cl2、Fe2+KMnO4、F2、Fe3+物质氧化性、还原性相对强弱的比较【方法一】根据氧化还原反应方程式在同一氧化还原反应中,
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物 氧化剂的氧化性越强,则其对应的还原产物的还原性就越弱;还原剂的还原性越强,则其对应的氧化产物的氧化性就越弱。1、请指出反应Fe+CuCl2 = FeCl2+Cu 中有关物质的氧化性、还原性的强弱
氧化性:CuCl2 FeCl2 还原性:Fe Cu
2、根据反应式:(1)2Fe3++2I-=2Fe2++I2,
(2) Br2+2Fe2+=2Br-+2Fe3+,
可判断出离子的还原性从强到弱的顺序是( )
A.Br-、Fe2+、I-
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-练习>>B物质氧化性、还原性相对强弱的比较【方法二】根据金属活动顺序表比较判断【例】下列说法中正确的是( )
A、还原性强弱:Fe > Cu> H2
B、氧化性强弱:Cu2+ > H+> Fe3+
C、得电子越多的物质,氧化性越强
D、夺电子越强的物质,氧化性越强D物质氧化性、还原性相对强弱的比较【方法三】根据氧化还原反应的程度氧化性Cl2>S 不同氧化剂和相同还原剂作用时,还原剂化合价升高数值越大,氧化剂的氧化性越强。 Fe + S ? FeS 反应的条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强,如是否加热、反应温度高低、有无催化剂和反应物浓度大小等。如
MnO2+4HCl MnCl2+Cl2↑+2H2O
KMnO4+16HCl=== 2KCl+2MnCl2+5Cl2↑+8H2O
氧化性:KMnO4> MnO2物质氧化性、还原性相对强弱的比较【方法四】根据反应的条件及反应的程度常见氧化剂和还原剂物质氧化性、还原性强弱比较:
根据氧化还原反应方程式:氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物
根据元素活动性顺序比较:金属单质还原性越强,其对应的金属阳离子氧化性越弱
根据氧化还原反应的程度比较:
4. 根据反应的条件及反应的剧烈程度比较:
MnO2+4HCl MnCl2+Cl2↑+2H2O
KMnO4+16HCl=== 2KCl+2MnCl2+5Cl2↑+8H2O
氧化性:KMnO4> MnO2氧化性Cl2>S点燃
2Fe +3Cl2=== 2FeCl3 Fe + S ? FeS课时训练115.已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A.3Cl2+6FeI2 = 2FeCl3+4FeI3
B.Cl2+FeI2 = FeCl2+I2
C.Co2O3+6HCl = 2CoCl2+Cl2↑+3H2O
D.2Fe3++2I- = 2Fe2++I2
A先后规律:氧化还原反应中,强者优先,即氧化性(或还原性)强,优先反应。
双线桥单线桥不交叉规律:同种元素不同价态之间,相邻价态之间不反应,发生反应时化合价向中间靠拢,但不交叉。(只靠近,不交叉,相邻价态不反应)。守恒规律:化合价升高总数=化合价降低总数,即电子得失守恒。氧化还原反应的基本规律:
化合价升高总数=化合价降低总数,即电子得失守恒
价态规律:元素处于最高价只具有氧化性,处于最低价只具有还原性,中间价态既有氧化性又有还原性。
先后规律:氧化还原反应中,强者优先,即氧化性(或还原性)强,优先反应。
不交叉规律:同种元素不同价态之间,相邻价态之间不反应,发生反应时化合价向中间靠拢,但不交叉。(只靠近,不交叉,相邻价态不反应) C+ HNO3(浓) NO2 + CO2 + H2O
氧化还原反应方程式的配平0+5+4+4化合价升高4化合价降低1(1)标:标出反应前后有化合价变化的元素的化合价(2)等:通过求最小公倍数法使化合价升降总数相等(3)定:确定氧化剂、还原剂、氧化产物、还原产物的系数(4)平:观察法配平其他物质的系数(5)查:检查质量、电荷、得失电子是否分别守恒 ×1×411442(1)全部参与氧化还原反应
NH3 + O2 — NO + H2O
(2)部分参与氧化还原反应:
Cu+ HNO3(稀) — Cu(NO3)2+ NO↑+ H2O
(3)一种反应物中多种元素参加反应:
KClO3 KCl+ O2
(4)归中反应
H2S + SO2 — S↓ + H2O
(5)歧化反应:
Na2O2+ H2O— NaOH+ O2↑
(6)离子氧化还原反应方程式的配平
MnO4- + H2O2 + H+ — Mn2+ + O2 ↑+ H2O
氧化还原反应方程式的配平(7)缺项配平
所谓缺项方程式,即某些反应物或生成物的化学式未写出,它们一般为水(H2O)、酸(H+)、碱(OH-)
KI + KIO3+ H2SO4 == I2+ K2SO4+ 。氧化还原反应的计算计算公式:
氧化剂物质的量×变价元素原子个数×化合价的变化值=还原剂物质的量×变价元素原子个数×化合价的变化值例8 用0.1mol/L的Na2SO3溶液30mL ,恰好将
2×10-3mol的XO4- 还原,则元素X在还原产物中的化合价是( )
A.+1 B. +2 C.+3 D. +4
D
