人教版高一化学必修一第三章第二节 几种重要的金属化合物(共86张PPT)x
文档属性
| 名称 | 人教版高一化学必修一第三章第二节 几种重要的金属化合物(共86张PPT)x |

|
|
| 格式 | zip | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-20 00:00:00 | ||
图片预览











文档简介
课件86张PPT。§3.2 几种重要的金属化合物
(第1课时)【学习目标】【重点难点】1.掌握过氧化钠的性质。 2.通过探究实验,比较碳酸钠、碳酸氢钠的性质,掌握鉴别它们的方法。1.过氧化钠的性质。2.碳酸钠和碳酸氢钠的性质及其鉴别方法。2.写出下列变化的化学反应方程式。
①金属钠在空气中表面变暗;
②金属钠在空气中加热;
③金属钠投入纯水中;
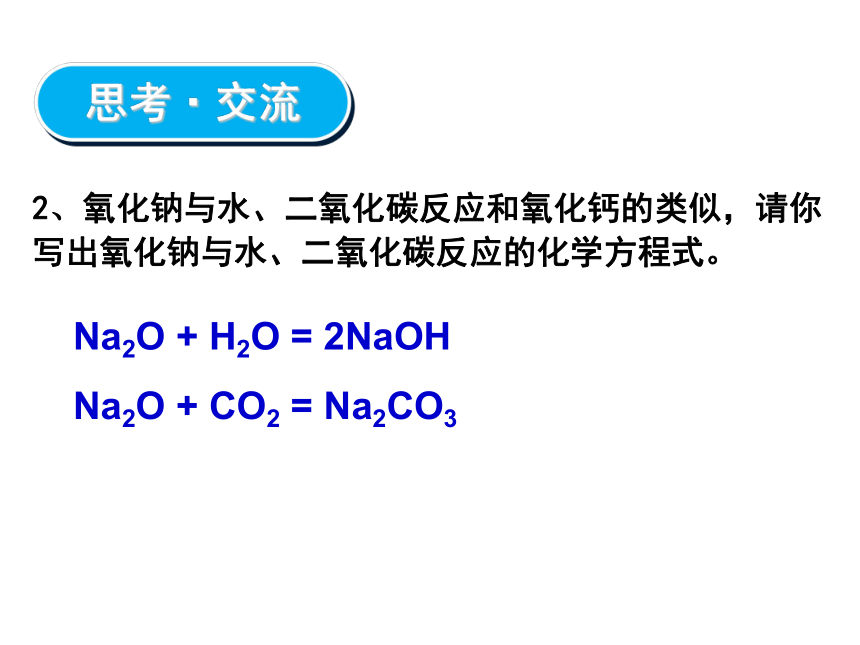
④金属铝投入NaOH溶液中1.为什么多数金属在自然界中都以化合态形式存在?2Na + O2 = Na2O24Na + O2 = 2Na2O2Na + 2H2O = 2NaOH + H2↑2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑复习·回顾§3.2 几种重要的金属化合物一、钠的重要化合物1、氧化钠和过氧化钠1、回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。白色淡黄色固态固态思考·交流Na2O + H2O = 2NaOH2、氧化钠与水、二氧化碳反应和氧化钙的类似,请你写出氧化钠与水、二氧化碳反应的化学方程式。Na2O + CO2 = Na2CO3思考·交流-1 -2 0现象:化学方程式:有气泡产生,反应放热,放出的气体能使带火星的木条复燃,溶液中滴入酚酞先变红后褪色。把水滴入在盛有少量过氧化钠固体的试管中,立即用带火星木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞,有什么现象? 2Na2O2+2H2O=4NaOH+O2↑Na2O2+H2O —NaOH+O2↑失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原既是氧化剂又是还原剂有漂白性过氧化钠与水的反应实验·探究-1 -2 02Na2O2+2H2O=4NaOH+O2↑失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原既是氧化剂又是还原剂有漂白性结论:过氧化钠和水反应放热,生成氧气和氢氧化钠,过氧化钠有强氧化性和漂白性。 2e-2Na2O2+2H2O=4NaOH+O2↑过氧化钠与水的反应实验·探究-1 -2 0化学方程式:2Na2O2+2CO2=2Na2CO3+O2Na2O2+CO2 —O2失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原既是氧化剂又是还原剂过氧化钠与二氧化碳的反应 取一小块脱脂棉与石棉网上,再取半角匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。观察现象。现象:脱脂棉燃烧起来Na2CO3+实验·探究失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原既是氧化剂又是还原剂有漂白性结论:过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠。2e-2Na2O2+2CO2=2Na2CO3+O22Na2O2+2CO2=2Na2CO3+O2-1 -2 0过氧化钠与二氧化碳的反应实验·探究过氧化钠的用途过氧化钠的用途氧化钠与过氧化钠的比较淡黄色固体白色固体 -2价 -1价 常温 点燃 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑ Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2否是Na2O+2HCl=
2NaCl+H2O2Na2O2 + 4HCl =4NaCl +
2H2O + O2 ↑§3.2 几种重要的金属化合物一、钠的重要化合物1、氧化钠和过氧化钠2、碳酸钠和碳酸氢钠碳酸钠和碳酸氢钠 白色粉末白色晶体Na2CO3NaHCO3纯碱、苏打小苏打碳酸钠和碳酸氢钠的性质加水结块;放热加水部分溶解;
感受不到热量变化振荡时间长时可溶解 固体量减少溶液变红(较深)溶液变微红色 Na2CO3比NaHCO3易溶于水, 溶液碱性比NaHCO3溶液强。实验·探究 Na2CO3和NaHCO3的热稳定性烧杯A无变化,烧杯B中溶液变浑浊碳酸钠和碳酸氢钠的性质实验·探究 Na2CO3和NaHCO3与稀盐酸的反应NaHCO3反应更剧烈,产生的气体多。Na2CO3+2HCl =2NaCl+H2O CO2↑HCO3- + H+ = H2O + CO2 ↑CO32- + 2H+ = H2O + CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑碳酸钠和碳酸氢钠都易与酸反应,但是碳酸氢钠与酸反应比碳酸钠更剧烈。Na2CO3 + HCl = NaHCO3 + NaCl
NaHCO3+HCl= NaCl+H2O+CO2↑
CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO2 ↑碳酸钠和碳酸氢钠的性质实验·探究稳定,加热不分解Na2CO3>NaHCO3Na2CO3>NaHCO3CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑碳酸钠与碳酸氢钠的比较Na2CO3NaHCO3/ NaOH △ / HClH2O + CO22NaHCO3=Na2CO3+H2O+CO2↑
NaHCO3 + NaOH= Na2CO3 + H2O
Na2CO3 + H2O + CO2 = 2NaHCO3
Na2CO3 + HCl = NaHCO3 + NaCl碳酸钠和碳酸氢钠的用途§3.2 几种重要的金属化合物一、钠的重要化合物1、氧化钠和过氧化钠2、碳酸钠和碳酸氢钠3、焰色反应3、焰色反应:(2)是元素的性质。(1)金属或它们的化合物在灼烧时使火焰呈现特殊的颜色,这在化学上叫焰色反应。(3)焰色反应是物理变化。实验步骤:①将铂丝放在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。焰色反应现象:钠:黄色 钾:紫色(透过蓝色钴玻璃)实验·探究①本节课学习了哪些知识和学习方法?②通过本节课的学习你有哪些收获或感想?小 结§3.2 几种重要的金属化合物一、钠的重要化合物2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O22NaHCO3=Na2CO3+H2O+CO2↑
NaHCO3 + NaOH= Na2CO3 + H2O
Na2CO3 + H2O + CO2 = 2NaHCO3
Na2CO3 + HCl = NaHCO3 + NaCl焰色反应钠:黄色
钾:紫色
(透过蓝色钴玻璃)Na2CO3 + HCl = NaHCO3 + NaCl
NaHCO3+HCl= NaCl+H2O+CO2↑
CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO2 ↑作 业完成随堂检测§3.2 几种重要的金属化合物
(第2课时 铝及其化合物)
教学设计(一)【学习目标】【重点难点】1.掌握氧化铝及氢氧化铝的化学性质。
2.掌握铝的三角关系。氧化铝及氢氧化铝与强碱溶液的反应及其化学方程式的书写。刚玉(Al2O3)1.铝的氧化物二、铝的重要化合物 通过下面的描述,试归纳氧化铝的物理性质:
(1)铝能与沸水反应,但由于铝锅表面有一层氧化膜,所以可用铝锅来烧水。
(2)加热铝箔时,熔化的铝箔不滴落。
(3)红宝石、蓝宝石的主要成分是氧化铝。(1)物理性质氧化铝难溶于水,熔点很高,也很坚硬。1.铝的氧化物二、铝的重要化合物 Al2O3是一种两性氧化物Al2O3 + 6HCl = 2AlCl3 + 3H2O(2)化学性质既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + OH- = 2AlO2- + H2O1. 氧化铝二、铝的重要化合物 Al2O3 + 6HCl = 2AlCl3 + 3H2O(2)化学性质Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + OH- = 2AlO2- + H2O1. 氧化铝二、铝的重要化合物 1. 氧化铝二、铝的重要化合物 (3)用途①液态Al2O3被电解生成铝和氧气,氧化铝是冶炼铝的主要原料。②耐火材料,可以用来制造耐火坩埚、耐火管和耐高温的实验仪器等。二、铝的重要化合物 2.氢氧化铝AlCl3+3NH3·H2O = Al(OH)3↓+ 3NH4Cl有白色胶状物质生成Al3++3NH3·H2O = Al(OH)3 ↓ + 3NH4+实验·探究Al(OH)3 + 3HCl = AlCl3 + 3H2O 白色胶状物质溶解Al(OH)3 + 3H+ = Al3+ + 3H2O 白色胶状物质溶解Al(OH)3 + NaOH = NaAlO2 + 2H2O Al(OH)3 + OH- = AlO2- + 2H2O 实验·探究(1)物理性质氢氧化铝是白色胶状固体,难溶于水。它能凝聚水中的悬浮物,并能吸附色素,所以可作净水剂。明矾(KAl(SO4)2?12H2O) 净水的原理:
明矾溶于水,生成Al(OH)3胶体,它凝聚水中的悬浮物,吸附色素,使水澄清。二、铝的重要化合物 2.氢氧化铝(2)化学性质①两性Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O Al(OH)3是一种两性氧化物既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氢氧化物二、铝的重要化合物 2.氢氧化铝①两性Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O ②不稳定性这是工业上制取纯净氧化铝的方法(2)化学性质二、铝的重要化合物 2.氢氧化铝(1)如何以氯化铝溶液为原料制取氢氧化铝?AlCl3+3NH3·H2O = Al(OH)3↓+ 3NH4ClAlCl3+3NaOH = Al(OH)3↓+ 3NaClAl(OH)3 + NaOH = NaAlO2 + 2H2O 向氯化铝溶液中加入足量的氨水AlCl3+4NaOH = NaAlO2 + 3NaCl+ 2H2O 思考·交流(2)如何以偏铝酸钠溶液为原料制取氢氧化铝?NaAlO2+CO2+2H2O = Al(OH)3↓+NaHCO3向NaAlO2溶液中通入过量的二氧化碳NaAlO2 + HCl + H2O= Al(OH)3 ↓ + NaClAl(OH)3 + 3HCl = AlCl3 + 3H2O NaAlO2 + 4HCl = AlCl3 + NaCl + 2H2O思考·交流(3)制备AlCl3+3NH3·H2O = Al(OH)3↓+ 3NH4ClNaAlO2+CO2+2H2O = Al(OH)3↓+NaHCO3二、铝的重要化合物 2.氢氧化铝Al(OH)3是医用的胃酸中和剂中的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液酸度降低,起到中和过多胃酸的作用。(4)用途二、铝的重要化合物 2.氢氧化铝①本节课学习了哪些知识和学习方法?②通过本节课的学习你有哪些收获或感想?小 结小 结Al2O3Al(OH)3AlO2-Al3+Al酸OH-足量的OH- 足量的 H+ 酸碱△电解O2弱酸或
适量强酸弱碱或
适量强碱偏铝盐铝盐作 业完成随堂检测§3.2 几种重要的金属化合物
(第2课时)
教学设计(二)【学习目标】【重点难点】1.掌握氧化铝及氢氧化铝的化学性质。
2.掌握铝的三角关系。氧化铝及氢氧化铝碱溶液的反应及其化学方程式的书写。1.氢氧化铝的制备二、铝的重要化合物 药品:Al2(SO4)3溶液、稀盐酸、稀NaOH溶液、氨水、稀醋酸溶液;
仪器:小试管、胶头滴管;
请同学们根据以上仪器和药品,设计制备氢氧化铝的可能方案:①注意分工合作,认真观察、记录现象;
②液体试剂用量一般2mL左右;
③试剂要逐滴加入,边加边振荡;
④制得的氢氧化铝备用。最佳方案:
Al2(SO4)3 + 6NH3·H2O = 2 Al(OH)3↓+ 3(NH4)2SO4
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+1.氢氧化铝二、铝的重要化合物 (1)制备(2)物理性质氢氧化铝是白色胶状固体,难溶于水。它能凝聚水中的悬浮物,并能吸附色素,所以可作净水剂。二、铝的重要化合物 2.氢氧化铝(3)化学性质①两性Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O 二、铝的重要化合物 2.氢氧化铝Al(OH)3是一种两性氧化物既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氢氧化物①两性Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O ②不稳定性这是工业上制取纯净氧化铝的方法(3)化学性质二、铝的重要化合物 2.氢氧化铝Al2O3(1)物理性质氧化铝难溶于水,熔点很高,也很坚硬。2. 氧化铝二、铝的重要化合物 二、铝的重要化合物 药品:氧化铝(α-Al2O3)、稀盐酸、稀NaOH溶液、氨水、稀醋酸溶液;
仪器:小试管、胶头滴管;
请同学们根据以上仪器和药品,验证氧化铝的两性: α-氧化铝,又称纳米氧化铝,纳米氧化铝xz-L14显白色蓬松粉末状态,晶型是α型。粒径是20nm,比表面积≥50m/g。
γ型氧化铝不溶于水,能溶于强酸或强碱溶液,将它加热至1200℃就全部转化为α型氧化铝。(2)化学性质1. 氧化铝二、铝的重要化合物 药品:氧化铝(α-Al2O3)、稀盐酸、稀NaOH溶液、氨水、稀醋酸溶液;
仪器:小试管、胶头滴管;
请同学们根据以上仪器和药品,验证氧化铝的两性:(2)化学性质1. 氧化铝结论:
氧化铝不能被酸或碱溶解。二、铝的重要化合物 (2)化学性质1. 氧化铝毛刷实验药品:氧化铝(γ-Al2O3)、稀盐酸、稀NaOH溶液、氨水、稀醋酸溶液;
仪器:小试管、胶头滴管;
请同学们根据以上仪器和药品,验证氧化铝的两性:结论:
新制备的氧化铝既能溶于酸溶液,又能溶于强碱溶液。Al2O3是一种两性氧化物Al2O3 + 6HCl = 2AlCl3 + 3H2O(2)化学性质既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + OH- = 2AlO2- + H2O2. 氧化铝二、铝的重要化合物 Al2O3 + 6HCl = 2AlCl3 + 3H2O(2)化学性质Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + OH- = 2AlO2- + H2O1. 氧化铝二、铝的重要化合物 工业上用铝土矿制备金属铝的工艺流程图小 结作 业完成随堂检测§3.2 几种重要的金属化合物
(第3课时)【学习目标】【重点难点】1.了解铁的重要化合物的主要性质及应用。
2.掌握检验Fe3+、Fe2+的方法及其相互转化。Fe(OH)3、Fe(OH)2的制备方法。1.铁的氧化物铁 红磁性氧化铁黑色粉末红棕色粉末黑色晶体Fe2O3FeOFe3O4+2+3+2,+3 不溶不溶 不溶碱 性 氧 化 物三、铁的重要化合物 Fe2O3 + 6H+ = 2Fe3+ + 3H2OFeO + 2H+ = Fe2+ + H2OFe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O1.铁的氧化物三、铁的重要化合物 2.铁的氢氧化物——Fe(OH)2、Fe(OH)3 三、铁的重要化合物 产生红褐色的沉淀先有白色的沉淀,迅速变成灰绿色,最后变成红褐色。Fe3+ + 3OH- = Fe(OH)3↓Fe2+ + 2OH- = Fe(OH)2↓4Fe(OH)2+O2+2H2O =4Fe(OH)3 在两只试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后逐滴滴入稀氨水至过量。观察并描述实验现象。制备Fe(OH)2时,采取哪些措施可防止Fe(OH)2被氧化?①配制溶液的蒸馏水加热煮沸,除去O2。
②长胶头滴管伸入到液面以下加入液体。
③溶液表面覆盖植物油(或苯),以隔绝空气。
④将装置密封且将装置内空气空气赶尽。实验·探究【例】下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
__________。①②③⑤三、铁的重要化合物 白色固体红褐色固体Fe(OH)2+2H+ = Fe2++2H2OFe(OH)3+3H+ = Fe3++3H2OFe2++ 2OH- = Fe(OH)2↓Fe3++3OH- = Fe(OH)3 ↓4Fe(OH)2+O2+2H2O = 4Fe(OH)3Fe(OH)2、Fe(OH)3 的比较3.铁盐和亚铁盐三、铁的重要化合物 (1)Fe2+和Fe3+的检验Fe2+和Fe3+的检验有哪些方法?直接观色加KSCN溶液加NaOH溶液 浅绿色 棕黄色白色沉淀迅速变灰绿色最后呈红褐色 立即产生
红褐色沉淀溶液呈红色 ,继续滴加
氯水,溶液呈红色 无现象实验·探究3.铁盐和亚铁盐三、铁的重要化合物 (1)Fe2+和Fe3+的检验(2)Fe2+和Fe3+的相互转化在盛有氯化铁溶液的试管中,加入少量铁粉,振荡,充分反应后,滴加几滴KSCN溶液,有什么现象?再加几滴氯水又发生什么变化?溶液由黄色变为淡绿色,加KSCN溶液没有明显变化,加氯水后溶液变为红色。2FeCl3+Fe = 3FeCl2
2FeCl2+Cl2 = 2FeCl3 Fe2+ Fe3+Cl2、H2O2、KMnO4Fe、Cu实验·探究思考·交流配制及保存FeSO4溶液时,需注意什么?在溶液中加入少量铁粉,防止Fe2+被氧化成Fe3+。①本节课学习了哪些知识和学习方法?②通过本节课的学习你有哪些收获或感想?小 结小 结Fe2+Fe3+Fe强氧化剂弱氧化剂强氧化剂弱还原剂强氧化剂:
弱氧化剂:强还原剂:
弱还原剂:强还原剂强还原剂Cl2、O2、Br2、HNO3、H2O2、KMnO4(H+)等H+ 、Cu2+ 、S 、 Fe3+等Al、Zn、H2、C、CO等Fe、Cu、S2-、SO32-、I-等作 业完成随堂检测
(第1课时)【学习目标】【重点难点】1.掌握过氧化钠的性质。 2.通过探究实验,比较碳酸钠、碳酸氢钠的性质,掌握鉴别它们的方法。1.过氧化钠的性质。2.碳酸钠和碳酸氢钠的性质及其鉴别方法。2.写出下列变化的化学反应方程式。
①金属钠在空气中表面变暗;
②金属钠在空气中加热;
③金属钠投入纯水中;
④金属铝投入NaOH溶液中1.为什么多数金属在自然界中都以化合态形式存在?2Na + O2 = Na2O24Na + O2 = 2Na2O2Na + 2H2O = 2NaOH + H2↑2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑复习·回顾§3.2 几种重要的金属化合物一、钠的重要化合物1、氧化钠和过氧化钠1、回忆前面做过的实验,描述氧化钠和过氧化钠的颜色、状态。白色淡黄色固态固态思考·交流Na2O + H2O = 2NaOH2、氧化钠与水、二氧化碳反应和氧化钙的类似,请你写出氧化钠与水、二氧化碳反应的化学方程式。Na2O + CO2 = Na2CO3思考·交流-1 -2 0现象:化学方程式:有气泡产生,反应放热,放出的气体能使带火星的木条复燃,溶液中滴入酚酞先变红后褪色。把水滴入在盛有少量过氧化钠固体的试管中,立即用带火星木条放在试管口,检验生成的气体。用手轻轻摸一摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞,有什么现象? 2Na2O2+2H2O=4NaOH+O2↑Na2O2+H2O —NaOH+O2↑失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原既是氧化剂又是还原剂有漂白性过氧化钠与水的反应实验·探究-1 -2 02Na2O2+2H2O=4NaOH+O2↑失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原既是氧化剂又是还原剂有漂白性结论:过氧化钠和水反应放热,生成氧气和氢氧化钠,过氧化钠有强氧化性和漂白性。 2e-2Na2O2+2H2O=4NaOH+O2↑过氧化钠与水的反应实验·探究-1 -2 0化学方程式:2Na2O2+2CO2=2Na2CO3+O2Na2O2+CO2 —O2失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原既是氧化剂又是还原剂过氧化钠与二氧化碳的反应 取一小块脱脂棉与石棉网上,再取半角匙过氧化钠粉末至于脱脂棉上,小心包裹后,向包有过氧化钠的脱脂棉吹气。观察现象。现象:脱脂棉燃烧起来Na2CO3+实验·探究失去2e-,化合价升高,被氧化得到2e-,化合价降低,被还原既是氧化剂又是还原剂有漂白性结论:过氧化钠和二氧化碳反应放热,生成氧气和碳酸钠。2e-2Na2O2+2CO2=2Na2CO3+O22Na2O2+2CO2=2Na2CO3+O2-1 -2 0过氧化钠与二氧化碳的反应实验·探究过氧化钠的用途过氧化钠的用途氧化钠与过氧化钠的比较淡黄色固体白色固体 -2价 -1价 常温 点燃 Na2O+H2O=2NaOH 2Na2O2+2H2O=4NaOH+O2↑ Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2否是Na2O+2HCl=
2NaCl+H2O2Na2O2 + 4HCl =4NaCl +
2H2O + O2 ↑§3.2 几种重要的金属化合物一、钠的重要化合物1、氧化钠和过氧化钠2、碳酸钠和碳酸氢钠碳酸钠和碳酸氢钠 白色粉末白色晶体Na2CO3NaHCO3纯碱、苏打小苏打碳酸钠和碳酸氢钠的性质加水结块;放热加水部分溶解;
感受不到热量变化振荡时间长时可溶解 固体量减少溶液变红(较深)溶液变微红色 Na2CO3比NaHCO3易溶于水, 溶液碱性比NaHCO3溶液强。实验·探究 Na2CO3和NaHCO3的热稳定性烧杯A无变化,烧杯B中溶液变浑浊碳酸钠和碳酸氢钠的性质实验·探究 Na2CO3和NaHCO3与稀盐酸的反应NaHCO3反应更剧烈,产生的气体多。Na2CO3+2HCl =2NaCl+H2O CO2↑HCO3- + H+ = H2O + CO2 ↑CO32- + 2H+ = H2O + CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑碳酸钠和碳酸氢钠都易与酸反应,但是碳酸氢钠与酸反应比碳酸钠更剧烈。Na2CO3 + HCl = NaHCO3 + NaCl
NaHCO3+HCl= NaCl+H2O+CO2↑
CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO2 ↑碳酸钠和碳酸氢钠的性质实验·探究稳定,加热不分解Na2CO3>NaHCO3Na2CO3>NaHCO3CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑碳酸钠与碳酸氢钠的比较Na2CO3NaHCO3/ NaOH △ / HClH2O + CO22NaHCO3=Na2CO3+H2O+CO2↑
NaHCO3 + NaOH= Na2CO3 + H2O
Na2CO3 + H2O + CO2 = 2NaHCO3
Na2CO3 + HCl = NaHCO3 + NaCl碳酸钠和碳酸氢钠的用途§3.2 几种重要的金属化合物一、钠的重要化合物1、氧化钠和过氧化钠2、碳酸钠和碳酸氢钠3、焰色反应3、焰色反应:(2)是元素的性质。(1)金属或它们的化合物在灼烧时使火焰呈现特殊的颜色,这在化学上叫焰色反应。(3)焰色反应是物理变化。实验步骤:①将铂丝放在酒精灯外焰上灼烧至火焰颜色与原来相同;
②用铂丝蘸取待测碳酸钠溶液放在外焰上灼烧,观察火焰颜色;
③用盐酸洗净铂丝,在外焰上灼烧至火焰无色后,再蘸取碳酸钾溶液在外焰上灼烧,透过蓝色的钴玻璃观察火焰的颜色。焰色反应现象:钠:黄色 钾:紫色(透过蓝色钴玻璃)实验·探究①本节课学习了哪些知识和学习方法?②通过本节课的学习你有哪些收获或感想?小 结§3.2 几种重要的金属化合物一、钠的重要化合物2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2CO2=2Na2CO3+O22NaHCO3=Na2CO3+H2O+CO2↑
NaHCO3 + NaOH= Na2CO3 + H2O
Na2CO3 + H2O + CO2 = 2NaHCO3
Na2CO3 + HCl = NaHCO3 + NaCl焰色反应钠:黄色
钾:紫色
(透过蓝色钴玻璃)Na2CO3 + HCl = NaHCO3 + NaCl
NaHCO3+HCl= NaCl+H2O+CO2↑
CO32- + H+ = HCO3-
HCO3- + H+ = H2O + CO2 ↑作 业完成随堂检测§3.2 几种重要的金属化合物
(第2课时 铝及其化合物)
教学设计(一)【学习目标】【重点难点】1.掌握氧化铝及氢氧化铝的化学性质。
2.掌握铝的三角关系。氧化铝及氢氧化铝与强碱溶液的反应及其化学方程式的书写。刚玉(Al2O3)1.铝的氧化物二、铝的重要化合物 通过下面的描述,试归纳氧化铝的物理性质:
(1)铝能与沸水反应,但由于铝锅表面有一层氧化膜,所以可用铝锅来烧水。
(2)加热铝箔时,熔化的铝箔不滴落。
(3)红宝石、蓝宝石的主要成分是氧化铝。(1)物理性质氧化铝难溶于水,熔点很高,也很坚硬。1.铝的氧化物二、铝的重要化合物 Al2O3是一种两性氧化物Al2O3 + 6HCl = 2AlCl3 + 3H2O(2)化学性质既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + OH- = 2AlO2- + H2O1. 氧化铝二、铝的重要化合物 Al2O3 + 6HCl = 2AlCl3 + 3H2O(2)化学性质Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + OH- = 2AlO2- + H2O1. 氧化铝二、铝的重要化合物 1. 氧化铝二、铝的重要化合物 (3)用途①液态Al2O3被电解生成铝和氧气,氧化铝是冶炼铝的主要原料。②耐火材料,可以用来制造耐火坩埚、耐火管和耐高温的实验仪器等。二、铝的重要化合物 2.氢氧化铝AlCl3+3NH3·H2O = Al(OH)3↓+ 3NH4Cl有白色胶状物质生成Al3++3NH3·H2O = Al(OH)3 ↓ + 3NH4+实验·探究Al(OH)3 + 3HCl = AlCl3 + 3H2O 白色胶状物质溶解Al(OH)3 + 3H+ = Al3+ + 3H2O 白色胶状物质溶解Al(OH)3 + NaOH = NaAlO2 + 2H2O Al(OH)3 + OH- = AlO2- + 2H2O 实验·探究(1)物理性质氢氧化铝是白色胶状固体,难溶于水。它能凝聚水中的悬浮物,并能吸附色素,所以可作净水剂。明矾(KAl(SO4)2?12H2O) 净水的原理:
明矾溶于水,生成Al(OH)3胶体,它凝聚水中的悬浮物,吸附色素,使水澄清。二、铝的重要化合物 2.氢氧化铝(2)化学性质①两性Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O Al(OH)3是一种两性氧化物既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氢氧化物二、铝的重要化合物 2.氢氧化铝①两性Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O ②不稳定性这是工业上制取纯净氧化铝的方法(2)化学性质二、铝的重要化合物 2.氢氧化铝(1)如何以氯化铝溶液为原料制取氢氧化铝?AlCl3+3NH3·H2O = Al(OH)3↓+ 3NH4ClAlCl3+3NaOH = Al(OH)3↓+ 3NaClAl(OH)3 + NaOH = NaAlO2 + 2H2O 向氯化铝溶液中加入足量的氨水AlCl3+4NaOH = NaAlO2 + 3NaCl+ 2H2O 思考·交流(2)如何以偏铝酸钠溶液为原料制取氢氧化铝?NaAlO2+CO2+2H2O = Al(OH)3↓+NaHCO3向NaAlO2溶液中通入过量的二氧化碳NaAlO2 + HCl + H2O= Al(OH)3 ↓ + NaClAl(OH)3 + 3HCl = AlCl3 + 3H2O NaAlO2 + 4HCl = AlCl3 + NaCl + 2H2O思考·交流(3)制备AlCl3+3NH3·H2O = Al(OH)3↓+ 3NH4ClNaAlO2+CO2+2H2O = Al(OH)3↓+NaHCO3二、铝的重要化合物 2.氢氧化铝Al(OH)3是医用的胃酸中和剂中的一种,它的碱性不强,不至于对胃壁产生强烈的刺激或腐蚀作用,但却可以与酸反应,使胃液酸度降低,起到中和过多胃酸的作用。(4)用途二、铝的重要化合物 2.氢氧化铝①本节课学习了哪些知识和学习方法?②通过本节课的学习你有哪些收获或感想?小 结小 结Al2O3Al(OH)3AlO2-Al3+Al酸OH-足量的OH- 足量的 H+ 酸碱△电解O2弱酸或
适量强酸弱碱或
适量强碱偏铝盐铝盐作 业完成随堂检测§3.2 几种重要的金属化合物
(第2课时)
教学设计(二)【学习目标】【重点难点】1.掌握氧化铝及氢氧化铝的化学性质。
2.掌握铝的三角关系。氧化铝及氢氧化铝碱溶液的反应及其化学方程式的书写。1.氢氧化铝的制备二、铝的重要化合物 药品:Al2(SO4)3溶液、稀盐酸、稀NaOH溶液、氨水、稀醋酸溶液;
仪器:小试管、胶头滴管;
请同学们根据以上仪器和药品,设计制备氢氧化铝的可能方案:①注意分工合作,认真观察、记录现象;
②液体试剂用量一般2mL左右;
③试剂要逐滴加入,边加边振荡;
④制得的氢氧化铝备用。最佳方案:
Al2(SO4)3 + 6NH3·H2O = 2 Al(OH)3↓+ 3(NH4)2SO4
Al3+ + 3NH3·H2O = Al(OH)3↓+ 3NH4+1.氢氧化铝二、铝的重要化合物 (1)制备(2)物理性质氢氧化铝是白色胶状固体,难溶于水。它能凝聚水中的悬浮物,并能吸附色素,所以可作净水剂。二、铝的重要化合物 2.氢氧化铝(3)化学性质①两性Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O 二、铝的重要化合物 2.氢氧化铝Al(OH)3是一种两性氧化物既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氢氧化物①两性Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + OH- = AlO2- + 2H2O ②不稳定性这是工业上制取纯净氧化铝的方法(3)化学性质二、铝的重要化合物 2.氢氧化铝Al2O3(1)物理性质氧化铝难溶于水,熔点很高,也很坚硬。2. 氧化铝二、铝的重要化合物 二、铝的重要化合物 药品:氧化铝(α-Al2O3)、稀盐酸、稀NaOH溶液、氨水、稀醋酸溶液;
仪器:小试管、胶头滴管;
请同学们根据以上仪器和药品,验证氧化铝的两性: α-氧化铝,又称纳米氧化铝,纳米氧化铝xz-L14显白色蓬松粉末状态,晶型是α型。粒径是20nm,比表面积≥50m/g。
γ型氧化铝不溶于水,能溶于强酸或强碱溶液,将它加热至1200℃就全部转化为α型氧化铝。(2)化学性质1. 氧化铝二、铝的重要化合物 药品:氧化铝(α-Al2O3)、稀盐酸、稀NaOH溶液、氨水、稀醋酸溶液;
仪器:小试管、胶头滴管;
请同学们根据以上仪器和药品,验证氧化铝的两性:(2)化学性质1. 氧化铝结论:
氧化铝不能被酸或碱溶解。二、铝的重要化合物 (2)化学性质1. 氧化铝毛刷实验药品:氧化铝(γ-Al2O3)、稀盐酸、稀NaOH溶液、氨水、稀醋酸溶液;
仪器:小试管、胶头滴管;
请同学们根据以上仪器和药品,验证氧化铝的两性:结论:
新制备的氧化铝既能溶于酸溶液,又能溶于强碱溶液。Al2O3是一种两性氧化物Al2O3 + 6HCl = 2AlCl3 + 3H2O(2)化学性质既能与酸反应生成盐和水,又能与碱反应生成盐和水的金属氧化物Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + OH- = 2AlO2- + H2O2. 氧化铝二、铝的重要化合物 Al2O3 + 6HCl = 2AlCl3 + 3H2O(2)化学性质Al2O3 + 2NaOH = 2NaAlO2 + H2OAl2O3 + 6H+ = 2Al3+ + 3H2OAl2O3 + OH- = 2AlO2- + H2O1. 氧化铝二、铝的重要化合物 工业上用铝土矿制备金属铝的工艺流程图小 结作 业完成随堂检测§3.2 几种重要的金属化合物
(第3课时)【学习目标】【重点难点】1.了解铁的重要化合物的主要性质及应用。
2.掌握检验Fe3+、Fe2+的方法及其相互转化。Fe(OH)3、Fe(OH)2的制备方法。1.铁的氧化物铁 红磁性氧化铁黑色粉末红棕色粉末黑色晶体Fe2O3FeOFe3O4+2+3+2,+3 不溶不溶 不溶碱 性 氧 化 物三、铁的重要化合物 Fe2O3 + 6H+ = 2Fe3+ + 3H2OFeO + 2H+ = Fe2+ + H2OFe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O1.铁的氧化物三、铁的重要化合物 2.铁的氢氧化物——Fe(OH)2、Fe(OH)3 三、铁的重要化合物 产生红褐色的沉淀先有白色的沉淀,迅速变成灰绿色,最后变成红褐色。Fe3+ + 3OH- = Fe(OH)3↓Fe2+ + 2OH- = Fe(OH)2↓4Fe(OH)2+O2+2H2O =4Fe(OH)3 在两只试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后逐滴滴入稀氨水至过量。观察并描述实验现象。制备Fe(OH)2时,采取哪些措施可防止Fe(OH)2被氧化?①配制溶液的蒸馏水加热煮沸,除去O2。
②长胶头滴管伸入到液面以下加入液体。
③溶液表面覆盖植物油(或苯),以隔绝空气。
④将装置密封且将装置内空气空气赶尽。实验·探究【例】下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
__________。①②③⑤三、铁的重要化合物 白色固体红褐色固体Fe(OH)2+2H+ = Fe2++2H2OFe(OH)3+3H+ = Fe3++3H2OFe2++ 2OH- = Fe(OH)2↓Fe3++3OH- = Fe(OH)3 ↓4Fe(OH)2+O2+2H2O = 4Fe(OH)3Fe(OH)2、Fe(OH)3 的比较3.铁盐和亚铁盐三、铁的重要化合物 (1)Fe2+和Fe3+的检验Fe2+和Fe3+的检验有哪些方法?直接观色加KSCN溶液加NaOH溶液 浅绿色 棕黄色白色沉淀迅速变灰绿色最后呈红褐色 立即产生
红褐色沉淀溶液呈红色 ,继续滴加
氯水,溶液呈红色 无现象实验·探究3.铁盐和亚铁盐三、铁的重要化合物 (1)Fe2+和Fe3+的检验(2)Fe2+和Fe3+的相互转化在盛有氯化铁溶液的试管中,加入少量铁粉,振荡,充分反应后,滴加几滴KSCN溶液,有什么现象?再加几滴氯水又发生什么变化?溶液由黄色变为淡绿色,加KSCN溶液没有明显变化,加氯水后溶液变为红色。2FeCl3+Fe = 3FeCl2
2FeCl2+Cl2 = 2FeCl3 Fe2+ Fe3+Cl2、H2O2、KMnO4Fe、Cu实验·探究思考·交流配制及保存FeSO4溶液时,需注意什么?在溶液中加入少量铁粉,防止Fe2+被氧化成Fe3+。①本节课学习了哪些知识和学习方法?②通过本节课的学习你有哪些收获或感想?小 结小 结Fe2+Fe3+Fe强氧化剂弱氧化剂强氧化剂弱还原剂强氧化剂:
弱氧化剂:强还原剂:
弱还原剂:强还原剂强还原剂Cl2、O2、Br2、HNO3、H2O2、KMnO4(H+)等H+ 、Cu2+ 、S 、 Fe3+等Al、Zn、H2、C、CO等Fe、Cu、S2-、SO32-、I-等作 业完成随堂检测
