高中化学人教必修一 4.2 富集在海水中的元素--氯 课件 (共22张PPT)
文档属性
| 名称 | 高中化学人教必修一 4.2 富集在海水中的元素--氯 课件 (共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 560.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-21 00:00:00 | ||
图片预览






文档简介
课件22张PPT。 第四章
非金属及其化合物 第二节
富集在海水中的元素—氯大海有几十种化学元素,蕴藏着丰富的化学资源。
大部分以盐的形式存在,氯是最重要的成盐元素。海洋中含盐3%,如果将海水中的盐结晶后平铺于陆地上,地球将增高150米以NaCl为主要成分的食盐,至今仍是人类惟一必须的食用盐。
新疆盐湖
长芦盐场
(100)
莺歌盐场
(30) 资源开发利用案例京沪高速公路氯气泄漏事件 新华网报道:2005年3月29日,京沪高速公路淮安段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : ”一股黄绿色的气体就像探照灯光一样,‘唰’地射向高空,足有5米高,并有刺鼻的气味,眼睛也熏得有些睁不开 。”
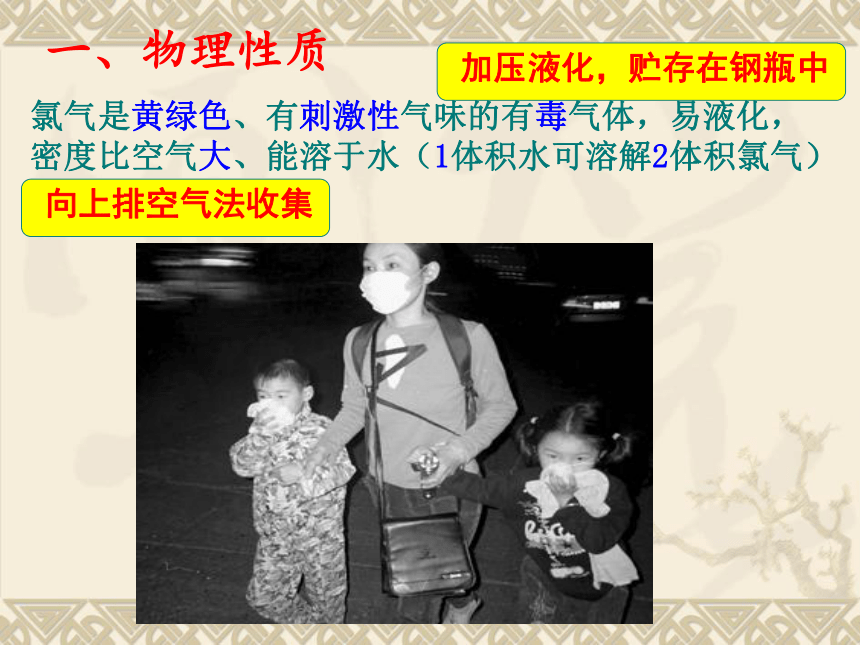
事发后消防队员不断地用水枪喷射,但时值东北风,氯气迅速向西南方扩散 ,造成350 人中毒进医院救治, 另有28人中毒死亡的特大事故,附近居民采取应急措施,疏散到一高坡上。请问:根据上述材料,氯气有哪些物理性质?一、有强氧化性的黄绿色气体-----氯气氯气是黄绿色、有刺激性气味的有毒气体,易液化,
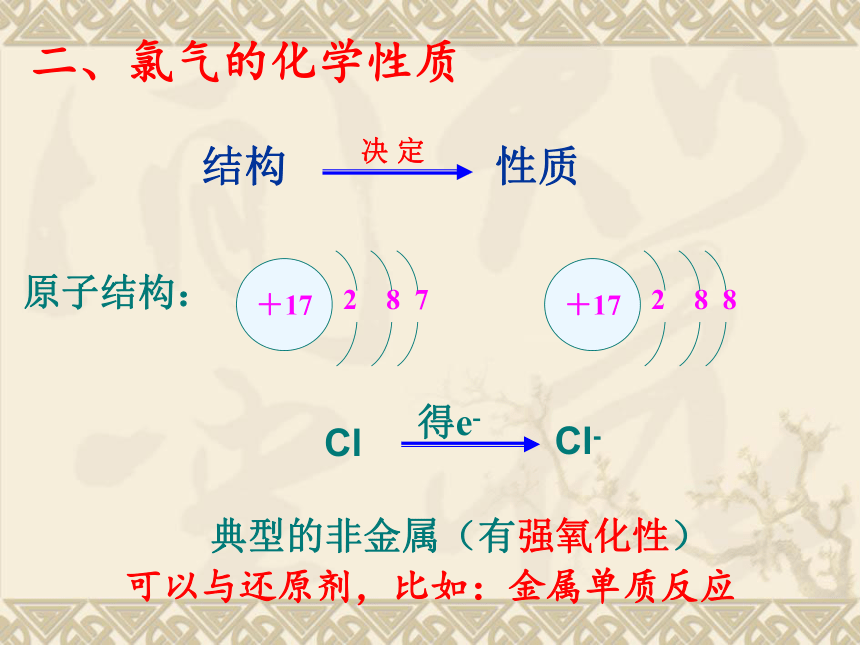
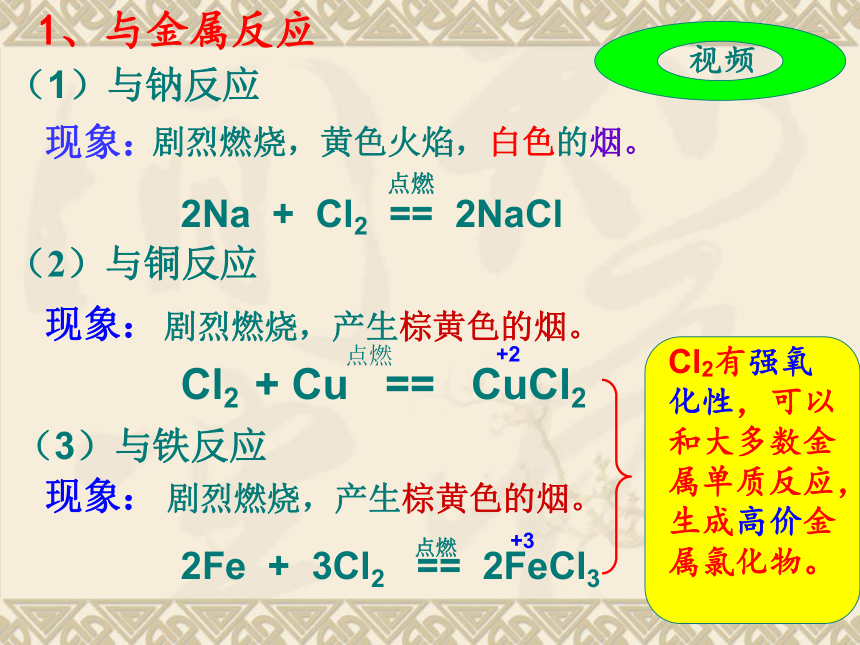
密度比空气大、能溶于水(1体积水可溶解2体积氯气)一、物理性质二、氯气的化学性质 结构原子结构: 典型的非金属(有强氧化性)Cl得e-Cl-性质决 定可以与还原剂,比如:金属单质反应1、与金属反应(1)与钠反应现象:剧烈燃烧,黄色火焰,白色的烟。(2)与铜反应现象:剧烈燃烧,产生棕黄色的烟。(3)与铁反应现象:剧烈燃烧,产生棕黄色的烟。+2+32、与非金属反应H2在Cl2的反应现象:纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。【实验4-3(1)】在空气中点燃氢气(H2),然后把
导管缓缓伸入盛满氯气(Cl2)的集气瓶。【实验4-3(2)】将和混合在一个塑料瓶中,盖好盖,在塑料瓶旁点燃镁条,观察现象。现象:瓶内的混合气体在强光照射下爆炸。1、与金属反应(1)与钠反应现象:剧烈燃烧,黄色火焰,白色的烟。(2)与铜反应现象:剧烈燃烧,产生棕黄色的烟。(3)与铁反应现象:剧烈燃烧,产生棕黄色的烟。+2+32、与非金属反应H2在Cl2的反应现象:纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。【实验4-3(1)】在空气中点燃氢气(H2),然后把
导管缓缓伸入盛满氯气(Cl2)的集气瓶。【实验4-3(2)】将和混合在一个塑料瓶中,盖好盖,在塑料瓶旁点燃镁条,观察现象。现象:瓶内的混合气体在强光照射下爆炸。实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合, Cl2都是做氧化剂。燃烧:任何发光发热的剧烈的化学反应叫做燃烧。燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?思考与交流【实验4-4、5】氯水的漂白性实验:将氯气先通入干燥的有色布条,再通入湿润的有色布条。现象:干燥的布条不褪色,
湿润的布条褪色。结论:具有漂白性的物质不是Cl2本身,而是Cl2与H2O反应的生成物—次氯酸(HClO)的功劳。Cl2 + H2O = + HClO3、与水(或碱)的反应HCl0+1-1Cl2既是氧化剂,又是还原剂(1)与水的反应Cl2 + H2O = H+ + Cl-+ HClOCl2 + H2O = HCl + HClO(次氯酸)次氯酸的性质:3、强氧化性漂白作用1、弱酸性2、不稳定易分解 可用于自来水的杀菌、消毒,可用做漂白剂。酸性:H2CO3 >HClO(2)与碱的反应根据Cl2与H2O的反应,推测Cl2与NaOH溶液能否发生反应?若反应,其产物是什么?2NaOH + Cl2 = NaClO + NaCl + H2OCl2 + H2O = HCl + HClO想一想HCl + NaOH = NaCl + H2OHClO + NaOH = NaClO + H2O“84”消毒液的有效成分Cl2 + 2OH- = ClO- + Cl- + H2O2Ca(OH)2+2Cl2=将Cl2通入消石灰〔Ca(OH)2〕中得到:HClCaCl2HClO+Ca(ClO)2+2H2O漂白粉、漂粉精的有效成分练一练:写出Cl2和NaOH溶液、以及Cl2和Ca(OH)2溶液反应的离子方程式。想一想有漂白功能的是次氯酸,那“84”
消毒液和漂白粉的漂白原理(即
它们是如何产生次氯酸)是什么?日常 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO工业 Ca(ClO)2+2HCl=CaCl2+2HClO漂白原理:氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO强酸制取弱酸想一想氧化亚铁离子(Fe2+)时就用到氯水,用的是其中的氯气(Cl2),现在我们知道氯气溶于水不仅是溶解,还有化学反应,那新制氯水有什么样的性质呢?液氯与氯水的区别?新制氯水与久置氯水的区别?纯净物混合物分子:离子:Cl2 ,HClO,H2OH+,Cl-,ClO-, OH-分子:H2O离子:H+,Cl-新制有氧化性,无酸性和漂白性有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置只有Cl2分子实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中只有酸性在实验室,氯气可用浓盐酸与MnO2反应来制取。实验装置原理MnO2 + 4HCl(浓) == MnCl2 +2H2O +Cl2 ↑ △收集装置:尾气处理:气体发生装置:固、液加热向上排气法(或排饱和食盐水法)碱液(NaOH)吸收氧化剂还原剂三、氯气的实验室制法(P83思考与交流)四、 Cl-的检验(【实验4-6】) 或者:取少量被检验的溶液于试管中,加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。(2)方法和结论:(1)所用试剂: AgNO3溶液、稀硝酸 取少量被检验的溶液于试管中,滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。有关反应的离子方程式是:
Ag+ + Cl– == AgCl ?
2Ag+ + CO32- == Ag2CO3 ?
Ag2CO3 + 2H+ == 2Ag+ + CO2 ?+ H2O
非金属及其化合物 第二节
富集在海水中的元素—氯大海有几十种化学元素,蕴藏着丰富的化学资源。
大部分以盐的形式存在,氯是最重要的成盐元素。海洋中含盐3%,如果将海水中的盐结晶后平铺于陆地上,地球将增高150米以NaCl为主要成分的食盐,至今仍是人类惟一必须的食用盐。
新疆盐湖
长芦盐场
(100)
莺歌盐场
(30) 资源开发利用案例京沪高速公路氯气泄漏事件 新华网报道:2005年3月29日,京沪高速公路淮安段一辆满载液氯的液罐车和对面来车相撞 ,大量液氯外泄。据目击者描述 : ”一股黄绿色的气体就像探照灯光一样,‘唰’地射向高空,足有5米高,并有刺鼻的气味,眼睛也熏得有些睁不开 。”
事发后消防队员不断地用水枪喷射,但时值东北风,氯气迅速向西南方扩散 ,造成350 人中毒进医院救治, 另有28人中毒死亡的特大事故,附近居民采取应急措施,疏散到一高坡上。请问:根据上述材料,氯气有哪些物理性质?一、有强氧化性的黄绿色气体-----氯气氯气是黄绿色、有刺激性气味的有毒气体,易液化,
密度比空气大、能溶于水(1体积水可溶解2体积氯气)一、物理性质二、氯气的化学性质 结构原子结构: 典型的非金属(有强氧化性)Cl得e-Cl-性质决 定可以与还原剂,比如:金属单质反应1、与金属反应(1)与钠反应现象:剧烈燃烧,黄色火焰,白色的烟。(2)与铜反应现象:剧烈燃烧,产生棕黄色的烟。(3)与铁反应现象:剧烈燃烧,产生棕黄色的烟。+2+32、与非金属反应H2在Cl2的反应现象:纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。【实验4-3(1)】在空气中点燃氢气(H2),然后把
导管缓缓伸入盛满氯气(Cl2)的集气瓶。【实验4-3(2)】将和混合在一个塑料瓶中,盖好盖,在塑料瓶旁点燃镁条,观察现象。现象:瓶内的混合气体在强光照射下爆炸。1、与金属反应(1)与钠反应现象:剧烈燃烧,黄色火焰,白色的烟。(2)与铜反应现象:剧烈燃烧,产生棕黄色的烟。(3)与铁反应现象:剧烈燃烧,产生棕黄色的烟。+2+32、与非金属反应H2在Cl2的反应现象:纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,放出大量的热,瓶口有大量白雾产生。【实验4-3(1)】在空气中点燃氢气(H2),然后把
导管缓缓伸入盛满氯气(Cl2)的集气瓶。【实验4-3(2)】将和混合在一个塑料瓶中,盖好盖,在塑料瓶旁点燃镁条,观察现象。现象:瓶内的混合气体在强光照射下爆炸。实验证明,在一定条件下,Cl2还能与P、S、C等非金属直接化合, Cl2都是做氧化剂。燃烧:任何发光发热的剧烈的化学反应叫做燃烧。燃烧不一定要有氧气参加,燃烧的本质是氧化还原反应。通过H2在Cl2中燃烧的实验,你对燃烧的条件及其本质有什么新的认识?思考与交流【实验4-4、5】氯水的漂白性实验:将氯气先通入干燥的有色布条,再通入湿润的有色布条。现象:干燥的布条不褪色,
湿润的布条褪色。结论:具有漂白性的物质不是Cl2本身,而是Cl2与H2O反应的生成物—次氯酸(HClO)的功劳。Cl2 + H2O = + HClO3、与水(或碱)的反应HCl0+1-1Cl2既是氧化剂,又是还原剂(1)与水的反应Cl2 + H2O = H+ + Cl-+ HClOCl2 + H2O = HCl + HClO(次氯酸)次氯酸的性质:3、强氧化性漂白作用1、弱酸性2、不稳定易分解 可用于自来水的杀菌、消毒,可用做漂白剂。酸性:H2CO3 >HClO(2)与碱的反应根据Cl2与H2O的反应,推测Cl2与NaOH溶液能否发生反应?若反应,其产物是什么?2NaOH + Cl2 = NaClO + NaCl + H2OCl2 + H2O = HCl + HClO想一想HCl + NaOH = NaCl + H2OHClO + NaOH = NaClO + H2O“84”消毒液的有效成分Cl2 + 2OH- = ClO- + Cl- + H2O2Ca(OH)2+2Cl2=将Cl2通入消石灰〔Ca(OH)2〕中得到:HClCaCl2HClO+Ca(ClO)2+2H2O漂白粉、漂粉精的有效成分练一练:写出Cl2和NaOH溶液、以及Cl2和Ca(OH)2溶液反应的离子方程式。想一想有漂白功能的是次氯酸,那“84”
消毒液和漂白粉的漂白原理(即
它们是如何产生次氯酸)是什么?日常 Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO工业 Ca(ClO)2+2HCl=CaCl2+2HClO漂白原理:氯水、漂白液、漂白粉、漂粉精的漂白作用都是因反应生成的HClO强酸制取弱酸想一想氧化亚铁离子(Fe2+)时就用到氯水,用的是其中的氯气(Cl2),现在我们知道氯气溶于水不仅是溶解,还有化学反应,那新制氯水有什么样的性质呢?液氯与氯水的区别?新制氯水与久置氯水的区别?纯净物混合物分子:离子:Cl2 ,HClO,H2OH+,Cl-,ClO-, OH-分子:H2O离子:H+,Cl-新制有氧化性,无酸性和漂白性有酸性,强氧化性,能漂白,消毒,光照时HClO分解久置只有Cl2分子实验室中使用的氯水只能现配现用,并盛放在棕色试剂瓶中只有酸性在实验室,氯气可用浓盐酸与MnO2反应来制取。实验装置原理MnO2 + 4HCl(浓) == MnCl2 +2H2O +Cl2 ↑ △收集装置:尾气处理:气体发生装置:固、液加热向上排气法(或排饱和食盐水法)碱液(NaOH)吸收氧化剂还原剂三、氯气的实验室制法(P83思考与交流)四、 Cl-的检验(【实验4-6】) 或者:取少量被检验的溶液于试管中,加入稀硝酸酸化,再滴入AgNO3溶液,若产生白色沉淀,则被检液中含有Cl-。(2)方法和结论:(1)所用试剂: AgNO3溶液、稀硝酸 取少量被检验的溶液于试管中,滴入AgNO3溶液,若产生白色沉淀,再加入稀硝酸,沉淀不溶,则被检液中含有Cl-。有关反应的离子方程式是:
Ag+ + Cl– == AgCl ?
2Ag+ + CO32- == Ag2CO3 ?
Ag2CO3 + 2H+ == 2Ag+ + CO2 ?+ H2O
