人教版化学必修一 第二章 化学物质及其变化 第三节 氧化还原反应 教学设计
文档属性
| 名称 | 人教版化学必修一 第二章 化学物质及其变化 第三节 氧化还原反应 教学设计 |

|
|
| 格式 | zip | ||
| 文件大小 | 22.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-24 00:00:00 | ||
图片预览


文档简介
化学1
第二章
化学物质及其变化
第三节
氧化还原反应
教学设计
一、学习目标分析
(一)学习目标确定的依据
必修模块要求
《课程标准》要求
《模块学习要求》
根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。
1能够利用化合价升降,判断反应是否为氧化还原反应。
2对于简单的氧化还原反应,能够找出氧化剂和还原剂;能列举中学阶段常见的氧化剂和还原剂。
3举例说明生产、生活中常见的氧化还原反应。初步学会从氧化还原反应的视角研究物质的化学性质。
(二)学习目标
1.知识与技能目标
(1)能够利用化合价升降,判断反应是否为氧化还原反应。认识氧化还原反应与四种基本反应类型的关系。
(2)认识氧化还原反应的本质是电子的转移。
(3)举例说明生产、生活中常见的氧化还原反应。对于简单的氧化还原反应,能够找出氧化剂和还原剂。
2.过程与方法目标
(1)通过氧化还原反应概念的引入过程,使学生体验分类的研究方法。
(2)通过对氧化还原反应本质的逐步揭示,培养学生从个性到共性归纳知识以及透过现象看本质的能力。
(3)通过对应用的介绍,使学生认识理论可以指导实践,并且培养学生一分为二看待事物的思想。
(4)初步学会从氧化还原反应的视角研究物质的化学性质。
3.情感态度与价值观目标
通过氧化还原反应概念的演变和深入发展,培养学生用发展的观点、科学的态度看待问题,体验科学概念的形成过程,培养学生用勇于探索的品质学习化学,并对学生进行透过现象看本质、对立统一等辩证唯物主义教育。
二、教学重难点分析
(一)教学重点的分析及确定
在高中化学的学习过程中,建立或深化氧化还原反应的相关概念的重要意义在于其认识功能,而且氧化还原反应的观点会贯穿整个高中化学的学习,所以非常重要。
基于以上观点确立教学重点为:氧化还原反应概念的形成过程。
(二)教学难点的分析及确定
难点在于通过概念的形成过程完成认识方式的转变,能够指导学生有效地自主学习,体现学生学习方式的转变和学习能力的不断深入和发展,及知识系统的延续性和发展性。
基于以上观点确立教学难点为:氧化还原反应的本质和特征。
三、教学内容安排
(一)本节内容在教材中的地位及教材分析
氧化还原反应是高中阶段教学内容的重点和难点。新课程标准中对这部分的要求是“根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应”。将它排在第二章第三节,编排在离子反应之后,元素化合物知识之前,一方面可以降低初、高中之间的台阶,有利于知识的衔接、概念的延伸,更重要的是为今后学习化学奠定基础,铺平道路,其地位也同“离子反应”一样,是引导学生有效进行高中阶段化学学习的必备基础知识,具有非常重要的承前启后的作用。
本节教材主要包括氧化还原反应、氧化剂和还原剂两个部分。
在第一部分内容中,教科书首先以“思想与交流”的方式,让学生通过列举几个氧化反应和还原反应的实例,从得氧、失氧的角度对这些反应进行分类,最后得出氧化反应和还原反应是同时发生的结论,从而从得氧、失氧的角度得出氧化还原反应的概念。
然后教科书还是以“思考与交流”的方式,让学生分析3个有得氧和失氧的氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价升降的关系。通过分析Fe与CuSO4的反应,将氧化还原反应扩大到虽然没有得氧、失氧关系,但反应前后元素化合价有升降的氧化还原反应,引出氧化还原反应的特征。
最后主要从微观的角度来认识电子转移与氧化还原反应的关系,这是本节的主要内容。教科书以钠与氯气的反应、氢气与氯气的反应为例,从原子结构的角度讨论了氧化还原反应与电子转移的关系,并从电子转移的角度给氧化还原反应下了一个更为本质的定义。第一部分的最后安排了“学与问”,要求通过讨论分析置换反应等基本类型的反应与氧化还原反应的关系,并要求学生用交叉分类示意图简要表示这种关系。
第二部分主要讨论氧化剂和还原剂。教科书从电子转移的角度给氧化剂和还原剂下定义,并简单介绍了中学化学中常见的氧化剂和还原剂。
本节最后简介了氧化还原反应在工农业生产、科学技术和日常生活中的重要应用,同时也辩证地介绍了有的氧化还原反应会给人类带来危害,并指出这是不以人的意志为转移的。人类只有掌握了化学变化的规律之后,才能更好地利用化学变化为人类造福。
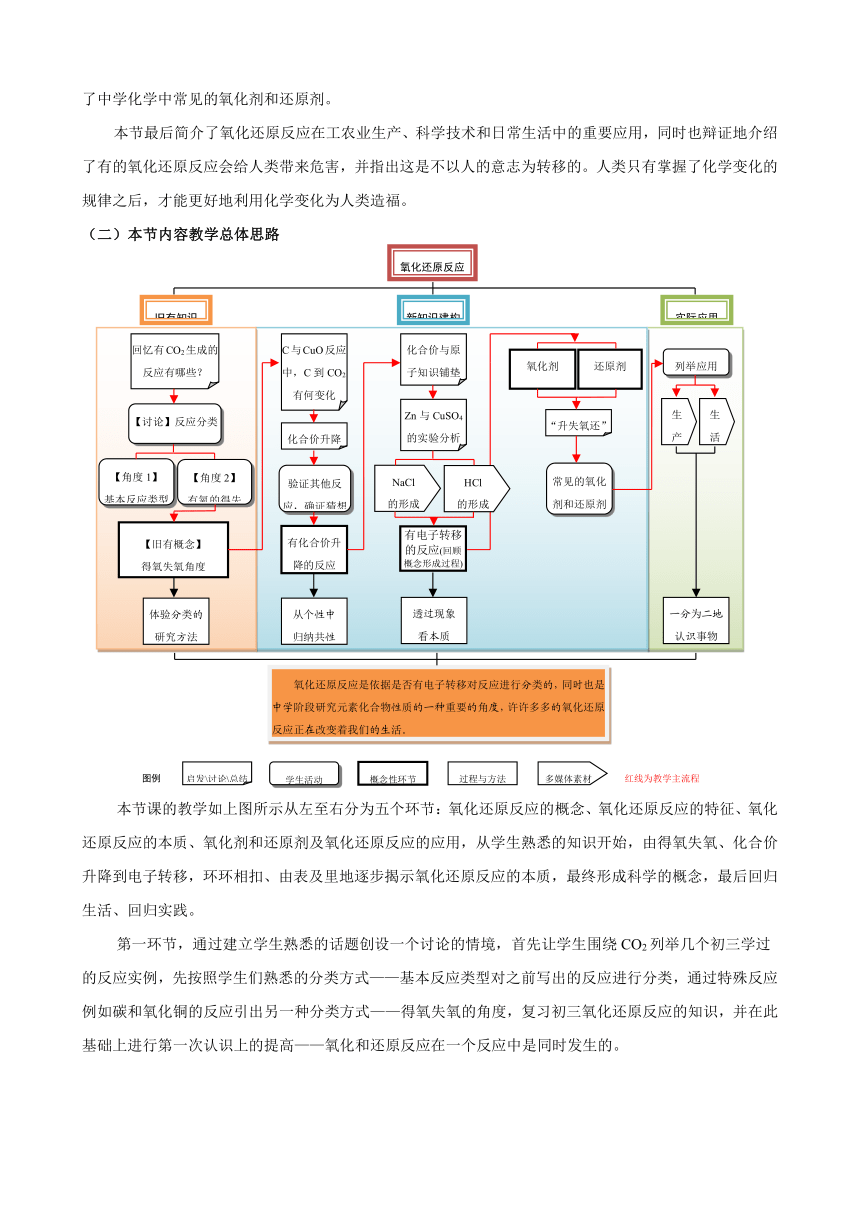
(二)本节内容教学总体思路
本节课的教学如上图所示从左至右分为五个环节:氧化还原反应的概念、氧化还原反应的特征、氧化还原反应的本质、氧化剂和还原剂及氧化还原反应的应用,从学生熟悉的知识开始,由得氧失氧、化合价升降到电子转移,环环相扣、由表及里地逐步揭示氧化还原反应的本质,最终形成科学的概念,最后回归生活、回归实践。
第一环节,通过建立学生熟悉的话题创设一个讨论的情境,首先让学生围绕CO2列举几个初三学过的反应实例,先按照学生们熟悉的分类方式——基本反应类型对之前写出的反应进行分类,通过特殊反应例如碳和氧化铜的反应引出另一种分类方式——得氧失氧的角度,复习初三氧化还原反应的知识,并在此基础上进行第一次认识上的提高——氧化和还原反应在一个反应中是同时发生的。
第二环节,通过分析一个具体的氧化还原反应,引导学生从元素的化合价是否发生变化的角度重新认识这类反应,引出氧化还原反应的特征,并进行第二次认识上的提高——只要化学反应前后元素化合价有升降的反应都属于氧化还原反应。
第三、四环节,主要从微观的角度来认识电子转移与氧化还原反应的关系,并从电子转移的角度给氧化还原反应下了一个更为本质的定义,并认识氧化剂和还原剂,这也是第三次认识上的提高。这个环节还将引导学生通过讨论,用交叉分类示意图简要表示四种基本类型的反应与氧化还原反应的关系。之后通过回顾前三个环节,进一步体会化学概念的形成过程。
本节最后一个环节从理论回归实践、回归生活,使学生体会抽象、“枯燥”的理论知识不但可以解释生活中的现象,并能指导实践、影响我们的生活。
(三)学时安排
本节课的教学,计划安排2课时完成。将五个环节编排为三大模块:旧有知识回顾,建构新知识以及实践应用,从实际反应中归纳总结出一般的规律,最后又回归实践,体现了理论与实践、一般与特殊的辩证关系;概念的形成过程由表及里、逐步提高,符合学生认知规律。具体教学流程可参见上页流程图。
(四)本节涉及内容的深广度把握
氧化产物和还原产物的概念、氧化性和还原性强弱的判断、电子得失守恒原理在化学计算方面的应用、对复杂氧化还原反应进行配平、对氧化还原反应类型进行判断等内容暂不做要求,将在选修模块学习。
对于一般校的学生来说,由于初三基础可能不扎实,原子结构等微观思想、回忆和识别某些化学方程式、以及抽象思维的能力都比较薄弱。因此,对于课堂必备的知识可以事先做一定铺垫,同时将难点分散,在突出重点基础上可以适当对部分学生暂时理解困难的知识做灵活处理。例如化合价与电子得失的关系以学生会用为准,短时间内可能部分学生难以理解透彻,因此可以直接给出结论性知识不做过多讨论。
四、教学方法与学习指导策略建议
本节课的教学内容理论性比较强,要注意通过观察、对比、分类、讨论、归纳等方式来指导本节的学习。
(一)氧化还原反应概念的引入
本课的引入方式是多种多样的。例如可以以学生讨论的方式回顾旧知识,引入新概念。例如:由学生结合初中化学所学知识回顾生成二氧化碳的所有化学反应方程式,然后对化学方程式以多种分类标准进行归类、对比;通过对比使得木炭与氧化铜(氧化铁)、一氧化碳与氧化铜(氧化铁)的反应脱颖而出(不属于四大基本类型),利用学生初中学过的知识很容易从得氧失氧角度引出氧化还原反应。再通过观察上述反应,由木炭(一氧化碳)到二氧化碳除了有得氧的变化外还可看出碳的化合价的变化,从而很容易引出氧化还原反应的特征。
也可以通过探究性实验——例如锌与硫酸铜溶液的反应。通过学生观察实验过程中电流计指针发生了偏转,确定线路内有电流产生,发生了电荷的定向移动。直观的实验可以大大降低学生理解微观世界的难度,对于学生理解化合价变化与电子转移的关系是很有帮助的。
综上所述,氧化还原反应对于入学不久的高一学生而言,是一个全新的、抽象的、难于理解的内容,又由于理论性、逻辑性强,因此学生容易感觉枯燥乏味、缺乏学习兴趣和动机。为此,我们的引入是通过学生熟悉的内容入手,一方面温故而知新,有利于学生学习新知识,另一方面能够使学生更易于接受,更好理解,更有利于内容的衔接。总之,从学生所熟悉的内容引入新知识,对于教师的讲授、学生的学习都会有很大的帮助,使学习能够由表及里,由简单到复杂,从而达到好的学习效果。对于一般校而言,我们建议采用第一种引入方式,内容简单,学生易于理解、易于接受。
(二)氧化还原反应本质的认识
这部分内容比较抽象,宏观上很难让学生理解的很透彻,再加上初中阶段学生对原子核结构只是一个粗略的认识,对于原子核外电子的排布还不是很清楚,为此建议教师对于氯化钠和氯化氢的形成可以采用Flash动画和视频等多媒体方式让学生从微观角度对氧化还原反应的本质有明确的认识,教师再结合多媒体加以讲解、分析,相信学生会对氧化还原反应的本质有更加深入的了解,会有更加明确的认识,学习效果会更好。
教师也可结合课本图2–12一些元素的原子结构示意图和图2–13氯化钠形成示意图加以讲解、分析,以使学生的理解更加深入。
为了使学生对氧化还原反应的学习效果更好,建议教师可以留给学生对于所熟悉的分解反应、化合反应、置换反应、复分解反应这四种基本反应与氧化还原反应之间的关系一个讨论的空间,并列举出相应的化学反应。
总之,对于氧化还原反应的本质的认识,对于一般校建议采用第一种教学方式,一方面易于教师的讲解和学生的理解,另一方面,有利于激发学生学习的兴趣,活跃课堂气氛,为教师授课营造一个好的氛围。
(三)氧化剂和还原剂的理解
教师可采取提问的方式让学生结合初中化学所学内容思考具有氧化性的物质,教师可结合学生的回答加以补充说明,让学生对此有更加深入的理解。
教师可结合单、双线桥这一加深理解氧化还原反应的工具引导学生总结氧化剂和还原剂“升失氧还,降得还氧”的规律,以帮助学生理解的更加深刻,但是要注意把握度,单双线桥法侧重使用,学生看得懂即可,不必过于强化。
五、教学资源建议
处理化合价变化与电子得失的联系时,结合教材图2-12的原子结构示意图加以讲解分析。
在教学重、难点:氧化还原反应的特征和本质环节,可以用生动的Flash动画、录像等资料。利用直观影像化解学生理解微观世界的困难。
充分利用各种日常以及生产有关的氧化还原反应的图片、事例,增加学生的感性认识,使学生充分体会氧化还原反应与我们生活紧密相关。
学生课下可以登录查询资料的网站:例如化学21世纪教育网,化学资源网,人民教育出版社等进行补充学习;同时有条件的学校可以利用Blog、Wiki、网络合作性学习网站等网络媒介进行学生课堂反馈、课外讨论、研究性学习,将课堂学习延伸至课外。
六、课堂教学评价建议
(一)对于知识与技能目标的评价建议用纸笔作业评价。考察应以氧化还原反应的特征和本质、氧化剂和还原剂的判断为重点。课后题很多,这里不做举例了,应注意度的把握,避免偏怪难、超纲。
(二)对于过程与方法、情感态度与价值观目标的达成度,可以从很多方面来考察。
例如:可以利用氧化还原反应解释日常生活的现象:
1.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜铸塑像上出现铜绿[Cu2(OH)2CO3]
B.充有氢气的气球遇明火爆炸
C.大理石雕像被酸雨腐蚀毁坏
D.夏日的深夜坟场里的”鬼火”
例如:辩证统一的思想的巩固,有氧化反应发生就有还原反应发生。
2.化学反应Na2 SO3+S=Na2S2O3中,没有发生的反应是(
)
A.化合反应
B.氧化反应
C.还原反应
D.置换反应
例如:开放性题目的完成,对知识的再现以及分类方法的巩固有很大的帮助。由于学生程度相对较低,建议小组完成。(P37“学与问”)
例如:对于“回忆CO2的生成反应并进行分类”的探究,可设计下页表格进行检验。
(三)本节全部学习结束以后,可以引导学生从学习前后知识能力的对比等方面对自己的学习进行反思回顾,通过反思、学习日志、自我问答等方式记录下自己反思的成果并与老师和同学交流。这些思考和交流後的结果,应该放入学生的个人学习档案袋。
课堂表现评价表
学生姓名-------------
评价的维度
评价信息
活动过程的评价
学生的参与意识
分析问题的思路
表达交流技能
能否对他人的观点做准确、有条理的补充?
处理现场提问的应变能力
对活动结果的评价
知识再现是否完整度
分类是否恰当准确
图例
启发\讨论\总结
学生活动
概念性环节
过程与方法
多媒体素材
新知识建构
C与CuO反应中,C到CO2有何变化
化合价升降
验证其他反应,确证猜想
有化合价升降的反应
化合价与原子知识铺垫
NaCl
的形成
HCl
的形成
Zn与CuSO4的实验分析
有电子转移的反应(回顾概念形成过程)
“升失氧还”
氧化剂
还原剂
常见的氧化剂和还原剂
实际应用
列举应用
生
产
生
活
体验分类的研究方法
从个性中
归纳共性
透过现象
看本质
一分为二地认识事物
氧化还原反应
氧化还原反应是依据是否有电子转移对反应进行分类的,同时也是中学阶段研究元素化合物性质的一种重要的角度,许许多多的氧化还原反应正在改变着我们的生活。
旧有知识
回忆有CO2生成的反应有哪些?
【讨论】反应分类
【角度1】
基本反应类型
【角度2】
有氧的得失
【旧有概念】
得氧失氧角度
红线为教学主流程
第二章
化学物质及其变化
第三节
氧化还原反应
教学设计
一、学习目标分析
(一)学习目标确定的依据
必修模块要求
《课程标准》要求
《模块学习要求》
根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。
1能够利用化合价升降,判断反应是否为氧化还原反应。
2对于简单的氧化还原反应,能够找出氧化剂和还原剂;能列举中学阶段常见的氧化剂和还原剂。
3举例说明生产、生活中常见的氧化还原反应。初步学会从氧化还原反应的视角研究物质的化学性质。
(二)学习目标
1.知识与技能目标
(1)能够利用化合价升降,判断反应是否为氧化还原反应。认识氧化还原反应与四种基本反应类型的关系。
(2)认识氧化还原反应的本质是电子的转移。
(3)举例说明生产、生活中常见的氧化还原反应。对于简单的氧化还原反应,能够找出氧化剂和还原剂。
2.过程与方法目标
(1)通过氧化还原反应概念的引入过程,使学生体验分类的研究方法。
(2)通过对氧化还原反应本质的逐步揭示,培养学生从个性到共性归纳知识以及透过现象看本质的能力。
(3)通过对应用的介绍,使学生认识理论可以指导实践,并且培养学生一分为二看待事物的思想。
(4)初步学会从氧化还原反应的视角研究物质的化学性质。
3.情感态度与价值观目标
通过氧化还原反应概念的演变和深入发展,培养学生用发展的观点、科学的态度看待问题,体验科学概念的形成过程,培养学生用勇于探索的品质学习化学,并对学生进行透过现象看本质、对立统一等辩证唯物主义教育。
二、教学重难点分析
(一)教学重点的分析及确定
在高中化学的学习过程中,建立或深化氧化还原反应的相关概念的重要意义在于其认识功能,而且氧化还原反应的观点会贯穿整个高中化学的学习,所以非常重要。
基于以上观点确立教学重点为:氧化还原反应概念的形成过程。
(二)教学难点的分析及确定
难点在于通过概念的形成过程完成认识方式的转变,能够指导学生有效地自主学习,体现学生学习方式的转变和学习能力的不断深入和发展,及知识系统的延续性和发展性。
基于以上观点确立教学难点为:氧化还原反应的本质和特征。
三、教学内容安排
(一)本节内容在教材中的地位及教材分析
氧化还原反应是高中阶段教学内容的重点和难点。新课程标准中对这部分的要求是“根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应”。将它排在第二章第三节,编排在离子反应之后,元素化合物知识之前,一方面可以降低初、高中之间的台阶,有利于知识的衔接、概念的延伸,更重要的是为今后学习化学奠定基础,铺平道路,其地位也同“离子反应”一样,是引导学生有效进行高中阶段化学学习的必备基础知识,具有非常重要的承前启后的作用。
本节教材主要包括氧化还原反应、氧化剂和还原剂两个部分。
在第一部分内容中,教科书首先以“思想与交流”的方式,让学生通过列举几个氧化反应和还原反应的实例,从得氧、失氧的角度对这些反应进行分类,最后得出氧化反应和还原反应是同时发生的结论,从而从得氧、失氧的角度得出氧化还原反应的概念。
然后教科书还是以“思考与交流”的方式,让学生分析3个有得氧和失氧的氧化还原反应中各种元素的化合价在反应前后有无变化,讨论氧化还原反应与元素化合价升降的关系。通过分析Fe与CuSO4的反应,将氧化还原反应扩大到虽然没有得氧、失氧关系,但反应前后元素化合价有升降的氧化还原反应,引出氧化还原反应的特征。
最后主要从微观的角度来认识电子转移与氧化还原反应的关系,这是本节的主要内容。教科书以钠与氯气的反应、氢气与氯气的反应为例,从原子结构的角度讨论了氧化还原反应与电子转移的关系,并从电子转移的角度给氧化还原反应下了一个更为本质的定义。第一部分的最后安排了“学与问”,要求通过讨论分析置换反应等基本类型的反应与氧化还原反应的关系,并要求学生用交叉分类示意图简要表示这种关系。
第二部分主要讨论氧化剂和还原剂。教科书从电子转移的角度给氧化剂和还原剂下定义,并简单介绍了中学化学中常见的氧化剂和还原剂。
本节最后简介了氧化还原反应在工农业生产、科学技术和日常生活中的重要应用,同时也辩证地介绍了有的氧化还原反应会给人类带来危害,并指出这是不以人的意志为转移的。人类只有掌握了化学变化的规律之后,才能更好地利用化学变化为人类造福。
(二)本节内容教学总体思路
本节课的教学如上图所示从左至右分为五个环节:氧化还原反应的概念、氧化还原反应的特征、氧化还原反应的本质、氧化剂和还原剂及氧化还原反应的应用,从学生熟悉的知识开始,由得氧失氧、化合价升降到电子转移,环环相扣、由表及里地逐步揭示氧化还原反应的本质,最终形成科学的概念,最后回归生活、回归实践。
第一环节,通过建立学生熟悉的话题创设一个讨论的情境,首先让学生围绕CO2列举几个初三学过的反应实例,先按照学生们熟悉的分类方式——基本反应类型对之前写出的反应进行分类,通过特殊反应例如碳和氧化铜的反应引出另一种分类方式——得氧失氧的角度,复习初三氧化还原反应的知识,并在此基础上进行第一次认识上的提高——氧化和还原反应在一个反应中是同时发生的。
第二环节,通过分析一个具体的氧化还原反应,引导学生从元素的化合价是否发生变化的角度重新认识这类反应,引出氧化还原反应的特征,并进行第二次认识上的提高——只要化学反应前后元素化合价有升降的反应都属于氧化还原反应。
第三、四环节,主要从微观的角度来认识电子转移与氧化还原反应的关系,并从电子转移的角度给氧化还原反应下了一个更为本质的定义,并认识氧化剂和还原剂,这也是第三次认识上的提高。这个环节还将引导学生通过讨论,用交叉分类示意图简要表示四种基本类型的反应与氧化还原反应的关系。之后通过回顾前三个环节,进一步体会化学概念的形成过程。
本节最后一个环节从理论回归实践、回归生活,使学生体会抽象、“枯燥”的理论知识不但可以解释生活中的现象,并能指导实践、影响我们的生活。
(三)学时安排
本节课的教学,计划安排2课时完成。将五个环节编排为三大模块:旧有知识回顾,建构新知识以及实践应用,从实际反应中归纳总结出一般的规律,最后又回归实践,体现了理论与实践、一般与特殊的辩证关系;概念的形成过程由表及里、逐步提高,符合学生认知规律。具体教学流程可参见上页流程图。
(四)本节涉及内容的深广度把握
氧化产物和还原产物的概念、氧化性和还原性强弱的判断、电子得失守恒原理在化学计算方面的应用、对复杂氧化还原反应进行配平、对氧化还原反应类型进行判断等内容暂不做要求,将在选修模块学习。
对于一般校的学生来说,由于初三基础可能不扎实,原子结构等微观思想、回忆和识别某些化学方程式、以及抽象思维的能力都比较薄弱。因此,对于课堂必备的知识可以事先做一定铺垫,同时将难点分散,在突出重点基础上可以适当对部分学生暂时理解困难的知识做灵活处理。例如化合价与电子得失的关系以学生会用为准,短时间内可能部分学生难以理解透彻,因此可以直接给出结论性知识不做过多讨论。
四、教学方法与学习指导策略建议
本节课的教学内容理论性比较强,要注意通过观察、对比、分类、讨论、归纳等方式来指导本节的学习。
(一)氧化还原反应概念的引入
本课的引入方式是多种多样的。例如可以以学生讨论的方式回顾旧知识,引入新概念。例如:由学生结合初中化学所学知识回顾生成二氧化碳的所有化学反应方程式,然后对化学方程式以多种分类标准进行归类、对比;通过对比使得木炭与氧化铜(氧化铁)、一氧化碳与氧化铜(氧化铁)的反应脱颖而出(不属于四大基本类型),利用学生初中学过的知识很容易从得氧失氧角度引出氧化还原反应。再通过观察上述反应,由木炭(一氧化碳)到二氧化碳除了有得氧的变化外还可看出碳的化合价的变化,从而很容易引出氧化还原反应的特征。
也可以通过探究性实验——例如锌与硫酸铜溶液的反应。通过学生观察实验过程中电流计指针发生了偏转,确定线路内有电流产生,发生了电荷的定向移动。直观的实验可以大大降低学生理解微观世界的难度,对于学生理解化合价变化与电子转移的关系是很有帮助的。
综上所述,氧化还原反应对于入学不久的高一学生而言,是一个全新的、抽象的、难于理解的内容,又由于理论性、逻辑性强,因此学生容易感觉枯燥乏味、缺乏学习兴趣和动机。为此,我们的引入是通过学生熟悉的内容入手,一方面温故而知新,有利于学生学习新知识,另一方面能够使学生更易于接受,更好理解,更有利于内容的衔接。总之,从学生所熟悉的内容引入新知识,对于教师的讲授、学生的学习都会有很大的帮助,使学习能够由表及里,由简单到复杂,从而达到好的学习效果。对于一般校而言,我们建议采用第一种引入方式,内容简单,学生易于理解、易于接受。
(二)氧化还原反应本质的认识
这部分内容比较抽象,宏观上很难让学生理解的很透彻,再加上初中阶段学生对原子核结构只是一个粗略的认识,对于原子核外电子的排布还不是很清楚,为此建议教师对于氯化钠和氯化氢的形成可以采用Flash动画和视频等多媒体方式让学生从微观角度对氧化还原反应的本质有明确的认识,教师再结合多媒体加以讲解、分析,相信学生会对氧化还原反应的本质有更加深入的了解,会有更加明确的认识,学习效果会更好。
教师也可结合课本图2–12一些元素的原子结构示意图和图2–13氯化钠形成示意图加以讲解、分析,以使学生的理解更加深入。
为了使学生对氧化还原反应的学习效果更好,建议教师可以留给学生对于所熟悉的分解反应、化合反应、置换反应、复分解反应这四种基本反应与氧化还原反应之间的关系一个讨论的空间,并列举出相应的化学反应。
总之,对于氧化还原反应的本质的认识,对于一般校建议采用第一种教学方式,一方面易于教师的讲解和学生的理解,另一方面,有利于激发学生学习的兴趣,活跃课堂气氛,为教师授课营造一个好的氛围。
(三)氧化剂和还原剂的理解
教师可采取提问的方式让学生结合初中化学所学内容思考具有氧化性的物质,教师可结合学生的回答加以补充说明,让学生对此有更加深入的理解。
教师可结合单、双线桥这一加深理解氧化还原反应的工具引导学生总结氧化剂和还原剂“升失氧还,降得还氧”的规律,以帮助学生理解的更加深刻,但是要注意把握度,单双线桥法侧重使用,学生看得懂即可,不必过于强化。
五、教学资源建议
处理化合价变化与电子得失的联系时,结合教材图2-12的原子结构示意图加以讲解分析。
在教学重、难点:氧化还原反应的特征和本质环节,可以用生动的Flash动画、录像等资料。利用直观影像化解学生理解微观世界的困难。
充分利用各种日常以及生产有关的氧化还原反应的图片、事例,增加学生的感性认识,使学生充分体会氧化还原反应与我们生活紧密相关。
学生课下可以登录查询资料的网站:例如化学21世纪教育网,化学资源网,人民教育出版社等进行补充学习;同时有条件的学校可以利用Blog、Wiki、网络合作性学习网站等网络媒介进行学生课堂反馈、课外讨论、研究性学习,将课堂学习延伸至课外。
六、课堂教学评价建议
(一)对于知识与技能目标的评价建议用纸笔作业评价。考察应以氧化还原反应的特征和本质、氧化剂和还原剂的判断为重点。课后题很多,这里不做举例了,应注意度的把握,避免偏怪难、超纲。
(二)对于过程与方法、情感态度与价值观目标的达成度,可以从很多方面来考察。
例如:可以利用氧化还原反应解释日常生活的现象:
1.日常生活中的许多现象与化学反应有关,下列现象与氧化还原反应无关的是( )
A.铜铸塑像上出现铜绿[Cu2(OH)2CO3]
B.充有氢气的气球遇明火爆炸
C.大理石雕像被酸雨腐蚀毁坏
D.夏日的深夜坟场里的”鬼火”
例如:辩证统一的思想的巩固,有氧化反应发生就有还原反应发生。
2.化学反应Na2 SO3+S=Na2S2O3中,没有发生的反应是(
)
A.化合反应
B.氧化反应
C.还原反应
D.置换反应
例如:开放性题目的完成,对知识的再现以及分类方法的巩固有很大的帮助。由于学生程度相对较低,建议小组完成。(P37“学与问”)
例如:对于“回忆CO2的生成反应并进行分类”的探究,可设计下页表格进行检验。
(三)本节全部学习结束以后,可以引导学生从学习前后知识能力的对比等方面对自己的学习进行反思回顾,通过反思、学习日志、自我问答等方式记录下自己反思的成果并与老师和同学交流。这些思考和交流後的结果,应该放入学生的个人学习档案袋。
课堂表现评价表
学生姓名-------------
评价的维度
评价信息
活动过程的评价
学生的参与意识
分析问题的思路
表达交流技能
能否对他人的观点做准确、有条理的补充?
处理现场提问的应变能力
对活动结果的评价
知识再现是否完整度
分类是否恰当准确
图例
启发\讨论\总结
学生活动
概念性环节
过程与方法
多媒体素材
新知识建构
C与CuO反应中,C到CO2有何变化
化合价升降
验证其他反应,确证猜想
有化合价升降的反应
化合价与原子知识铺垫
NaCl
的形成
HCl
的形成
Zn与CuSO4的实验分析
有电子转移的反应(回顾概念形成过程)
“升失氧还”
氧化剂
还原剂
常见的氧化剂和还原剂
实际应用
列举应用
生
产
生
活
体验分类的研究方法
从个性中
归纳共性
透过现象
看本质
一分为二地认识事物
氧化还原反应
氧化还原反应是依据是否有电子转移对反应进行分类的,同时也是中学阶段研究元素化合物性质的一种重要的角度,许许多多的氧化还原反应正在改变着我们的生活。
旧有知识
回忆有CO2生成的反应有哪些?
【讨论】反应分类
【角度1】
基本反应类型
【角度2】
有氧的得失
【旧有概念】
得氧失氧角度
红线为教学主流程
