2.4 氢原子光谱与能级结构 课件 (2)
文档属性
| 名称 | 2.4 氢原子光谱与能级结构 课件 (2) |

|
|
| 格式 | zip | ||
| 文件大小 | 185.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 物理 | ||
| 更新时间 | 2016-08-25 00:00:00 | ||
图片预览








文档简介
课件20张PPT。高中物理·选修3-5·鲁科版第2章 原子结构
第4节 氢原子光谱与能级结构[目标定位] 1.知道氢原子光谱的实验规律,了解巴尔末公式及里德伯常量.2.理解玻尔理论对氢原子光谱规律的解释.一、氢原子光谱
1.氢原子光谱的特点:
(1)从红外区到紫外区呈现多条具有确定 的谱线;
(2)从长波到短波,Hα~Hδ等谱线间的距离 ,表现出明显的 .预习导学波长 越来越小 规律性 里德伯常量 二、玻尔理论对氢原子光谱的解释
1.巴尔末系:氢原子从n≥3的能级跃迁到 的能级得到的线系.
2.玻尔理论的局限性:玻尔理论解释了原子结构和氢原子 .的关系,但无法计算光谱的 ,对于其他元素更为复杂的光谱,理论与实验 .预习导学n=2 光谱 强度 差别很大 一、氢原子光谱的实验规律
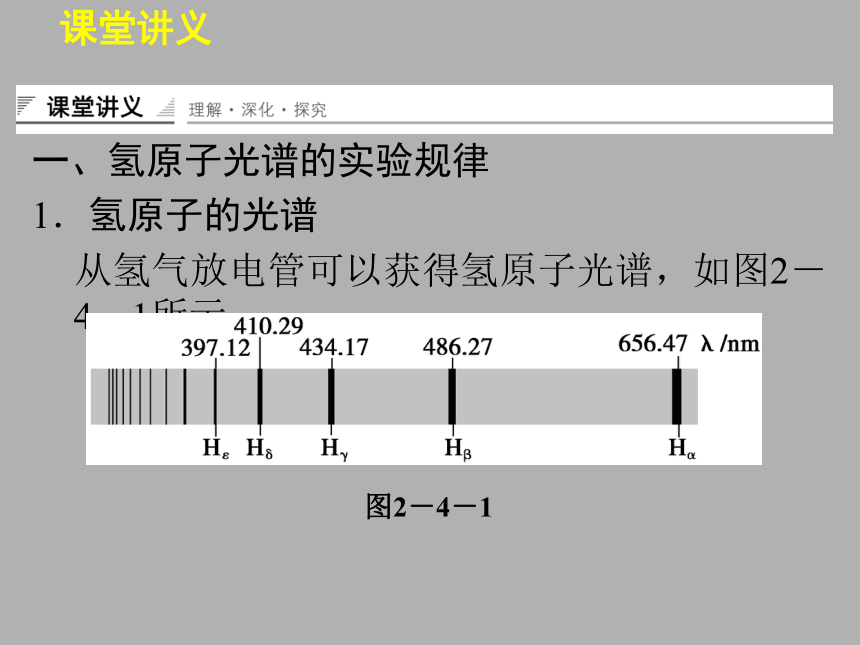
1.氢原子的光谱
从氢气放电管可以获得氢原子光谱,如图2-4-1所示.课堂讲义图2-4-1 课堂讲义2.氢原子光谱的特点:在氢原子光谱图中的可见光区内,由右向左,相邻谱线间的距离越来越小,表现出明显的规律性.课堂讲义课堂讲义【例1】 根据巴尔末公式,指出氢原子光谱在可见光范围内最长波长和最短波长所对应的n,并计算其波长.
答案 当n=3时,波长最长为6.55×10-7 m
当n=∞时,波长最短为3.64×10-7 m.课堂讲义课堂讲义课堂讲义课堂讲义答案 AC
解析 此公式是巴尔末在研究氢原子光谱在可见光区的14条谱线中得到的,只适用于氢原子光谱的分析,且n只能取大于等于3的整数,则λ不能取连续值,故氢原子光谱是分立的光谱,故A、C对,B、D错.课堂讲义课堂讲义2.成功方面
(1)运用经典理论和量子化观念确定了氢原子的各个定态的能量,并由此画出了氢原子的能级图.
(2)处于激发态的氢原子向低能级跃迁辐射出光子,辐射光子的能量与实际符合得很好,由于能级是分立的,辐射光子的波长是不连续的.课堂讲义(3)导出了巴尔末公式,并从理论上算出了里德伯常量R的值,并很好地解释甚至预言了氢原子的其他谱线系.
(4)能够解释原子光谱,每种原子都有特定的能级,原子发生跃迁时,每种原子都有自己的特征谱线,即原子光谱是线状光谱,利用光谱可以鉴别物质和确定物质的组成成分.课堂讲义 答案 C课堂讲义解析 巴尔末公式只确定了氢原子发光中的一个线系波长,不能描述氢原子发出的各种光的波长,也不能描述其他原子发出的光,故D错误.巴尔末公式是由当时已知的可见光中的部分谱线总结出来的,但它适用于整个巴尔末线系,故A、B错误,C正确.课堂讲义借题发挥 巴尔末公式的应用方法及注意问题
(1)巴尔末公式反映氢原子发光的规律特征,不能描述其他原子.
(2)公式中n只能取整数,不能连续取值,因此波长也只是分立的值.
(3)公式是在对可见光区的四条谱线分析时总结出的,在紫外区的谱线也适用.
(4)应用时熟记公式,当n取不同值时求出一一对应的波长λ.课堂讲义 A.玻尔理论中氢原子从高能级向n=2能级跃迁时,放出的光谱线与巴尔末公式计算出的光谱线一致
B.氢原子从n=2,3,4,…能级向n=1能级跃迁时,放出的光谱线亦满足巴尔末公式
C.巴尔末公式能用来解释所有原子光谱规律
D.用巴尔末公式计算出的光谱线均在可见光范围内
答案 A 再见
第4节 氢原子光谱与能级结构[目标定位] 1.知道氢原子光谱的实验规律,了解巴尔末公式及里德伯常量.2.理解玻尔理论对氢原子光谱规律的解释.一、氢原子光谱
1.氢原子光谱的特点:
(1)从红外区到紫外区呈现多条具有确定 的谱线;
(2)从长波到短波,Hα~Hδ等谱线间的距离 ,表现出明显的 .预习导学波长 越来越小 规律性 里德伯常量 二、玻尔理论对氢原子光谱的解释
1.巴尔末系:氢原子从n≥3的能级跃迁到 的能级得到的线系.
2.玻尔理论的局限性:玻尔理论解释了原子结构和氢原子 .的关系,但无法计算光谱的 ,对于其他元素更为复杂的光谱,理论与实验 .预习导学n=2 光谱 强度 差别很大 一、氢原子光谱的实验规律
1.氢原子的光谱
从氢气放电管可以获得氢原子光谱,如图2-4-1所示.课堂讲义图2-4-1 课堂讲义2.氢原子光谱的特点:在氢原子光谱图中的可见光区内,由右向左,相邻谱线间的距离越来越小,表现出明显的规律性.课堂讲义课堂讲义【例1】 根据巴尔末公式,指出氢原子光谱在可见光范围内最长波长和最短波长所对应的n,并计算其波长.
答案 当n=3时,波长最长为6.55×10-7 m
当n=∞时,波长最短为3.64×10-7 m.课堂讲义课堂讲义课堂讲义课堂讲义答案 AC
解析 此公式是巴尔末在研究氢原子光谱在可见光区的14条谱线中得到的,只适用于氢原子光谱的分析,且n只能取大于等于3的整数,则λ不能取连续值,故氢原子光谱是分立的光谱,故A、C对,B、D错.课堂讲义课堂讲义2.成功方面
(1)运用经典理论和量子化观念确定了氢原子的各个定态的能量,并由此画出了氢原子的能级图.
(2)处于激发态的氢原子向低能级跃迁辐射出光子,辐射光子的能量与实际符合得很好,由于能级是分立的,辐射光子的波长是不连续的.课堂讲义(3)导出了巴尔末公式,并从理论上算出了里德伯常量R的值,并很好地解释甚至预言了氢原子的其他谱线系.
(4)能够解释原子光谱,每种原子都有特定的能级,原子发生跃迁时,每种原子都有自己的特征谱线,即原子光谱是线状光谱,利用光谱可以鉴别物质和确定物质的组成成分.课堂讲义 答案 C课堂讲义解析 巴尔末公式只确定了氢原子发光中的一个线系波长,不能描述氢原子发出的各种光的波长,也不能描述其他原子发出的光,故D错误.巴尔末公式是由当时已知的可见光中的部分谱线总结出来的,但它适用于整个巴尔末线系,故A、B错误,C正确.课堂讲义借题发挥 巴尔末公式的应用方法及注意问题
(1)巴尔末公式反映氢原子发光的规律特征,不能描述其他原子.
(2)公式中n只能取整数,不能连续取值,因此波长也只是分立的值.
(3)公式是在对可见光区的四条谱线分析时总结出的,在紫外区的谱线也适用.
(4)应用时熟记公式,当n取不同值时求出一一对应的波长λ.课堂讲义 A.玻尔理论中氢原子从高能级向n=2能级跃迁时,放出的光谱线与巴尔末公式计算出的光谱线一致
B.氢原子从n=2,3,4,…能级向n=1能级跃迁时,放出的光谱线亦满足巴尔末公式
C.巴尔末公式能用来解释所有原子光谱规律
D.用巴尔末公式计算出的光谱线均在可见光范围内
答案 A 再见
同课章节目录
- 第1章 动量守恒研究
- 导 入 从天体到微粒的碰撞
- 第1节 动量定理
- 第2节 动量守恒定律
- 第3节 科学探究——维弹性碰撞
- 第2章 原子结构
- 导 入 从一幅图片说起
- 第1节 电子的发现与汤姆孙模型
- 第2节 原子的核式结构模型
- 第3节 玻尔的原子模型
- 第4节 氢原子光谱与能级结构
- 专题探究 动量与原子的实验与调研
- 第3章 原子核与放射性
- 导 入 打开原子核物理的大门
- 第1节 原子核结构
- 第2节 原子核衰变及半衰期
- 第3节 放射性的应用与防护
- 第4章 核能
- 导 入 熟悉而又陌生的核能
- 第1节 核力与核能
- 第2节 核裂变
- 第3节 核聚变
- 第4节 核能的利用与环境保护
- 专题探究 原子核和核能利用的实验与调研
- 第5章 波与粒子
- 导 入 奇异的微观世界
- 第1节 光电效应
- 第2节 康普顿效应
- 第3节 实物粒子的波粒二象性
- 第4节 “基本粒子”与恒星演化
- 专题探究 波粒二象性的实验与调研
