人教版化学选修4《化学反应原理》 第一章化学反应与能量教材分析 课件(52张)
文档属性
| 名称 | 人教版化学选修4《化学反应原理》 第一章化学反应与能量教材分析 课件(52张) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-26 00:00:00 | ||
图片预览









文档简介
课件52张PPT。选修4《化学反应原理》
第一节 化学反应与能量的变化
第二节 燃烧热 能源
第三节 化学反应热的计算
第一章化学反应与能量教材分析 教学课时分配
第一节 化学反应与能量变化 1课时
第二节 燃烧热 能源 1课时
第三节 化学反应热的计算 2课时
实验 中和热测定 1课时
单元复习检测 1课时
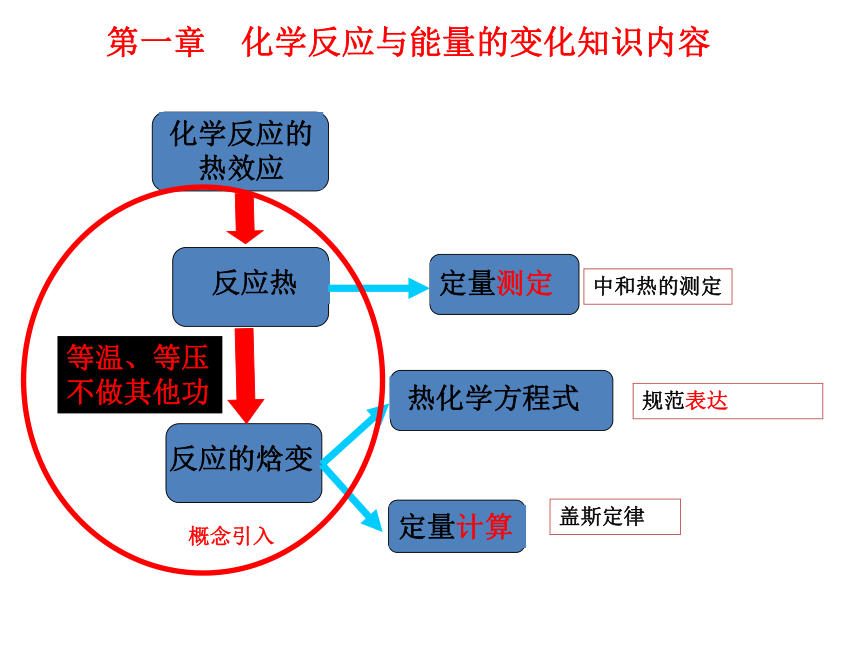
总计 6课时 第一章 化学反应与能量的变化知识内容等温、等压
不做其他功 规范表达中和热的测定盖斯定律概念引入本专题在模块中的地位
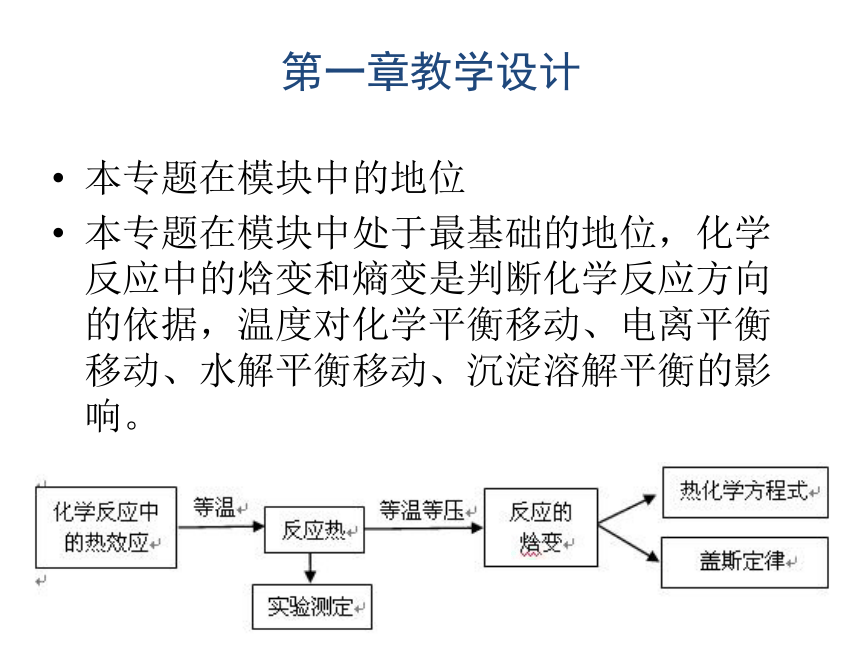
本专题在模块中处于最基础的地位,化学反应中的焓变和熵变是判断化学反应方向的依据,温度对化学平衡移动、电离平衡移动、水解平衡移动、沉淀溶解平衡的影响。第一章教学设计能量观的基本内涵分子原子具有热能:分子、原子由于无规则(不碰撞)运动产生的能量。物质的存在状态与热能有关。
核外电子按能量高低排布在核外运动,决定了最外层电子的得、失能力(也决定了化合价)。
化学键:原子之间的强烈相互作用,使原子处于能量较低的稳定状态。(物质转化必伴随能量改变。
键的断裂与形成需要吸、放热)能量观的基本价值定量研究化学反应的热效应。(为实验测定反应热指明了方向。测温度差)
预测元素的金属性、非金属性。
解释晶体的物理性质和化合物的稳定性。
解释影响化学反应速率的条件。
判断物质转化的方向。
掌握热能的表示,了解能源的利用。北京D第一节 化学反应与能量变化一、反应热 焓变
要点:
1.反应热的概念(举例说明化学键能→反应热效应→吸、放热反应)
2.焓→变简化后的意义=恒压下反应的反应热?H
3.放热反应的?H为“-”
二、热化学方程式
要点:
1.注明反应时的温度、压强,反应物、产物的状态
2.化学方程式中的计量数可以是分数
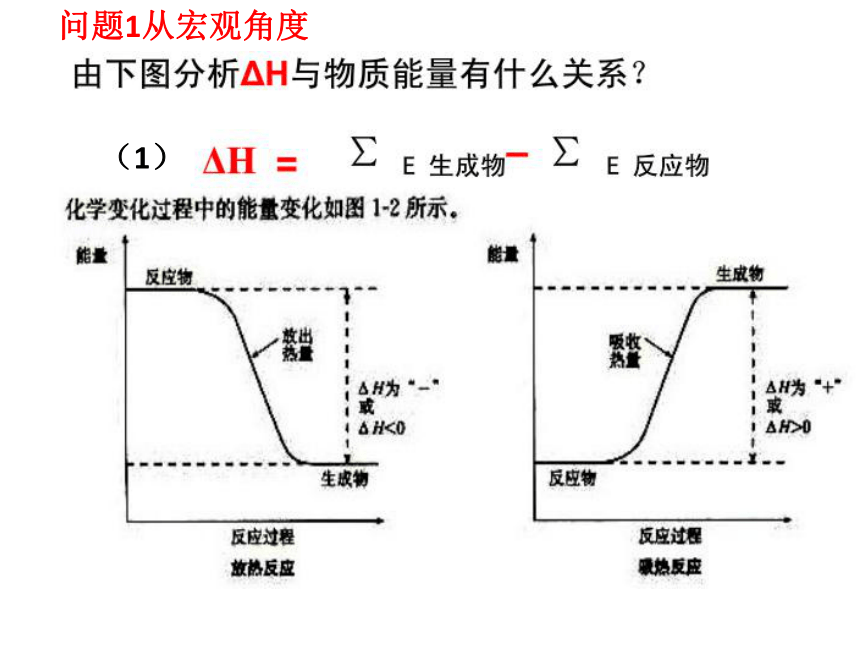
实践活动——中和反应反应热的测定:体验反应热,了解相关科学实验的过程和方法问题1从宏观角度(1)问题2:化学反应的实质是什么?从微观角度问题3:化学反应的△H与键能的关系 ?(2)△H=断键的总能-成键的总能△H=(436+243)-2X431=-183KJ/mol化学反应中存在热效应,告诉学生“焓”是人们为了方便计算反应热而定义的一个新物理量,可用反应焓的变化来衡量反应中能量的改变。即这样描述:在恒压条件下,反应热等于反应的焓变,即△H=Q。目标就达成了——会运用焓变,为后续的学习打下基础。 提供信息→提出问题→对比的方法→归纳整理→交流汇报二、关于热化学方程式的教学 充分利用数据展开讨论,使学生自主归纳出热化学方程式书写的注意事项; 例1
2H2(g)+ O2(g) = 2H2O(g);△H= -483.6 kJ/mol
2H2(g)十 O2 (g)=2H2O(l);△H= -571.6kJ/mol课题1:如何在化学方程式中正确反映其热量变化?问题2:为什么反应物相同产物相同,但产生的热量不同?学生:物质的聚集状态,与它们所具有的能量有关,
方程式中要注明反应物和生成物的状态。 例2
学生:对于相同物质的反应,当化学计量数不同时,其△H也不同,且成比例关系。
问题4:热化学方程式各物质前的化学计量数的意义?
学生:它可以是整数也可以是分数,因此不表示分子个数,只表示物质的量。问题3:观察2个方程式你能得到哪些结论?提高:
相同条件下,在密闭容器中加入1molN2和3molH2 ,
充分反应并达到平衡时,放出的热量_______92.4kJ
(填“大于”、“小于”或“等于”)。
原因是_____ _____。
问题5:体会如何在化学方程式中正确反映其热量变化?1、化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol;
2、物质后需标聚集状态(s、l、g、aq不用↓↑);
3 、热化学方程式中各物质化学式前面的化学计量数仅表示已参加的物质的物质的量,因此化学计量数可以是整数也可以是简单分数;
4、根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但数值不变
问题6:讨论归纳书写热化学方程式应注意什么?用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
(1)已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
①H2O的电子式是 。
②反应A的热化学方程式是 。
③断开1 mol H-O键与断开1 mol H-Cl 键所需能量相差约为 kJ ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”) 。热化学方程式的书写键能的计算化学键强弱的比较红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
根据上图回答下列问题(1)P和Cl2反应生成PCl3的热化学方程式 ;
P(g)+3/2Cl2(g)= PCl3 (g) ΔH=-306 kJ/mol
2P(g)+3Cl2(g)= 2PCl3 (g) ΔH=-612 kJ/mol
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
PCl5 (g) =PCl3 (g) + Cl2 (g) ΔH=+93 kJ/mol中和热测定的教学过程定量化学实验是科学研究的主要手段之一,它对于学生科学
态度和科学方法的培养尤为重要,是训练学生科学研究能力
的有效手段。国外现代中学和大学化学教材中定量化学实验
的比例较大,《化学反应原理》是十分贴近国外教材的编写,
其中的定量实验比较多。 必修2P34明确实验目的中和热测温度变化明确原理、推导定量公式吸收能量物质方案Ⅰ方案Ⅱ方案Ⅰ方案Ⅱ定什么量?如何定量?如何精确定量?Q = m · c ·Δt
中和热测定实验前预习报告定量实验前测对中和热的理解1、中和热都属于反应热 ,也用△H表示,是放热反应△H<0,单位也为kJ/mol
2、概念: ①在稀溶液中, ②酸跟碱发生中和反应而③生成1molH2O(l),这时的反应热叫做中和热。
3、中和热不包括离子在水溶液中的生成热、物质的溶解热、沉淀热、电解质电离的吸热所伴随的热效应
4、表示方法(中学阶段,只讨论强酸和强碱反应的中和热)
NaOH( aq)+HCl(aq)=NaCl(aq)+H2O (l) ?H= –57.3 kJ /molOH-( aq)+H+(aq)=H2O (l) ?H= –57.3 kJ /mol明确实验目的方案Ⅰ确保中和反应发生完全,热能少损耗方案Ⅱ确保收集数据可靠中和反应反应热测定实验目的
测定强酸和强碱在稀溶液中反应生成
1 mol H2O 时的反应热(焓变)
实验装置
1.测定酸碱中和热为什么要用稀溶液?2.评价该装置是怎样尽量减少实验过程中的热量损失?中和反应反应热的测定实验原理
50 mL 0.50 mol/L 盐酸 和
50 mL 0.55 mol/L NaOH溶液反应
测量反应放出的热量:
Q = m · c ·Δt
= 100g×4.18J/(g ·℃) ×Δt
= 0.418Δt kJ
计算生成 1 mol H2O 时的焓变:
3.为什么中和热测定中要用稍过量的碱?能不能用过量的酸? 4.中和产生的热量使m克的水升温,如何求m ?5.使体系温度升高的热是否就是中和热?它和中和热的关系是什么?
6.如何记录定量数据?如何处理数据?4.54.0
6.1
3.9
4.14
4.0定量实验为什么要做平行数据, 怎样判断坏数据,有效数字的含义。 化学实验的一般步骤实验目的确定实验原理(包括反应原理、推出定量原理)( 控制准量原则 )
合理的利用有利因素
分析并控制干扰因素实验方案形成明确中和反应反应热的测定几点说明
1.定量实验中精确测定和近似处理的关系
在误差的允许范围内,近似处理能简化实验方案和数据处理
近似处理应该有科学依据
ρ(0.50 mol/L HCl)≈1.008g/cm3
2.定量实验中有效数字和有效数字计算
定量测定的数据究竟保留几位数,必须根据仪器的精度来决定。
有效数字的处理和运算应严格遵循有关规则 中和反应反应热的测定
3.定量实验中减小误差的方法
平行实验
对照实验
空白实验
4.本实验中碱稍稍过量的原因分析
保证盐酸被完全中和。
避免碱溶液中碳酸盐的影响。 一
些
物
质
的
燃
烧
热⑴由表分析,??????? 是一种比较理想的燃料。⑵你认为应根据什么标准来选择燃料?⑶试简述理想燃料应具备哪些优点? 可从物质的燃烧热、燃料的储量、开采、运输、价格、对生态环境的影响等各方面综合考虑。 1.选择燃料的重要数据第二节数据比较策略在理论教学中作用2.判断同素异形体之间的转化3.比较烃的燃烧热1.同系物中含碳数越大(分子量大),燃烧热值大
2.相同碳数的烃,含氢量大,燃烧热值大
3.若乙炔转化成苯是吸热还是放热反映等物质
的量如何测定C(s)+1/2O2(g)==CO(g)的反应热△H1①能直接测定吗?为什么?
②若不能直接测,怎么办?第三节 盖斯定律的教学过程盖斯定律1840年,瑞士化学家盖斯,通过大量实验
事实证明,不管化学反应是一步完成或分
几步完成,其反应热是相同的。化学反应
的反应热只与反应体系的始态和终态有关,
而与反应的途径无关。这就是盖斯定律。
盖斯定律图示模型数学模型
△H= △H1+ △H2
△H1= △H- △H2盖斯定律在科学研究中的重要意义有些反应进行得很慢
有些反应不容易直接发生
有些反应的产品不纯(有副反应发生)
这些都给测量反应热造成了困难
利用盖斯定律可以间接地把它们的反应热计算出来C(s)+ ? O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案计算该反应的ΔH。
提示(1) C(s) + O2(g) = CO2(g)
△H1=-393.5 kJ/mol
(2) CO(g) + ?O2(g) = CO2(g)
△H3=-283.0 kJ/mol△H1= △H2+ △H3
△H2 = △H1- △H3
= -393.5 kJ/mol -(-283.0 kJ/mol)
= -110.5 kJ/mol
C (s) + ? O2 (g) = CO2(g)
△H=-110.5 kJ/mol
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol
C. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×10232CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) ΔH=-552 kJ/mol
2Na2O2(s)+ 2CO(g)= 2Na2CO3(s)
ΔH =-(566+ 552) kJ/mol
=-1018 kJ/mol+)2×6.02×1023反馈练习北京-26(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
写出该反应的热化学方程式: _。 某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在,该废水的处理流程如下:盖斯定律的应用示意图新课程交流和讨论P-9 虽然将煤转化为水煤气再燃烧与直接燃烧煤所获得的能量是一样的,而且将煤转化为水煤气会增加消耗。但将煤转化为水煤气至少有两个优点:一是:
将固体煤转化为气体,极大地提高了燃烧效率;
二是:
通过转化除去了硫,避免了SO2气体的产生。A海南A福建-11C山东-12B1.化学反应原理概念教学中,最值得深入思考、研究的问题是什么?学生对于概念的学习存在哪些错误认识?
如何探查和转变学生的个人概念?2.化学反应原理概念教学中,让学生获得什么最有价值?对概念的认识方式、对问题的分析方法、对问题的解决程序教学反思通过化学反应原理模块的学习将有哪些收获?它能帮助学生深入理解元素化合物知识,能促进学生的化学反应知识系统化、结构化,能帮助学生发展逻辑推理能力,提高学生的科学素养,同时通过探究活动和专题研究等丰富的学习活动,能培养学生科学探究能力
第二节 燃烧热 能源
第三节 化学反应热的计算
第一章化学反应与能量教材分析 教学课时分配
第一节 化学反应与能量变化 1课时
第二节 燃烧热 能源 1课时
第三节 化学反应热的计算 2课时
实验 中和热测定 1课时
单元复习检测 1课时
总计 6课时 第一章 化学反应与能量的变化知识内容等温、等压
不做其他功 规范表达中和热的测定盖斯定律概念引入本专题在模块中的地位
本专题在模块中处于最基础的地位,化学反应中的焓变和熵变是判断化学反应方向的依据,温度对化学平衡移动、电离平衡移动、水解平衡移动、沉淀溶解平衡的影响。第一章教学设计能量观的基本内涵分子原子具有热能:分子、原子由于无规则(不碰撞)运动产生的能量。物质的存在状态与热能有关。
核外电子按能量高低排布在核外运动,决定了最外层电子的得、失能力(也决定了化合价)。
化学键:原子之间的强烈相互作用,使原子处于能量较低的稳定状态。(物质转化必伴随能量改变。
键的断裂与形成需要吸、放热)能量观的基本价值定量研究化学反应的热效应。(为实验测定反应热指明了方向。测温度差)
预测元素的金属性、非金属性。
解释晶体的物理性质和化合物的稳定性。
解释影响化学反应速率的条件。
判断物质转化的方向。
掌握热能的表示,了解能源的利用。北京D第一节 化学反应与能量变化一、反应热 焓变
要点:
1.反应热的概念(举例说明化学键能→反应热效应→吸、放热反应)
2.焓→变简化后的意义=恒压下反应的反应热?H
3.放热反应的?H为“-”
二、热化学方程式
要点:
1.注明反应时的温度、压强,反应物、产物的状态
2.化学方程式中的计量数可以是分数
实践活动——中和反应反应热的测定:体验反应热,了解相关科学实验的过程和方法问题1从宏观角度(1)问题2:化学反应的实质是什么?从微观角度问题3:化学反应的△H与键能的关系 ?(2)△H=断键的总能-成键的总能△H=(436+243)-2X431=-183KJ/mol化学反应中存在热效应,告诉学生“焓”是人们为了方便计算反应热而定义的一个新物理量,可用反应焓的变化来衡量反应中能量的改变。即这样描述:在恒压条件下,反应热等于反应的焓变,即△H=Q。目标就达成了——会运用焓变,为后续的学习打下基础。 提供信息→提出问题→对比的方法→归纳整理→交流汇报二、关于热化学方程式的教学 充分利用数据展开讨论,使学生自主归纳出热化学方程式书写的注意事项; 例1
2H2(g)+ O2(g) = 2H2O(g);△H= -483.6 kJ/mol
2H2(g)十 O2 (g)=2H2O(l);△H= -571.6kJ/mol课题1:如何在化学方程式中正确反映其热量变化?问题2:为什么反应物相同产物相同,但产生的热量不同?学生:物质的聚集状态,与它们所具有的能量有关,
方程式中要注明反应物和生成物的状态。 例2
学生:对于相同物质的反应,当化学计量数不同时,其△H也不同,且成比例关系。
问题4:热化学方程式各物质前的化学计量数的意义?
学生:它可以是整数也可以是分数,因此不表示分子个数,只表示物质的量。问题3:观察2个方程式你能得到哪些结论?提高:
相同条件下,在密闭容器中加入1molN2和3molH2 ,
充分反应并达到平衡时,放出的热量_______92.4kJ
(填“大于”、“小于”或“等于”)。
原因是_____ _____。
问题5:体会如何在化学方程式中正确反映其热量变化?1、化学方程的右边必须写上△H,并用“空格”隔开, △H:吸热用“+”,放热用:“-”,单位是kJ/mol或J/mol;
2、物质后需标聚集状态(s、l、g、aq不用↓↑);
3 、热化学方程式中各物质化学式前面的化学计量数仅表示已参加的物质的物质的量,因此化学计量数可以是整数也可以是简单分数;
4、根据焓的性质,若化学方程式中各物质的系数加倍,则△H的数值也加倍;若反应逆向进行,则△H改变符号,但数值不变
问题6:讨论归纳书写热化学方程式应注意什么?用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2 2Cl2+2H2O
(1)已知:i.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
①H2O的电子式是 。
②反应A的热化学方程式是 。
③断开1 mol H-O键与断开1 mol H-Cl 键所需能量相差约为 kJ ,H2O中H-O键比HCl中H-Cl键(填“强”或“弱”) 。热化学方程式的书写键能的计算化学键强弱的比较红磷P(S)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
根据上图回答下列问题(1)P和Cl2反应生成PCl3的热化学方程式 ;
P(g)+3/2Cl2(g)= PCl3 (g) ΔH=-306 kJ/mol
2P(g)+3Cl2(g)= 2PCl3 (g) ΔH=-612 kJ/mol
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
PCl5 (g) =PCl3 (g) + Cl2 (g) ΔH=+93 kJ/mol中和热测定的教学过程定量化学实验是科学研究的主要手段之一,它对于学生科学
态度和科学方法的培养尤为重要,是训练学生科学研究能力
的有效手段。国外现代中学和大学化学教材中定量化学实验
的比例较大,《化学反应原理》是十分贴近国外教材的编写,
其中的定量实验比较多。 必修2P34明确实验目的中和热测温度变化明确原理、推导定量公式吸收能量物质方案Ⅰ方案Ⅱ方案Ⅰ方案Ⅱ定什么量?如何定量?如何精确定量?Q = m · c ·Δt
中和热测定实验前预习报告定量实验前测对中和热的理解1、中和热都属于反应热 ,也用△H表示,是放热反应△H<0,单位也为kJ/mol
2、概念: ①在稀溶液中, ②酸跟碱发生中和反应而③生成1molH2O(l),这时的反应热叫做中和热。
3、中和热不包括离子在水溶液中的生成热、物质的溶解热、沉淀热、电解质电离的吸热所伴随的热效应
4、表示方法(中学阶段,只讨论强酸和强碱反应的中和热)
NaOH( aq)+HCl(aq)=NaCl(aq)+H2O (l) ?H= –57.3 kJ /molOH-( aq)+H+(aq)=H2O (l) ?H= –57.3 kJ /mol明确实验目的方案Ⅰ确保中和反应发生完全,热能少损耗方案Ⅱ确保收集数据可靠中和反应反应热测定实验目的
测定强酸和强碱在稀溶液中反应生成
1 mol H2O 时的反应热(焓变)
实验装置
1.测定酸碱中和热为什么要用稀溶液?2.评价该装置是怎样尽量减少实验过程中的热量损失?中和反应反应热的测定实验原理
50 mL 0.50 mol/L 盐酸 和
50 mL 0.55 mol/L NaOH溶液反应
测量反应放出的热量:
Q = m · c ·Δt
= 100g×4.18J/(g ·℃) ×Δt
= 0.418Δt kJ
计算生成 1 mol H2O 时的焓变:
3.为什么中和热测定中要用稍过量的碱?能不能用过量的酸? 4.中和产生的热量使m克的水升温,如何求m ?5.使体系温度升高的热是否就是中和热?它和中和热的关系是什么?
6.如何记录定量数据?如何处理数据?4.54.0
6.1
3.9
4.14
4.0定量实验为什么要做平行数据, 怎样判断坏数据,有效数字的含义。 化学实验的一般步骤实验目的确定实验原理(包括反应原理、推出定量原理)( 控制准量原则 )
合理的利用有利因素
分析并控制干扰因素实验方案形成明确中和反应反应热的测定几点说明
1.定量实验中精确测定和近似处理的关系
在误差的允许范围内,近似处理能简化实验方案和数据处理
近似处理应该有科学依据
ρ(0.50 mol/L HCl)≈1.008g/cm3
2.定量实验中有效数字和有效数字计算
定量测定的数据究竟保留几位数,必须根据仪器的精度来决定。
有效数字的处理和运算应严格遵循有关规则 中和反应反应热的测定
3.定量实验中减小误差的方法
平行实验
对照实验
空白实验
4.本实验中碱稍稍过量的原因分析
保证盐酸被完全中和。
避免碱溶液中碳酸盐的影响。 一
些
物
质
的
燃
烧
热⑴由表分析,??????? 是一种比较理想的燃料。⑵你认为应根据什么标准来选择燃料?⑶试简述理想燃料应具备哪些优点? 可从物质的燃烧热、燃料的储量、开采、运输、价格、对生态环境的影响等各方面综合考虑。 1.选择燃料的重要数据第二节数据比较策略在理论教学中作用2.判断同素异形体之间的转化3.比较烃的燃烧热1.同系物中含碳数越大(分子量大),燃烧热值大
2.相同碳数的烃,含氢量大,燃烧热值大
3.若乙炔转化成苯是吸热还是放热反映等物质
的量如何测定C(s)+1/2O2(g)==CO(g)的反应热△H1①能直接测定吗?为什么?
②若不能直接测,怎么办?第三节 盖斯定律的教学过程盖斯定律1840年,瑞士化学家盖斯,通过大量实验
事实证明,不管化学反应是一步完成或分
几步完成,其反应热是相同的。化学反应
的反应热只与反应体系的始态和终态有关,
而与反应的途径无关。这就是盖斯定律。
盖斯定律图示模型数学模型
△H= △H1+ △H2
△H1= △H- △H2盖斯定律在科学研究中的重要意义有些反应进行得很慢
有些反应不容易直接发生
有些反应的产品不纯(有副反应发生)
这些都给测量反应热造成了困难
利用盖斯定律可以间接地把它们的反应热计算出来C(s)+ ? O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案计算该反应的ΔH。
提示(1) C(s) + O2(g) = CO2(g)
△H1=-393.5 kJ/mol
(2) CO(g) + ?O2(g) = CO2(g)
△H3=-283.0 kJ/mol△H1= △H2+ △H3
△H2 = △H1- △H3
= -393.5 kJ/mol -(-283.0 kJ/mol)
= -110.5 kJ/mol
C (s) + ? O2 (g) = CO2(g)
△H=-110.5 kJ/mol
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) ΔH=-226 kJ/mol
C. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×10232CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol
2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) ΔH=-552 kJ/mol
2Na2O2(s)+ 2CO(g)= 2Na2CO3(s)
ΔH =-(566+ 552) kJ/mol
=-1018 kJ/mol+)2×6.02×1023反馈练习北京-26(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
写出该反应的热化学方程式: _。 某氮肥厂氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在,该废水的处理流程如下:盖斯定律的应用示意图新课程交流和讨论P-9 虽然将煤转化为水煤气再燃烧与直接燃烧煤所获得的能量是一样的,而且将煤转化为水煤气会增加消耗。但将煤转化为水煤气至少有两个优点:一是:
将固体煤转化为气体,极大地提高了燃烧效率;
二是:
通过转化除去了硫,避免了SO2气体的产生。A海南A福建-11C山东-12B1.化学反应原理概念教学中,最值得深入思考、研究的问题是什么?学生对于概念的学习存在哪些错误认识?
如何探查和转变学生的个人概念?2.化学反应原理概念教学中,让学生获得什么最有价值?对概念的认识方式、对问题的分析方法、对问题的解决程序教学反思通过化学反应原理模块的学习将有哪些收获?它能帮助学生深入理解元素化合物知识,能促进学生的化学反应知识系统化、结构化,能帮助学生发展逻辑推理能力,提高学生的科学素养,同时通过探究活动和专题研究等丰富的学习活动,能培养学生科学探究能力
