【全国百强校】海南省国兴中学高中化学必修一课件:1-1-2 过滤和蒸发、离子检验 (共38张PPT)
文档属性
| 名称 | 【全国百强校】海南省国兴中学高中化学必修一课件:1-1-2 过滤和蒸发、离子检验 (共38张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 438.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-27 17:02:33 | ||
图片预览







文档简介
课件38张PPT。1-1-2 过滤和蒸发、离子检验 海南省国兴中学
曾垂云团队合作学习 自主管理 先学后教
第一章《从实验学化学》
第一节《化学实验基本方法》二、混合物的分离和提纯
1、分离:
把混合物中的几种物质分开,分别得到纯净物。
提纯:
把混合物中的杂质除去,得到纯净的目标物质。
2、阅读课本第5页,回答为什么要将混合物进行分离和提纯?
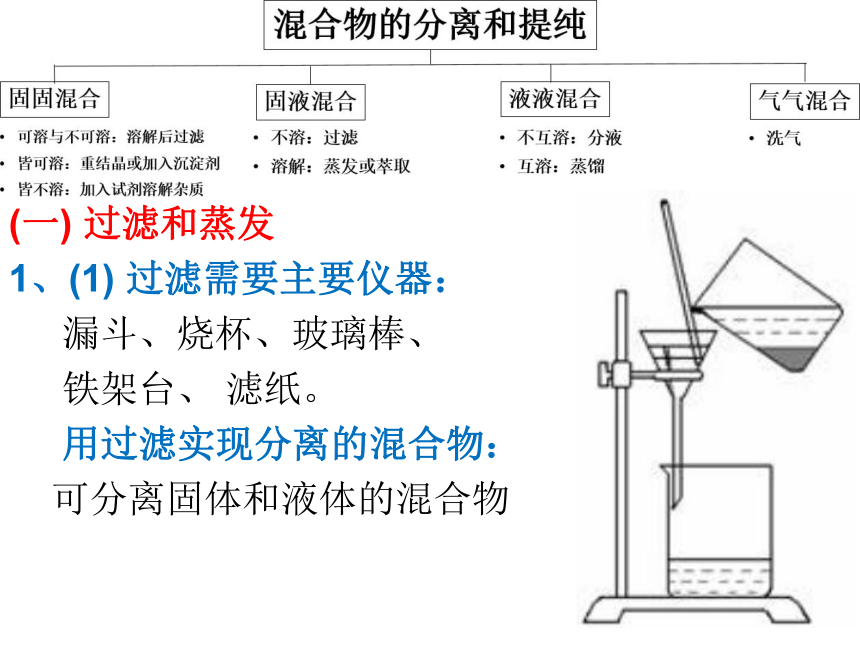
物质的研究与利用经常需要的是纯净物。(一) 过滤和蒸发
1、(1) 过滤需要主要仪器:
漏斗、烧杯、玻璃棒、
铁架台、 滤纸。
用过滤实现分离的混合物:
可分离固体和液体的混合物 (一) 过滤和蒸发
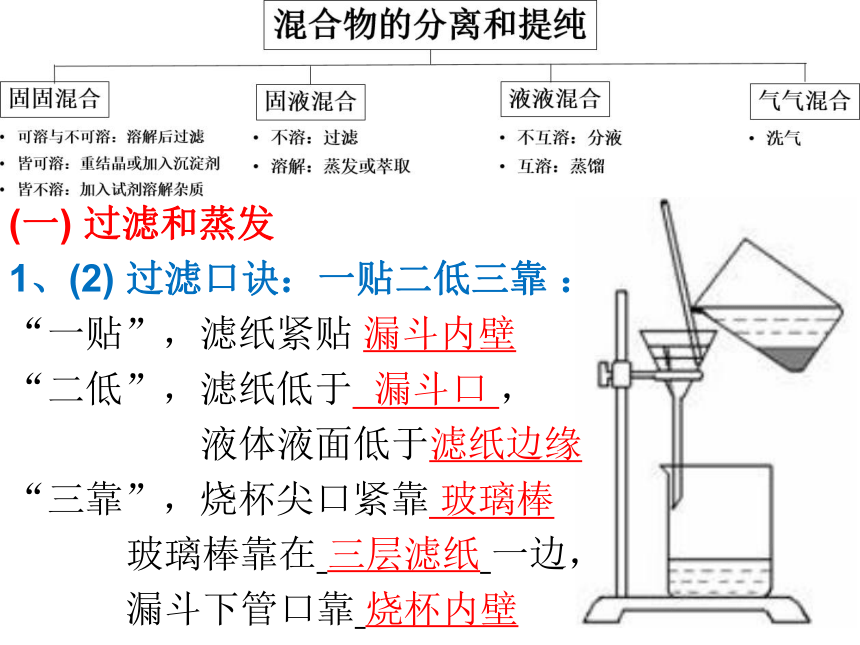
1、(2) 过滤口诀:一贴二低三靠 :
“一贴”,滤纸紧贴 漏斗内壁
“二低”,滤纸低于 漏斗口 ,
液体液面低于滤纸边缘
“三靠”,烧杯尖口紧靠 玻璃棒
玻璃棒靠在 三层滤纸 一边,
漏斗下管口靠 烧杯内壁 (一) 过滤和蒸发
2、(1) 蒸发需要的主要仪器:
蒸发皿、铁架台、酒精灯、玻璃棒。
适合用蒸发操提纯的混合物:
固体溶质和溶剂 (一) 过滤和蒸发
2、 (2) 过滤操作有要点 :
a. 液体不超过蒸发皿的 三分之二
b. 加热时,用 玻璃棒 不断搅拌
c. 现较多固体时停止 加热 , 余热 蒸干
d. 未冷却的蒸发皿要放在 石棉网 上 (一) 过滤和蒸发
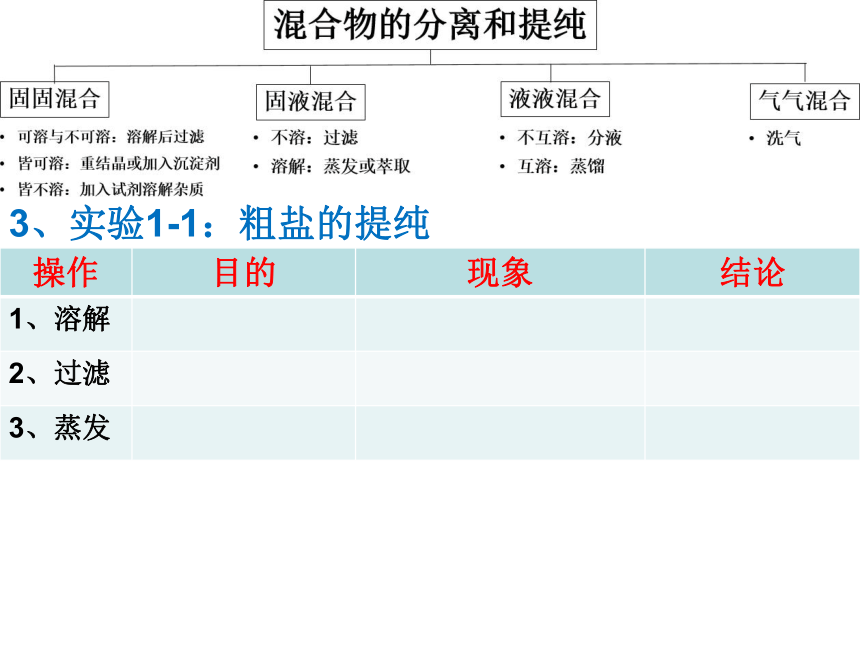
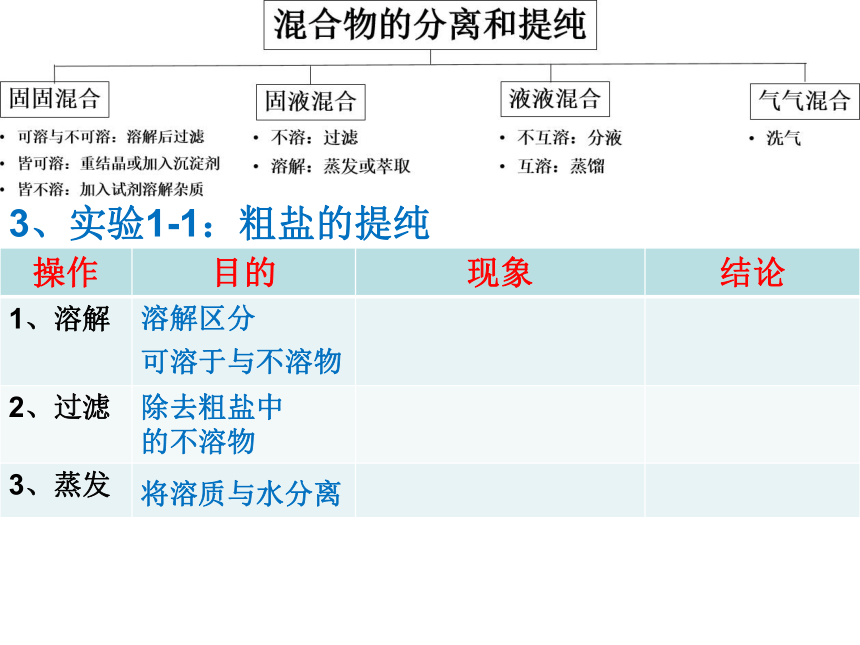
3、应用:实验1-1 粗盐的提纯
(1) 粗盐含有的杂质与粗盐提纯实验的目的:
杂质:泥沙和可溶的CaCl2 、MgCl2和硫酸盐
目的:除去粗盐中不溶的泥沙
(2) 粗盐提纯几步操作?
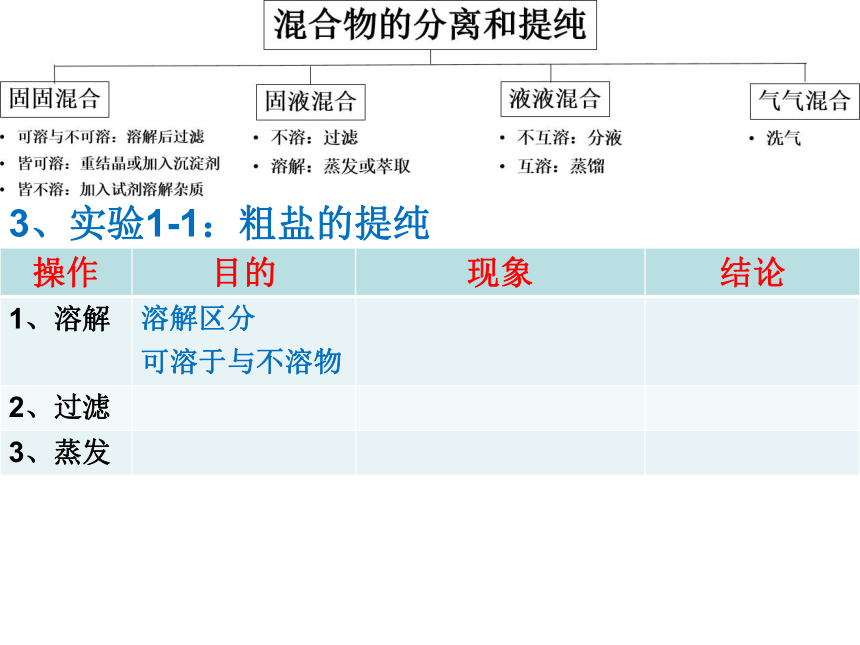
三步。 ①溶解区分可溶于与不溶物, ②过滤可除去不溶物, ③蒸发可将溶质与水分离。3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
(一) 过滤和蒸发
(3) 过滤蒸发后的氯化钠纯净吗?还有什么杂质?
不纯净。
可能含有CaCl2 、MgCl2和一些硫酸盐等。
(4) 用什么方法可以检出该杂质?
要想检出CaCl2主要是检验钙离子的存在,
检出MgCl2主要是检验镁离子的存在,
检出硫酸盐主要是检验硫酸根的存在。4、硫酸根离子(SO42﹣)的检验
(1) SO42﹣通常用什么试剂检验?为什么?
BaCl2溶液。 SO42﹣与Ba+形成的BaSO4?。
(2) 空气中的CO2溶于水形成CO32﹣,如何排除?
会造成干扰,因为BaCO3在水中也是白色沉淀。
可先加稀HCl酸化排除干扰。
(3) 若待测液含有Na2SO4,检验的化学反应方程式
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl 3、实验1-2:SO42-的检验
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
4、硫酸根离子(SO42﹣)的检验
(4) 什么是酸化?滴加BaCl2之前为什么要酸化?
往溶液中加酸使溶液呈酸性。
排除碳酸根离子等的干扰。
(5) 酸化所用的酸怎么选择?
酸化加入的酸不能与原溶液,及检验液中的离子发生反应。5、除去粗盐中的可溶性杂质(课本第7页)
(2) 该如何选择除杂试剂?
除去NaCl中的Na2SO4,Na+与Cl-不算杂质,
SO42-可用Ba2+沉淀,所以应选用BaCl2除去。
5、除去粗盐中的可溶性杂质(课本第7页)
(2) 该如何选择除杂试剂?
除去NaCl中的Na2SO4,Na+与Cl-不算杂质,
SO42-可用Ba2+沉淀,所以应选用BaCl2除去。
5、除去粗盐中的可溶性杂质(课本第7页)
(2) 该如何选择除杂试剂?
除去NaCl中的Na2SO4,Na+与Cl-不算杂质,
SO42-可用Ba2+沉淀,所以应选用BaCl2除去。
5、除去粗盐中的可溶性杂质(课本第7页)
(3) 除杂试剂都会稍加过量,会引入其他离子:
BaCl2引入Ba2+,NaOH引入OH-,Na2CO3引入CO32-。
Ba2+用Na2CO3除去, OH-和CO32-用HCl除去。HCl加热
5、除去粗盐中的可溶性杂质(课本第7页)
(4) 除杂试剂加入的合理顺序:
① BaCl2→NaOH →Na2CO3 →HCl 。
② BaCl2→ Na2CO3 → NaOH →HCl
5、除去粗盐中的可溶性杂质(课本第7页)
(4) 除杂试剂加入的合理顺序:
③ NaOH →BaCl2→ Na2CO3 →HCl。
只要Na2CO3加在BaCl2之后,盐酸最后加入便合理。
【合作运用】
1、提纯含有少量硝酸钡杂质的硝酸钾溶液
A.加入过量碳酸钠溶液,过滤,再加适量硝酸
B.加入过量硫酸钾溶液,过滤,再加适量硝酸
C.加入过量硫酸钠溶液,过滤,再加适量硝酸
D.加入过量碳酸钾溶液,过滤,再加适量硝酸 D【合作运用】
2、粗盐中含有Na2CO3杂质,则下列除杂过程:
①加足量稀盐酸 ②蒸发结晶 ③溶解 ④过滤,
其正确的操作顺序是
A.①②③④
B.④③②①
C.③④①②
D.③①④② D【合作运用】
3、
除去O2中的水蒸气:____
(2) 除去KNO3中的MnO2:_____
(3) 除去CO2中的CO:_____
(4) 除去碘的CCl4溶液中的溶剂:____ 乙甲丁丙丁【当堂作业】
1、除去KNO3中的CaSO4和MgSO4,先溶解,
然后先后加入的试剂顺序正确的是
A.K2CO3、Ba(NO3)2、KOH、HNO3
B.Ba(NO3)2、KOH、HNO3、K2CO3
C.KOH、K2CO3、Ba(NO3)2、HNO3
D.Ba(NO3)2、KOH、K2CO3、HNO3D【当堂作业】
2、从实验室加热KClO3与MnO2的混合物制氧气
后的剩余物中回收MnO2的操作顺序正确的是
A.溶解、过滤、蒸发、洗涤
B.溶解、过滤、洗涤、加热
C.溶解、蒸发、洗涤、过滤
D.溶解、洗涤、过滤、加热B【当堂作业】
3、
(1) 操作①可选择仪器______或 _______。
(2) ②可否改为硝酸钡?________________________
(3) 判断 SO4 2-已除尽的方法是:_________________
(4) ③的目的_____________;加HCl的目_____________;
④的目的是______________。蒸发皿 坩埚 不可,会引入杂质NO3- 滴加BaCl2不产生沉淀除去过量的Ba2+除去过量的CO32-除去过量的HCl谢谢诸位!让我们一起努力将化学变得更美好!
曾垂云团队合作学习 自主管理 先学后教
第一章《从实验学化学》
第一节《化学实验基本方法》二、混合物的分离和提纯
1、分离:
把混合物中的几种物质分开,分别得到纯净物。
提纯:
把混合物中的杂质除去,得到纯净的目标物质。
2、阅读课本第5页,回答为什么要将混合物进行分离和提纯?
物质的研究与利用经常需要的是纯净物。(一) 过滤和蒸发
1、(1) 过滤需要主要仪器:
漏斗、烧杯、玻璃棒、
铁架台、 滤纸。
用过滤实现分离的混合物:
可分离固体和液体的混合物 (一) 过滤和蒸发
1、(2) 过滤口诀:一贴二低三靠 :
“一贴”,滤纸紧贴 漏斗内壁
“二低”,滤纸低于 漏斗口 ,
液体液面低于滤纸边缘
“三靠”,烧杯尖口紧靠 玻璃棒
玻璃棒靠在 三层滤纸 一边,
漏斗下管口靠 烧杯内壁 (一) 过滤和蒸发
2、(1) 蒸发需要的主要仪器:
蒸发皿、铁架台、酒精灯、玻璃棒。
适合用蒸发操提纯的混合物:
固体溶质和溶剂 (一) 过滤和蒸发
2、 (2) 过滤操作有要点 :
a. 液体不超过蒸发皿的 三分之二
b. 加热时,用 玻璃棒 不断搅拌
c. 现较多固体时停止 加热 , 余热 蒸干
d. 未冷却的蒸发皿要放在 石棉网 上 (一) 过滤和蒸发
3、应用:实验1-1 粗盐的提纯
(1) 粗盐含有的杂质与粗盐提纯实验的目的:
杂质:泥沙和可溶的CaCl2 、MgCl2和硫酸盐
目的:除去粗盐中不溶的泥沙
(2) 粗盐提纯几步操作?
三步。 ①溶解区分可溶于与不溶物, ②过滤可除去不溶物, ③蒸发可将溶质与水分离。3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
(一) 过滤和蒸发
(3) 过滤蒸发后的氯化钠纯净吗?还有什么杂质?
不纯净。
可能含有CaCl2 、MgCl2和一些硫酸盐等。
(4) 用什么方法可以检出该杂质?
要想检出CaCl2主要是检验钙离子的存在,
检出MgCl2主要是检验镁离子的存在,
检出硫酸盐主要是检验硫酸根的存在。4、硫酸根离子(SO42﹣)的检验
(1) SO42﹣通常用什么试剂检验?为什么?
BaCl2溶液。 SO42﹣与Ba+形成的BaSO4?。
(2) 空气中的CO2溶于水形成CO32﹣,如何排除?
会造成干扰,因为BaCO3在水中也是白色沉淀。
可先加稀HCl酸化排除干扰。
(3) 若待测液含有Na2SO4,检验的化学反应方程式
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl 3、实验1-2:SO42-的检验
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
3、实验1-1:粗盐的提纯
4、硫酸根离子(SO42﹣)的检验
(4) 什么是酸化?滴加BaCl2之前为什么要酸化?
往溶液中加酸使溶液呈酸性。
排除碳酸根离子等的干扰。
(5) 酸化所用的酸怎么选择?
酸化加入的酸不能与原溶液,及检验液中的离子发生反应。5、除去粗盐中的可溶性杂质(课本第7页)
(2) 该如何选择除杂试剂?
除去NaCl中的Na2SO4,Na+与Cl-不算杂质,
SO42-可用Ba2+沉淀,所以应选用BaCl2除去。
5、除去粗盐中的可溶性杂质(课本第7页)
(2) 该如何选择除杂试剂?
除去NaCl中的Na2SO4,Na+与Cl-不算杂质,
SO42-可用Ba2+沉淀,所以应选用BaCl2除去。
5、除去粗盐中的可溶性杂质(课本第7页)
(2) 该如何选择除杂试剂?
除去NaCl中的Na2SO4,Na+与Cl-不算杂质,
SO42-可用Ba2+沉淀,所以应选用BaCl2除去。
5、除去粗盐中的可溶性杂质(课本第7页)
(3) 除杂试剂都会稍加过量,会引入其他离子:
BaCl2引入Ba2+,NaOH引入OH-,Na2CO3引入CO32-。
Ba2+用Na2CO3除去, OH-和CO32-用HCl除去。HCl加热
5、除去粗盐中的可溶性杂质(课本第7页)
(4) 除杂试剂加入的合理顺序:
① BaCl2→NaOH →Na2CO3 →HCl 。
② BaCl2→ Na2CO3 → NaOH →HCl
5、除去粗盐中的可溶性杂质(课本第7页)
(4) 除杂试剂加入的合理顺序:
③ NaOH →BaCl2→ Na2CO3 →HCl。
只要Na2CO3加在BaCl2之后,盐酸最后加入便合理。
【合作运用】
1、提纯含有少量硝酸钡杂质的硝酸钾溶液
A.加入过量碳酸钠溶液,过滤,再加适量硝酸
B.加入过量硫酸钾溶液,过滤,再加适量硝酸
C.加入过量硫酸钠溶液,过滤,再加适量硝酸
D.加入过量碳酸钾溶液,过滤,再加适量硝酸 D【合作运用】
2、粗盐中含有Na2CO3杂质,则下列除杂过程:
①加足量稀盐酸 ②蒸发结晶 ③溶解 ④过滤,
其正确的操作顺序是
A.①②③④
B.④③②①
C.③④①②
D.③①④② D【合作运用】
3、
除去O2中的水蒸气:____
(2) 除去KNO3中的MnO2:_____
(3) 除去CO2中的CO:_____
(4) 除去碘的CCl4溶液中的溶剂:____ 乙甲丁丙丁【当堂作业】
1、除去KNO3中的CaSO4和MgSO4,先溶解,
然后先后加入的试剂顺序正确的是
A.K2CO3、Ba(NO3)2、KOH、HNO3
B.Ba(NO3)2、KOH、HNO3、K2CO3
C.KOH、K2CO3、Ba(NO3)2、HNO3
D.Ba(NO3)2、KOH、K2CO3、HNO3D【当堂作业】
2、从实验室加热KClO3与MnO2的混合物制氧气
后的剩余物中回收MnO2的操作顺序正确的是
A.溶解、过滤、蒸发、洗涤
B.溶解、过滤、洗涤、加热
C.溶解、蒸发、洗涤、过滤
D.溶解、洗涤、过滤、加热B【当堂作业】
3、
(1) 操作①可选择仪器______或 _______。
(2) ②可否改为硝酸钡?________________________
(3) 判断 SO4 2-已除尽的方法是:_________________
(4) ③的目的_____________;加HCl的目_____________;
④的目的是______________。蒸发皿 坩埚 不可,会引入杂质NO3- 滴加BaCl2不产生沉淀除去过量的Ba2+除去过量的CO32-除去过量的HCl谢谢诸位!让我们一起努力将化学变得更美好!
