【全国百强校】海南省国兴中学高中化学必修一课件:1-2-2 气体摩尔体积 (共29张PPT)
文档属性
| 名称 | 【全国百强校】海南省国兴中学高中化学必修一课件:1-2-2 气体摩尔体积 (共29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-27 17:06:30 | ||
图片预览



文档简介
课件29张PPT。1-2-2 气体摩尔体积 阿伏加德罗定律海南省国兴中学
曾垂云团队合作学习 自主管理 先学后教
第一章《从实验学化学》
第二节《化学计量在实验中的应用》【学习目标】
1、掌握气体摩尔体积的概念与简单计算;
2、了解阿伏加德罗定律;
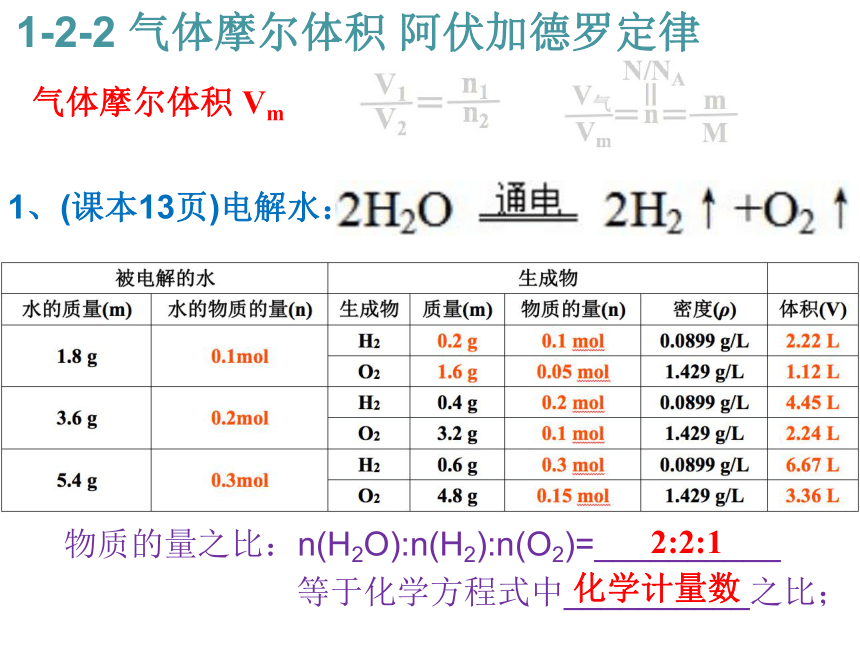
3、能对气体物质的N、n、V气、m进行综合计算。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律1、(课本13页)电解水:
物质的量之比:n(H2O):n(H2):n(O2)=__________
等于化学方程式中__________之比; 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律2:2:1 化学计量数 1、(课本13页)电解水:
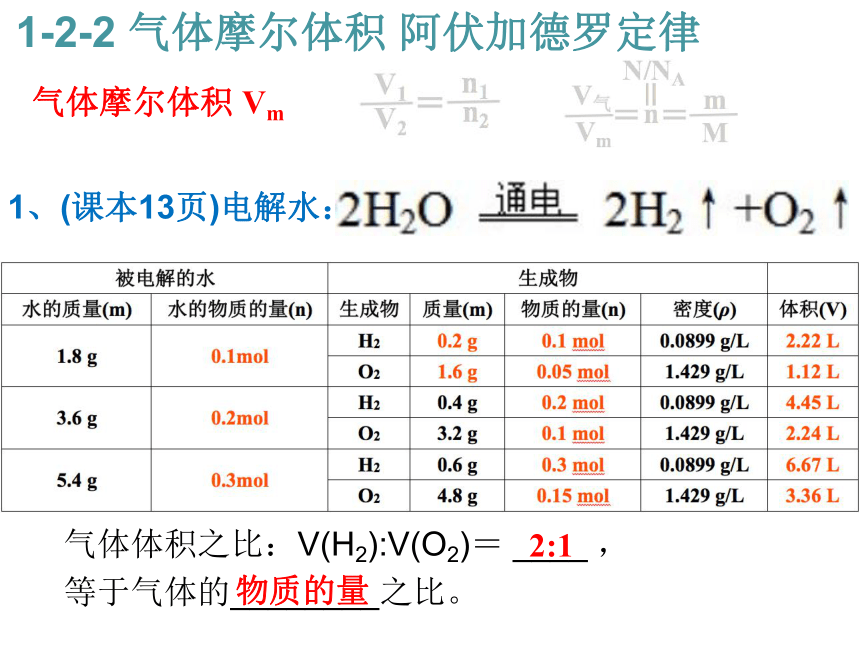
气体体积之比:V(H2):V(O2)= ____ ,
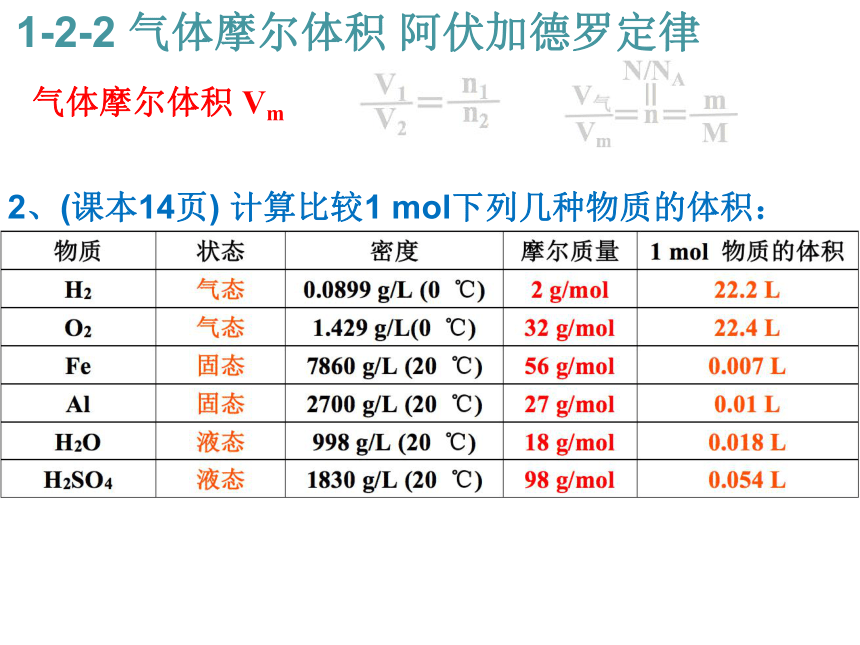
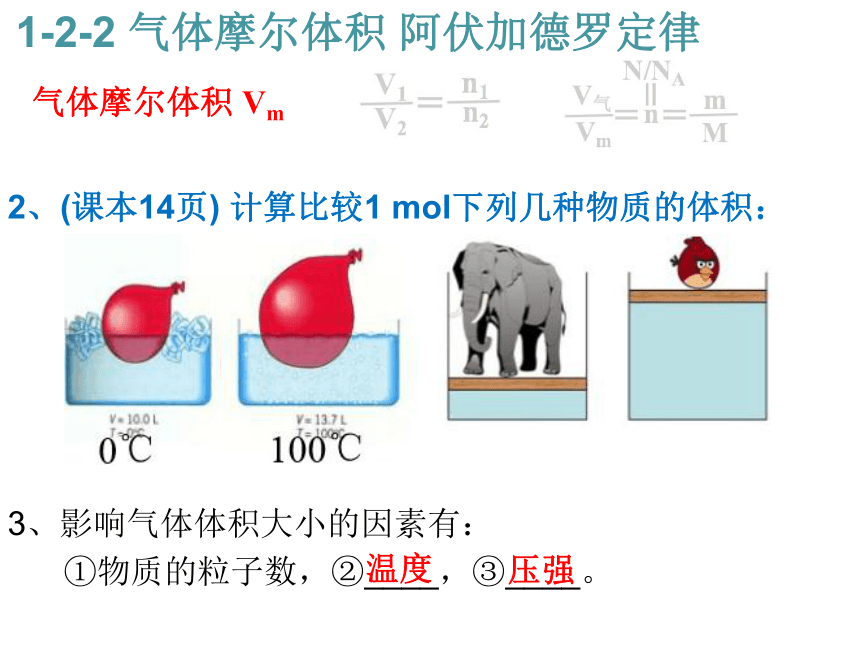
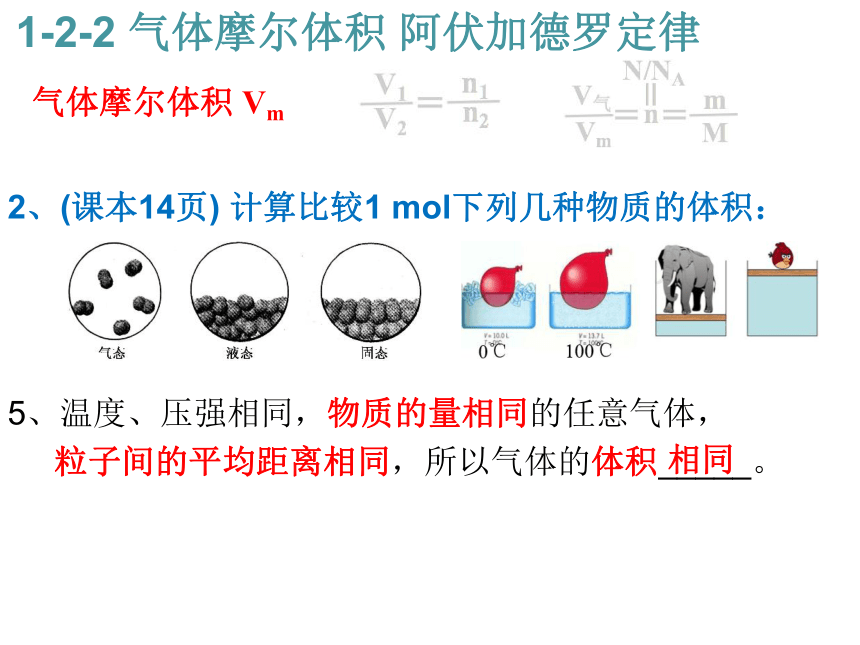
等于气体的________之比。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律2:1 物质的量 2、(课本14页) 计算比较1 mol下列几种物质的体积:
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律2、(课本14页) 计算比较1 mol下列几种物质的体积:
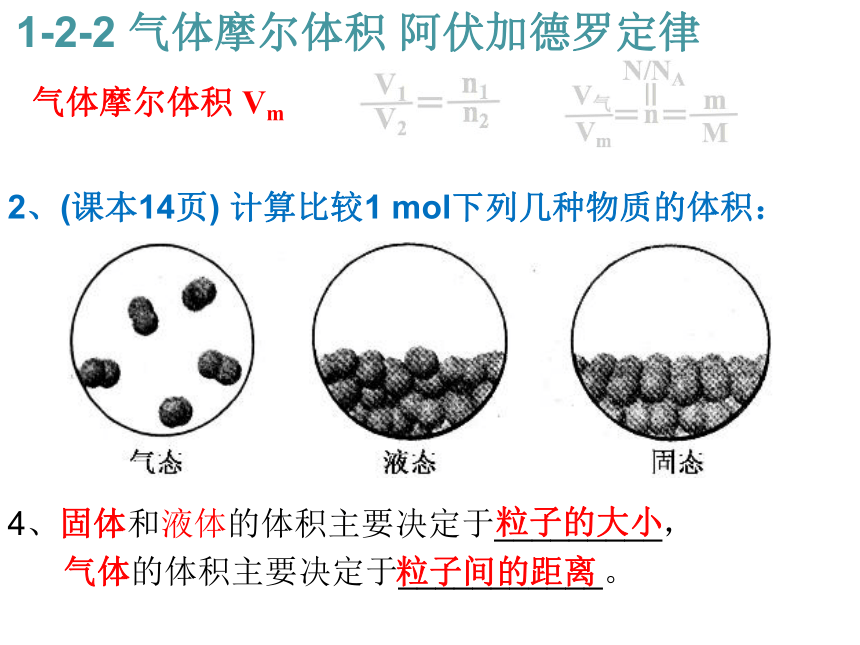
4、固体和液体的体积主要决定于_________,
气体的体积主要决定于___________。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律粒子的大小 粒子间的距离 2、(课本14页) 计算比较1 mol下列几种物质的体积:
3、影响气体体积大小的因素有:
①物质的粒子数,②____,③____。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律温度 压强 2、(课本14页) 计算比较1 mol下列几种物质的体积:
5、温度、压强相同,物质的量相同的任意气体,
粒子间的平均距离相同,所以气体的体积_____。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律相同 6、气体摩尔体积:单位物质的量的气体所占的体积
叫做气体摩尔体积,符号Vm,单位L·mol-1。
(1) 单位物质的量:即1 mol,所以气体摩尔体积,
可以理解为___ mol气体所占的体积。
(2) 气体摩尔体积:即只适用于气体,包括混合气体。
温度、压强相同,任意气体分子间的_____相同,
所以物质的量相同的任意气体,_____也相同。 7、标准状态(0 ℃,101 kPa)下,
1 mol任意气体所占的体积均为_________ ,
所以标准状况时,气体摩尔体积约为__________。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律1 距离 体积 22.4 L 22.4 L/mol8、气体体积(V)、物质的量(N)、摩尔体积(Vm)的关系思考:① 什么是标准状况:_____________
② 标准状况下,0.2 mol H2与0.8 mol O2
混合气体的体积是_______
③ 标准状况下,1 mol H2O的体积是22.4 L吗?
不是,标准状况下水为固态。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律5.6 L 11.2 L 22.4 L 33.6 L 44.8 L 67.2 L 0 ℃,101 kPa 22.4 L 8、气体体积(V)、物质的量(N)、摩尔体积(Vm)的关系12、标准状况下:
(1) 44.8 L H2的物质的量是多少?
n=V/Vm= 44.8 L ÷ 22.4 L/mol = 2 mol
(2) 0.5 mol CO的体积是多少?
V=nVm= 0.5 mol × 22.4 L/mol = 11.2 L气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律5.6 L 11.2 L 22.4 L 33.6 L 44.8 L 67.2 L 9、下列说法是否正确?
(1) 1 mol 氢气的体积约为 22.4 L。
(2) 标准状况下,1 mol 任何物质的体积都约为 22.4 L。
(3) 标准状况下,1 mol O2和N2混合的体积约为 22.4 L。
(4) 任何条件下,气体摩尔体积都是 22.4 L/mol。
(5) 标准状况下,6.02×1023个Cu原子体积约为 22.4 L。
(6) 1 mol 某气体体积为 22.4 L,该气体处于标准状况。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律× × √ × × × 10、阿伏加德罗定律:
同温同压下,相同体积的任何气体都含有相同的粒子数。
即同温同压时,气体的体积之比等于其物质的量之比。
思考:标准状况下,0.2 mol H2与0.8 mol O2的混合气体
① H2与O2的物质的量之比是________
② H2与O2的体积之比是________
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律1:4 1:4 10、阿伏加德罗定律:
同温同压下,相同体积的任何气体都含有相同的粒子数。
即同温同压时,气体的体积之比等于其物质的量之比。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律11、标准状况时,气体物质的粒子数(N)、物质的量(n)、
体积(V)、质量(m)之间的关系
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律11、标准状况时,气体物质的粒子数(N)、物质的量(n)、
体积(V)、质量(m)之间的关系
12、标准状况下:
(3) 1.12 L H2的有多少个H2分子?多少个H原子?
n=V/Vm= 1.12 L ÷ 22.4 L/mol = 0.05 mol
H2分子:N=nNA= 0.05 mol×6.02×1023 mol-1 = 3.01×1022
H原子: 3.01×1022×2 = 6.02×1022
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律11、标准状况时,气体物质的粒子数(N)、物质的量(n)、
体积(V)、质量(m)之间的关系
12、标准状况下:
(4) CO的密度是多少?
1 mol CO的质量为28 g,体积为22.4 L;
所以ρ(CO)=M/Vm
= 28 g/mol ÷ 22.4 L/mol
= 1.25 g/L。气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律11、标准状况时,气体物质的粒子数(N)、物质的量(n)、
体积(V)、质量(m)之间的关系气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【学习目标】
1、掌握气体摩尔体积的概念与简单计算;
2、了解阿伏加德罗定律;
3、能对气体物质的N、n、V气、m进行综合计算。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【合作运用】
13.(2分) 判断题
(1) 9.8 g H2SO4含有6.02×1023个H2SO4分子
(2) 氢气在标准状况下的体积为22.4 L
(3) CaCO3的摩尔质量是100 g
(4) 物质的量就是物质的质量
(5) 6.02×1022个H2SO4分子的质量是9.8 g
(6) 1 mol H2和1 mol O2的体积相等
(7) 1 mol H2O的质量是18 g/mol
(8) 标准状况下,水的摩尔体积是22.4 L/mol气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律× × × × √ × × × 【合作运用】
14.(3分) 标况15.6 g CO与CO2的混合,体积11.2 L。
设混合气体中,CO x mol,CO2 y mol。
则有 28x + 44y = 15.6 解得
22.4x + 22.4y = 11.2 x = 0.4 y = 0.1
(1) 混合气体的密度是_________________________
(2) 混合气体的平均摩尔质量是__________________
(3) CO2和CO的物质的量之比是___
(4) CO的物质的量分数是____________
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律15.6 g ÷ 11.2 L = 1.39 g/L M=m/n=15.6g÷(0.1+0.4)mol
=31.2 g/mol 1:480%【合作运用】
14.(3分) 标况15.6 g CO与CO2的混合,体积11.2 L。
设混合气体中,CO x mol,CO2 y mol。
则有 28x + 44y = 15.6 解得
22.4x + 22.4y = 11.2 x = 0.4 y = 0.1
(5) CO2和CO的体积之比是_______
(6) CO的体积分数是____________
(7) 混合气体O原子的物质的量是__________________
(8) 混合气体C原子的物质的量是__________________气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律1:480%(0.4+ 0.1×2) mol=0.6 mol (0.4+ 0.1) mol=0.5 mol 【当堂作业】
15.(2分) 物质的量是连接微观粒子和宏观物质的桥梁 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【当堂作业】
15.(2分) 物质的量是连接微观粒子和宏观物质的桥梁 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律6.02×1023 6.02×1023 1.806×1024 1 3 17 22.4 【当堂作业】
16.(2分) 标准状况下,电解水0.18 g,
你能算成生成的H2和O2的体积吗?
被电解的水的物质的量是多少?
n(H2O)=m/M= 0.18 g ÷ 18 g/mol = 0.01 mol
2 2 1
0.01 mol 0.01 mol 0.005 mol
∴ V(H2)=nVm=0.01mol×22.4L/mol= 0.224 L= 224 mL
V(O2)=nVm=0.005 mol×22.4L/mol=0.112L=112 mL 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【当堂作业】
17.(1分) 瓦斯中甲烷(CH4)与氧气的质量比为1:4时
极易爆炸,此时甲烷与氧气的体积比为_______;
请计算标准状况时,甲烷的密度为__________。气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【当堂作业】
17.(1分) 瓦斯中甲烷(CH4)与氧气的质量比为1:4时
极易爆炸,此时甲烷与氧气的体积比为_______;
请计算标准状况时,甲烷的密度为__________。
解:设甲烷的质量为m,则氧气的质量为4m
V甲烷=nVm=(m/M)Vm= m ÷ 16 g/mol× 22.4 L/mol
V氧气=nVm=(m/M)Vm= 4m ÷ 32 g/mol× 22.4 L/mol
V甲烷 :V氧气 = (m÷18×22.4):(4÷32×22.4) = 1:2
ρ甲烷 = M甲烷 / Vm = 16 g/mol ÷ 22.4 L/mol = 0.714 g/L 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律谢谢诸位!让我们一起努力将化学变得更美好!
曾垂云团队合作学习 自主管理 先学后教
第一章《从实验学化学》
第二节《化学计量在实验中的应用》【学习目标】
1、掌握气体摩尔体积的概念与简单计算;
2、了解阿伏加德罗定律;
3、能对气体物质的N、n、V气、m进行综合计算。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律1、(课本13页)电解水:
物质的量之比:n(H2O):n(H2):n(O2)=__________
等于化学方程式中__________之比; 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律2:2:1 化学计量数 1、(课本13页)电解水:
气体体积之比:V(H2):V(O2)= ____ ,
等于气体的________之比。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律2:1 物质的量 2、(课本14页) 计算比较1 mol下列几种物质的体积:
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律2、(课本14页) 计算比较1 mol下列几种物质的体积:
4、固体和液体的体积主要决定于_________,
气体的体积主要决定于___________。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律粒子的大小 粒子间的距离 2、(课本14页) 计算比较1 mol下列几种物质的体积:
3、影响气体体积大小的因素有:
①物质的粒子数,②____,③____。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律温度 压强 2、(课本14页) 计算比较1 mol下列几种物质的体积:
5、温度、压强相同,物质的量相同的任意气体,
粒子间的平均距离相同,所以气体的体积_____。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律相同 6、气体摩尔体积:单位物质的量的气体所占的体积
叫做气体摩尔体积,符号Vm,单位L·mol-1。
(1) 单位物质的量:即1 mol,所以气体摩尔体积,
可以理解为___ mol气体所占的体积。
(2) 气体摩尔体积:即只适用于气体,包括混合气体。
温度、压强相同,任意气体分子间的_____相同,
所以物质的量相同的任意气体,_____也相同。 7、标准状态(0 ℃,101 kPa)下,
1 mol任意气体所占的体积均为_________ ,
所以标准状况时,气体摩尔体积约为__________。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律1 距离 体积 22.4 L 22.4 L/mol8、气体体积(V)、物质的量(N)、摩尔体积(Vm)的关系思考:① 什么是标准状况:_____________
② 标准状况下,0.2 mol H2与0.8 mol O2
混合气体的体积是_______
③ 标准状况下,1 mol H2O的体积是22.4 L吗?
不是,标准状况下水为固态。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律5.6 L 11.2 L 22.4 L 33.6 L 44.8 L 67.2 L 0 ℃,101 kPa 22.4 L 8、气体体积(V)、物质的量(N)、摩尔体积(Vm)的关系12、标准状况下:
(1) 44.8 L H2的物质的量是多少?
n=V/Vm= 44.8 L ÷ 22.4 L/mol = 2 mol
(2) 0.5 mol CO的体积是多少?
V=nVm= 0.5 mol × 22.4 L/mol = 11.2 L气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律5.6 L 11.2 L 22.4 L 33.6 L 44.8 L 67.2 L 9、下列说法是否正确?
(1) 1 mol 氢气的体积约为 22.4 L。
(2) 标准状况下,1 mol 任何物质的体积都约为 22.4 L。
(3) 标准状况下,1 mol O2和N2混合的体积约为 22.4 L。
(4) 任何条件下,气体摩尔体积都是 22.4 L/mol。
(5) 标准状况下,6.02×1023个Cu原子体积约为 22.4 L。
(6) 1 mol 某气体体积为 22.4 L,该气体处于标准状况。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律× × √ × × × 10、阿伏加德罗定律:
同温同压下,相同体积的任何气体都含有相同的粒子数。
即同温同压时,气体的体积之比等于其物质的量之比。
思考:标准状况下,0.2 mol H2与0.8 mol O2的混合气体
① H2与O2的物质的量之比是________
② H2与O2的体积之比是________
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律1:4 1:4 10、阿伏加德罗定律:
同温同压下,相同体积的任何气体都含有相同的粒子数。
即同温同压时,气体的体积之比等于其物质的量之比。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律11、标准状况时,气体物质的粒子数(N)、物质的量(n)、
体积(V)、质量(m)之间的关系
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律11、标准状况时,气体物质的粒子数(N)、物质的量(n)、
体积(V)、质量(m)之间的关系
12、标准状况下:
(3) 1.12 L H2的有多少个H2分子?多少个H原子?
n=V/Vm= 1.12 L ÷ 22.4 L/mol = 0.05 mol
H2分子:N=nNA= 0.05 mol×6.02×1023 mol-1 = 3.01×1022
H原子: 3.01×1022×2 = 6.02×1022
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律11、标准状况时,气体物质的粒子数(N)、物质的量(n)、
体积(V)、质量(m)之间的关系
12、标准状况下:
(4) CO的密度是多少?
1 mol CO的质量为28 g,体积为22.4 L;
所以ρ(CO)=M/Vm
= 28 g/mol ÷ 22.4 L/mol
= 1.25 g/L。气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律11、标准状况时,气体物质的粒子数(N)、物质的量(n)、
体积(V)、质量(m)之间的关系气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【学习目标】
1、掌握气体摩尔体积的概念与简单计算;
2、了解阿伏加德罗定律;
3、能对气体物质的N、n、V气、m进行综合计算。 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【合作运用】
13.(2分) 判断题
(1) 9.8 g H2SO4含有6.02×1023个H2SO4分子
(2) 氢气在标准状况下的体积为22.4 L
(3) CaCO3的摩尔质量是100 g
(4) 物质的量就是物质的质量
(5) 6.02×1022个H2SO4分子的质量是9.8 g
(6) 1 mol H2和1 mol O2的体积相等
(7) 1 mol H2O的质量是18 g/mol
(8) 标准状况下,水的摩尔体积是22.4 L/mol气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律× × × × √ × × × 【合作运用】
14.(3分) 标况15.6 g CO与CO2的混合,体积11.2 L。
设混合气体中,CO x mol,CO2 y mol。
则有 28x + 44y = 15.6 解得
22.4x + 22.4y = 11.2 x = 0.4 y = 0.1
(1) 混合气体的密度是_________________________
(2) 混合气体的平均摩尔质量是__________________
(3) CO2和CO的物质的量之比是___
(4) CO的物质的量分数是____________
气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律15.6 g ÷ 11.2 L = 1.39 g/L M=m/n=15.6g÷(0.1+0.4)mol
=31.2 g/mol 1:480%【合作运用】
14.(3分) 标况15.6 g CO与CO2的混合,体积11.2 L。
设混合气体中,CO x mol,CO2 y mol。
则有 28x + 44y = 15.6 解得
22.4x + 22.4y = 11.2 x = 0.4 y = 0.1
(5) CO2和CO的体积之比是_______
(6) CO的体积分数是____________
(7) 混合气体O原子的物质的量是__________________
(8) 混合气体C原子的物质的量是__________________气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律1:480%(0.4+ 0.1×2) mol=0.6 mol (0.4+ 0.1) mol=0.5 mol 【当堂作业】
15.(2分) 物质的量是连接微观粒子和宏观物质的桥梁 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【当堂作业】
15.(2分) 物质的量是连接微观粒子和宏观物质的桥梁 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律6.02×1023 6.02×1023 1.806×1024 1 3 17 22.4 【当堂作业】
16.(2分) 标准状况下,电解水0.18 g,
你能算成生成的H2和O2的体积吗?
被电解的水的物质的量是多少?
n(H2O)=m/M= 0.18 g ÷ 18 g/mol = 0.01 mol
2 2 1
0.01 mol 0.01 mol 0.005 mol
∴ V(H2)=nVm=0.01mol×22.4L/mol= 0.224 L= 224 mL
V(O2)=nVm=0.005 mol×22.4L/mol=0.112L=112 mL 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【当堂作业】
17.(1分) 瓦斯中甲烷(CH4)与氧气的质量比为1:4时
极易爆炸,此时甲烷与氧气的体积比为_______;
请计算标准状况时,甲烷的密度为__________。气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律【当堂作业】
17.(1分) 瓦斯中甲烷(CH4)与氧气的质量比为1:4时
极易爆炸,此时甲烷与氧气的体积比为_______;
请计算标准状况时,甲烷的密度为__________。
解:设甲烷的质量为m,则氧气的质量为4m
V甲烷=nVm=(m/M)Vm= m ÷ 16 g/mol× 22.4 L/mol
V氧气=nVm=(m/M)Vm= 4m ÷ 32 g/mol× 22.4 L/mol
V甲烷 :V氧气 = (m÷18×22.4):(4÷32×22.4) = 1:2
ρ甲烷 = M甲烷 / Vm = 16 g/mol ÷ 22.4 L/mol = 0.714 g/L 气体摩尔体积 Vm 1-2-2 气体摩尔体积 阿伏加德罗定律谢谢诸位!让我们一起努力将化学变得更美好!
