【全国百强校】海南省国兴中学高中化学必修一课件:2-3-2 氧化剂和还原剂 (共21张PPT)
文档属性
| 名称 | 【全国百强校】海南省国兴中学高中化学必修一课件:2-3-2 氧化剂和还原剂 (共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 382.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-27 17:09:52 | ||
图片预览





文档简介
课件21张PPT。2-3-2 氧化剂和还原剂海南省国兴中学
曾垂云团队合作学习 自主管理 先学后教
第二章《化学物质及其变化》
第二节《离子反应》【学习目标】
1、掌握氧化剂、还原剂的概念及判断方法 ;
2、理解并应用口诀:升失氧化还原剂。
升失氧化还原剂 2-3-2 氧化剂和还原剂(一) 氧化剂和还原剂 1、H2、CO是常用的还原剂,具有还原性:
① 2CuO + C 2Cu + CO2↑
② CuO + H2 Cu+H2O↑
还原剂(具有_____性)→化合价_____
→ _____电子 →被_____ →发生_____反应
O2是最常见的氧化剂,有较强的氧化性:
③ 2H2 + O2 2H2O ④ C + O2 CO2
氧化剂(具有_____性)→化合价_____
→ _____电子 →被_____ →发生_____反应2-3-2 氧化剂和还原剂升失氧化还原剂 0 +4 0 +1 还原 升高 失去 氧化 氧化 0 -2 0 -2 氧化 降低 得到 还原 还原 (一) 氧化剂和还原剂
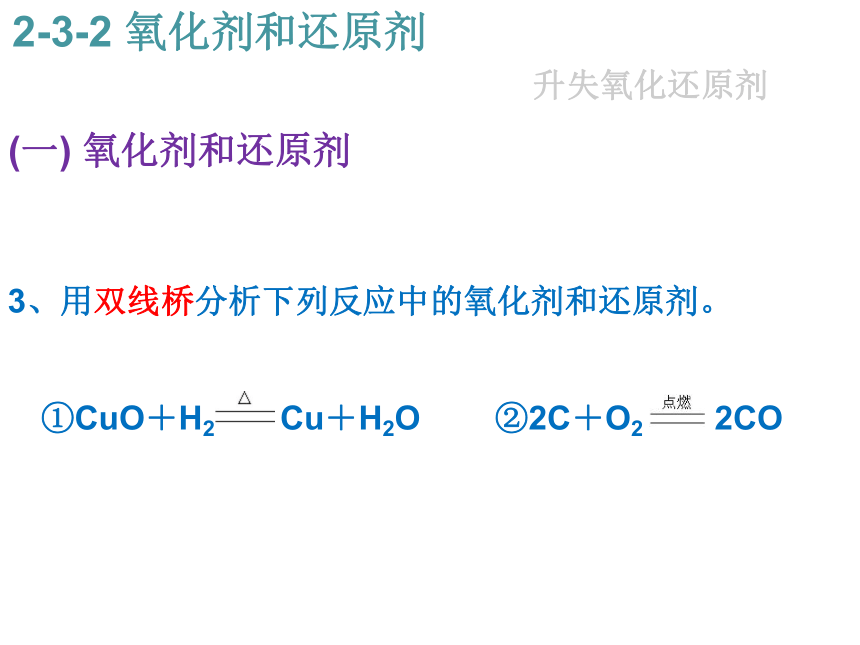
3、用双线桥分析下列反应中的氧化剂和还原剂。
?
①CuO+H2 Cu+H2O ②2C+O2 2CO
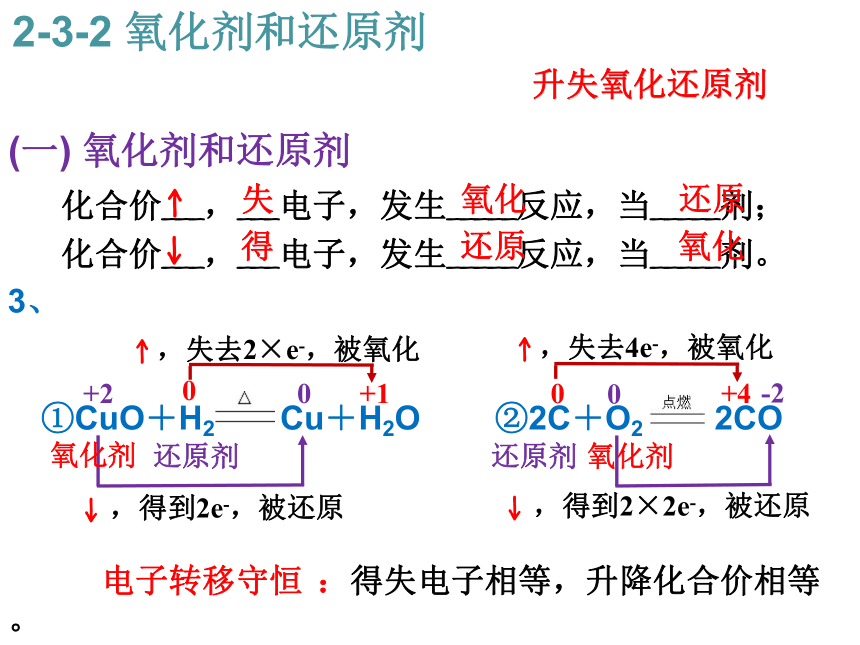
2-3-2 氧化剂和还原剂升失氧化还原剂 (一) 氧化剂和还原剂 化合价___,___电子,发生_____反应,当_____剂;
化合价___,___电子,发生_____反应,当_____剂。
3、
?
①CuO+H2 Cu+H2O ②2C+O2 2CO
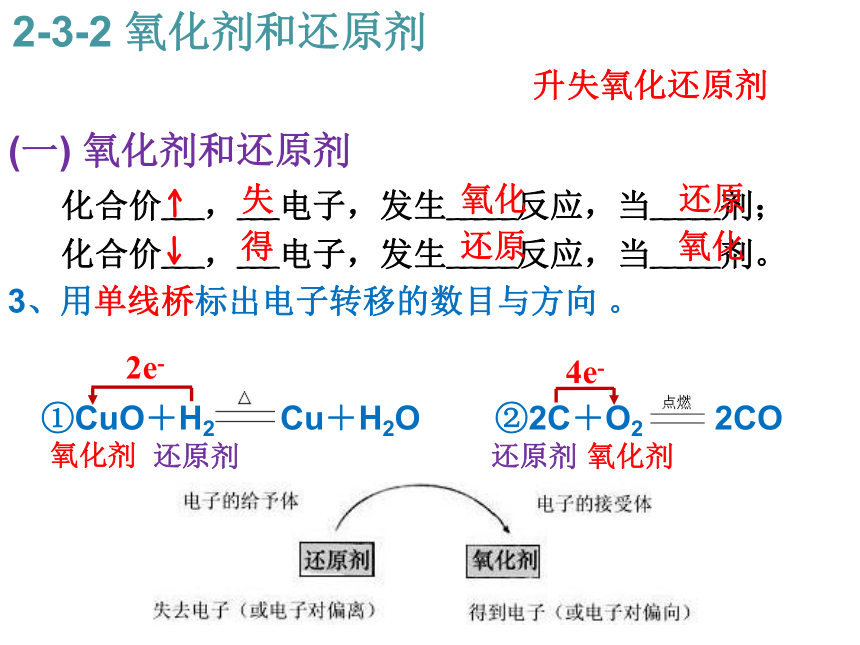
电子转移守恒 :得失电子相等,升降化合价相等。2-3-2 氧化剂和还原剂升失氧化还原剂 0+2+10↑ ,失去2×e-,被氧化 ↓ ,得到2e-,被还原 还原剂 氧化剂 00+4-2↑ ,失去4e-,被氧化 ↓ ,得到2×2e-,被还原 还原剂 氧化剂 ↑ 失 氧化 还原 ↓ 得 还原 氧化 升失氧化还原剂 (一) 氧化剂和还原剂 化合价___,___电子,发生_____反应,当_____剂;
化合价___,___电子,发生_____反应,当_____剂。
3、用单线桥标出电子转移的数目与方向 。
?
①CuO+H2 Cu+H2O ②2C+O2 2CO
2-3-2 氧化剂和还原剂升失氧化还原剂 还原剂 氧化剂 还原剂 氧化剂 ↑ 失 氧化 还原 ↓ 得 还原 氧化 2e-4e-(二) 氧化剂和还原剂相互依存,缺一不可 5、下列变化需要加入某种还原剂才能实现的是
A.Cl-→Cl2 B.H2→HCl
C.CaCl2→CaCO3 D.Fe3+→Fe2+
6、下列哪个变化中,,需要加入合适的氧化剂才能实现
A.氯化氢→氢气 HCl → H2
B.二氧化碳→一氧化碳 CO2 → CO
C.氯化铁→氯化亚铁 FeCl3 → FeCl2
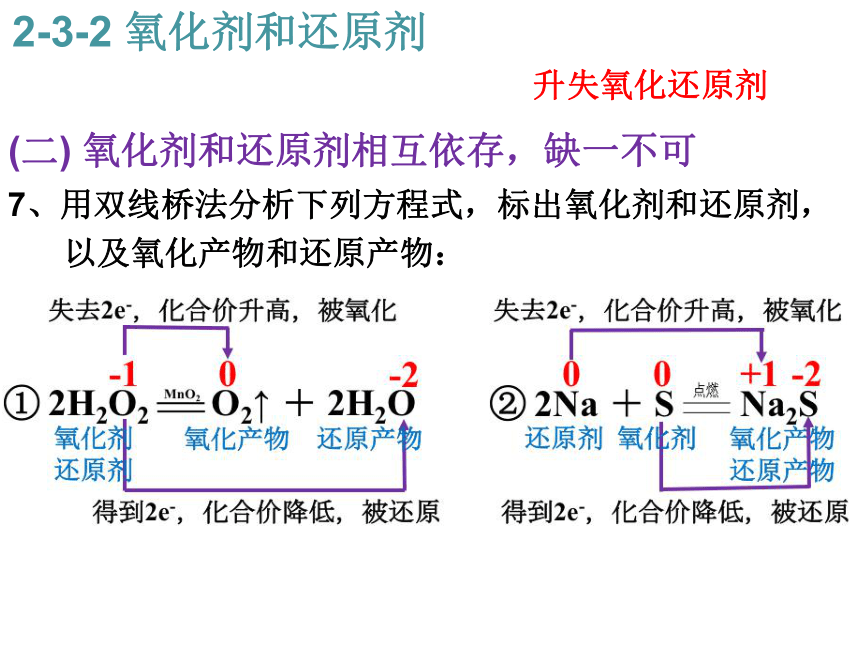
D.二氧化硫→三氧化硫 SO2 → SO32-3-2 氧化剂和还原剂升失氧化还原剂 -10↑ 还原剂 0+1+2+2↓ 氧化剂 ↑ 还原剂 +10↓ 氧化剂 +4+2↓ 氧化剂 +3+2↓ 氧化剂 +4+6↑ 还原剂 (二) 氧化剂和还原剂相互依存,缺一不可 7、用双线桥法分析下列方程式,标出氧化剂和还原剂,
以及氧化产物和还原产物:
① 2H2O2 O2↑ + 2H2O
② 2Na + S Na2S
③ S + O2 SO22-3-2 氧化剂和还原剂升失氧化还原剂 (二) 氧化剂和还原剂相互依存,缺一不可 7、用双线桥法分析下列方程式,标出氧化剂和还原剂,
以及氧化产物和还原产物:
2-3-2 氧化剂和还原剂升失氧化还原剂 (二) 氧化剂和还原剂相互依存,缺一不可 7、用双线桥法分析下列方程式,标出氧化剂和还原剂,
以及氧化产物和还原产物:
2-3-2 氧化剂和还原剂升失氧化还原剂 (三) 氧化还原反应在生产和生活中的应用
常见的氧化性物质:
O2、Cl2、浓H2SO4、HNO3、KMnO4、FeCl3等
常见的还原性物质:
Al、Zn、Fe、C、H2、CO等2-3-2 氧化剂和还原剂升失氧化还原剂 化合价容易降低 +6 +5 +7 +3 化合价容易升高 【合作运用】11.请用单线桥法分析下面化学方程式,
标出氧化剂、还原剂及氧化产物、还原产物:
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
(1) H元素的化合价由__价降低为__价,降低了__价,
H化合价降低的总数为__,6个H+得到电子数为__。
(2) Al元素化合价升高总数为__,2个Al原子失去电子
总数为_____。本反应转移的电子数为______。
(3) 有1 mol Al参加了反应,则氢元素得到__mol e﹣,
生成标准状态下的H2 ______L
2-3-2 氧化剂和还原剂【合作运用】11.请用单线桥法分析下面化学方程式,
标出氧化剂、还原剂及氧化产物、还原产物:
(1) H元素的化合价由__价降低为__价,降低了__价,
H化合价降低的总数为__,6个H+得到电子数为__。
(2) Al元素化合价升高总数为__,2个Al原子失去电子
总数为___。本反应转移的电子数为______。
(3) 有1 mol Al参加了反应,则氢元素得到__mol e﹣,
生成标准状态下的H2 ______L
2-3-2 氧化剂和还原剂+1 0 1 6 6 6 6 6 3 1.5 mol 33.6 【合作运用】8.实现下列变化需要加入氧化剂的是
A.NaOH→NaCl B.H2SO4→H2
C.HCl→Cl2 D.CaCO3→CO2
9.化学反应H2SO3 + I2 + H2O = 2HI + H2SO4 ,
以下说法正确的是
A.H2SO4是氧化剂
B.HI是氧化剂
C.H2O是还原剂
D.H2SO3是还原剂
C 2-3-2 氧化剂和还原剂D 10.在下列反应中,
水既不作氧化剂,又不作还原剂的是
A.2Na + 2H2O = 2NaOH + H2↑
B.Na2O + H2O = 2NaOH
C.H2O H2↑ + O2↑
D.C + H2O CO + H2B 2-3-2 氧化剂和还原剂【合作运用】12.下列叙述中正确的是
A.反应中化合价降低的物质是还原剂
B.有氧元素参加的反应一定是氧化还原反应
C.反应前后元素化合价没有变化的反应
一定不是氧化还原反应
D.氧化剂在反应中被氧化,还原剂在反应中被还原
【当堂作业】2-3-2 氧化剂和还原剂C 13.阿波罗宇宙飞船以 N2H4(联氨)和N2O4为推力源,
反应温度达 2700℃,反应式为
2N2H4 + N2O4 = 3N2 + 4H2O
关于该反应的说法中正确的是
A.属于置换反应
B.联氨是氧化剂
C.联氨是还原剂
D.氮气是氧化剂,也是还原剂
【当堂作业】2-3-2 氧化剂和还原剂C 14.氧化还原反应
3S + 6KOH K2SO3 + 2K2S + 3H2O
被氧化与被还原的硫原子个数比为
A.1∶2 B.2∶1 C.1∶1 D.3∶2
2-3-2 氧化剂和还原剂A 15.请用单线桥法分析下面化学方程式,
标出氧化剂、还原剂及氧化产物、还原产物:
?
Fe2(SO4)3 + H2SO3 + H2O = 2FeSO4 +2H2SO4
?
(1) 写出该反应的离子方程式:
(2) 此反应是否符合复分解型离子反应的条件?
(3) 请你再重新总结离子反应发生的条件。
2-3-2 氧化剂和还原剂15.请用单线桥法分析下面化学方程式,
标出氧化剂、还原剂及氧化产物、还原产物:
?
?
(1) 写出该反应的离子方程式:
2Fe3+ + SO32- + H2O = 2Fe2+ + 2H+ + SO42-
(2) 此反应是否符合复分解型离子反应的条件?
不符合,没有生成沉淀、气体和水。
(3) 请你再重新总结离子反应发生的条件。
有沉淀、气体和水生成或发生氧化还原反应。
2-3-2 氧化剂和还原剂谢谢诸位!让我们一起努力将化学变得更美好!
曾垂云团队合作学习 自主管理 先学后教
第二章《化学物质及其变化》
第二节《离子反应》【学习目标】
1、掌握氧化剂、还原剂的概念及判断方法 ;
2、理解并应用口诀:升失氧化还原剂。
升失氧化还原剂 2-3-2 氧化剂和还原剂(一) 氧化剂和还原剂 1、H2、CO是常用的还原剂,具有还原性:
① 2CuO + C 2Cu + CO2↑
② CuO + H2 Cu+H2O↑
还原剂(具有_____性)→化合价_____
→ _____电子 →被_____ →发生_____反应
O2是最常见的氧化剂,有较强的氧化性:
③ 2H2 + O2 2H2O ④ C + O2 CO2
氧化剂(具有_____性)→化合价_____
→ _____电子 →被_____ →发生_____反应2-3-2 氧化剂和还原剂升失氧化还原剂 0 +4 0 +1 还原 升高 失去 氧化 氧化 0 -2 0 -2 氧化 降低 得到 还原 还原 (一) 氧化剂和还原剂
3、用双线桥分析下列反应中的氧化剂和还原剂。
?
①CuO+H2 Cu+H2O ②2C+O2 2CO
2-3-2 氧化剂和还原剂升失氧化还原剂 (一) 氧化剂和还原剂 化合价___,___电子,发生_____反应,当_____剂;
化合价___,___电子,发生_____反应,当_____剂。
3、
?
①CuO+H2 Cu+H2O ②2C+O2 2CO
电子转移守恒 :得失电子相等,升降化合价相等。2-3-2 氧化剂和还原剂升失氧化还原剂 0+2+10↑ ,失去2×e-,被氧化 ↓ ,得到2e-,被还原 还原剂 氧化剂 00+4-2↑ ,失去4e-,被氧化 ↓ ,得到2×2e-,被还原 还原剂 氧化剂 ↑ 失 氧化 还原 ↓ 得 还原 氧化 升失氧化还原剂 (一) 氧化剂和还原剂 化合价___,___电子,发生_____反应,当_____剂;
化合价___,___电子,发生_____反应,当_____剂。
3、用单线桥标出电子转移的数目与方向 。
?
①CuO+H2 Cu+H2O ②2C+O2 2CO
2-3-2 氧化剂和还原剂升失氧化还原剂 还原剂 氧化剂 还原剂 氧化剂 ↑ 失 氧化 还原 ↓ 得 还原 氧化 2e-4e-(二) 氧化剂和还原剂相互依存,缺一不可 5、下列变化需要加入某种还原剂才能实现的是
A.Cl-→Cl2 B.H2→HCl
C.CaCl2→CaCO3 D.Fe3+→Fe2+
6、下列哪个变化中,,需要加入合适的氧化剂才能实现
A.氯化氢→氢气 HCl → H2
B.二氧化碳→一氧化碳 CO2 → CO
C.氯化铁→氯化亚铁 FeCl3 → FeCl2
D.二氧化硫→三氧化硫 SO2 → SO32-3-2 氧化剂和还原剂升失氧化还原剂 -10↑ 还原剂 0+1+2+2↓ 氧化剂 ↑ 还原剂 +10↓ 氧化剂 +4+2↓ 氧化剂 +3+2↓ 氧化剂 +4+6↑ 还原剂 (二) 氧化剂和还原剂相互依存,缺一不可 7、用双线桥法分析下列方程式,标出氧化剂和还原剂,
以及氧化产物和还原产物:
① 2H2O2 O2↑ + 2H2O
② 2Na + S Na2S
③ S + O2 SO22-3-2 氧化剂和还原剂升失氧化还原剂 (二) 氧化剂和还原剂相互依存,缺一不可 7、用双线桥法分析下列方程式,标出氧化剂和还原剂,
以及氧化产物和还原产物:
2-3-2 氧化剂和还原剂升失氧化还原剂 (二) 氧化剂和还原剂相互依存,缺一不可 7、用双线桥法分析下列方程式,标出氧化剂和还原剂,
以及氧化产物和还原产物:
2-3-2 氧化剂和还原剂升失氧化还原剂 (三) 氧化还原反应在生产和生活中的应用
常见的氧化性物质:
O2、Cl2、浓H2SO4、HNO3、KMnO4、FeCl3等
常见的还原性物质:
Al、Zn、Fe、C、H2、CO等2-3-2 氧化剂和还原剂升失氧化还原剂 化合价容易降低 +6 +5 +7 +3 化合价容易升高 【合作运用】11.请用单线桥法分析下面化学方程式,
标出氧化剂、还原剂及氧化产物、还原产物:
2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
(1) H元素的化合价由__价降低为__价,降低了__价,
H化合价降低的总数为__,6个H+得到电子数为__。
(2) Al元素化合价升高总数为__,2个Al原子失去电子
总数为_____。本反应转移的电子数为______。
(3) 有1 mol Al参加了反应,则氢元素得到__mol e﹣,
生成标准状态下的H2 ______L
2-3-2 氧化剂和还原剂【合作运用】11.请用单线桥法分析下面化学方程式,
标出氧化剂、还原剂及氧化产物、还原产物:
(1) H元素的化合价由__价降低为__价,降低了__价,
H化合价降低的总数为__,6个H+得到电子数为__。
(2) Al元素化合价升高总数为__,2个Al原子失去电子
总数为___。本反应转移的电子数为______。
(3) 有1 mol Al参加了反应,则氢元素得到__mol e﹣,
生成标准状态下的H2 ______L
2-3-2 氧化剂和还原剂+1 0 1 6 6 6 6 6 3 1.5 mol 33.6 【合作运用】8.实现下列变化需要加入氧化剂的是
A.NaOH→NaCl B.H2SO4→H2
C.HCl→Cl2 D.CaCO3→CO2
9.化学反应H2SO3 + I2 + H2O = 2HI + H2SO4 ,
以下说法正确的是
A.H2SO4是氧化剂
B.HI是氧化剂
C.H2O是还原剂
D.H2SO3是还原剂
C 2-3-2 氧化剂和还原剂D 10.在下列反应中,
水既不作氧化剂,又不作还原剂的是
A.2Na + 2H2O = 2NaOH + H2↑
B.Na2O + H2O = 2NaOH
C.H2O H2↑ + O2↑
D.C + H2O CO + H2B 2-3-2 氧化剂和还原剂【合作运用】12.下列叙述中正确的是
A.反应中化合价降低的物质是还原剂
B.有氧元素参加的反应一定是氧化还原反应
C.反应前后元素化合价没有变化的反应
一定不是氧化还原反应
D.氧化剂在反应中被氧化,还原剂在反应中被还原
【当堂作业】2-3-2 氧化剂和还原剂C 13.阿波罗宇宙飞船以 N2H4(联氨)和N2O4为推力源,
反应温度达 2700℃,反应式为
2N2H4 + N2O4 = 3N2 + 4H2O
关于该反应的说法中正确的是
A.属于置换反应
B.联氨是氧化剂
C.联氨是还原剂
D.氮气是氧化剂,也是还原剂
【当堂作业】2-3-2 氧化剂和还原剂C 14.氧化还原反应
3S + 6KOH K2SO3 + 2K2S + 3H2O
被氧化与被还原的硫原子个数比为
A.1∶2 B.2∶1 C.1∶1 D.3∶2
2-3-2 氧化剂和还原剂A 15.请用单线桥法分析下面化学方程式,
标出氧化剂、还原剂及氧化产物、还原产物:
?
Fe2(SO4)3 + H2SO3 + H2O = 2FeSO4 +2H2SO4
?
(1) 写出该反应的离子方程式:
(2) 此反应是否符合复分解型离子反应的条件?
(3) 请你再重新总结离子反应发生的条件。
2-3-2 氧化剂和还原剂15.请用单线桥法分析下面化学方程式,
标出氧化剂、还原剂及氧化产物、还原产物:
?
?
(1) 写出该反应的离子方程式:
2Fe3+ + SO32- + H2O = 2Fe2+ + 2H+ + SO42-
(2) 此反应是否符合复分解型离子反应的条件?
不符合,没有生成沉淀、气体和水。
(3) 请你再重新总结离子反应发生的条件。
有沉淀、气体和水生成或发生氧化还原反应。
2-3-2 氧化剂和还原剂谢谢诸位!让我们一起努力将化学变得更美好!
