【全国百强校】海南省国兴中学高中化学必修一课件:3-1-3 Al与NaOH溶液的反应 化学方程式的计算 (共26张PPT)
文档属性
| 名称 | 【全国百强校】海南省国兴中学高中化学必修一课件:3-1-3 Al与NaOH溶液的反应 化学方程式的计算 (共26张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 354.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-27 17:11:29 | ||
图片预览








文档简介
课件26张PPT。3-1-3 Al与NaOH溶液的反应 化学方程式的计算海南省国兴中学
团队合作学习 自主管理 先学后教
第三章《金属及其化合物》
第一节《金属的化学性质》【学习目标】
1、铝与NaOH溶液的反应 ;
2、物质的量应用于化学方程式计算的方法和格式 。
Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 2、请写出Al和HCl的反应方程式
2Al + 6HCl = 2AlCl3 + 3H2↑
3、Al还能和NaOH溶液反应,产物有NaAlO2,
以及一种气体。通过氧化还原反应原理,
试推导可能为何种气体?如何验证该气体?
Al + NaOH + H2O = NaAlO2 + ?↑
Al和NaOH溶液反应,Al的化合价升高,
则NaOH或H2O中必有元素化合价降低。
O是最低价,只能H由+1价降为0价,生成H2。
Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 2、请写出Al和HCl的反应方程式
2Al + 6HCl = 2AlCl3 + 3H2↑
3、Al还能和NaOH溶液反应,产物有NaAlO2,
以及一种气体。通过氧化还原反应原理,
试推导可能为何种气体?如何验证该气体?
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2 ↑
Al和NaOH溶液反应,Al的化合价升高,
则NaOH或H2O中必有元素化合价降低。
O是最低价,只能H由+1价降为0价,生成H2。
Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 【实验3-4】铝与盐酸和氢氧化钠溶液的反应 Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 有气泡不断冒出
点燃木条靠近有爆鸣声 有气泡不断冒出
点燃木条靠近有爆鸣声 Al与HCl反应
有H2生成 Al与NaOH溶液反应
有H2生成 (1) 将反应方程式改为离子方程式,并用双线桥法分析:
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
偏铝酸钠
(2) 铝制餐具是否适宜蒸煮或存放酸性、碱性的食物? 【实验3-4】铝与盐酸和氢氧化钠溶液的反应 Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 有气泡不断冒出
点燃木条靠近有爆鸣声 有气泡不断冒出
点燃木条靠近有爆鸣声 Al与HCl反应
有H2生成 Al与NaOH溶液反应
有H2生成 (1) 将反应方程式改为离子方程式,并用双线桥法分析:
2Al+2Na++ 2OH-+2H2O=2Na++2AlO2-+3H2 ↑
偏铝酸根
(2) 铝制餐具是否适宜蒸煮或存放酸性、碱性的食物? 【实验3-4】铝与盐酸和氢氧化钠溶液的反应 Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 有气泡不断冒出
点燃木条靠近有爆鸣声 有气泡不断冒出
点燃木条靠近有爆鸣声 Al与HCl反应
有H2生成 Al与NaOH溶液反应
有H2生成 (1) 将反应方程式改为离子方程式,并用双线桥法分析:
2Al+2Na++ 2OH-+2H2O=2Na++2AlO2-+3H2 ↑
偏铝酸根
(2) 铝制餐具是否适宜蒸煮或存放酸性、碱性的食物? 【实验3-4】铝与盐酸和氢氧化钠溶液的反应 Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 有气泡不断冒出
点燃木条靠近有爆鸣声 有气泡不断冒出
点燃木条靠近有爆鸣声 Al与HCl反应
有H2生成 Al与NaOH溶液反应
有H2生成 (1) 将反应方程式改为离子方程式,并用双线桥法分析:
(2) 铝制餐具是否适宜蒸煮或存放酸性、碱性的食物?
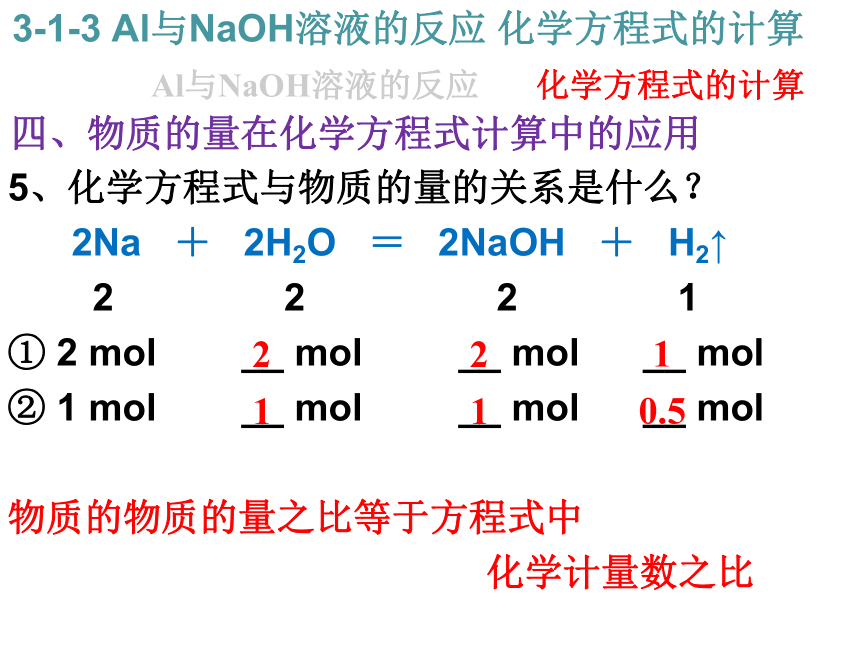
不能,因为铝既能和强酸反应,也能和强碱反应。 5、化学方程式与物质的量的关系是什么?
2Na + 2H2O = 2NaOH + H2↑
2 2 2 1
① 2 mol __ mol __ mol __ mol
② 1 mol __ mol __ mol __ mol
物质的物质的量之比等于方程式中
化学计量数之比Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 2 2 1 1 1 0.5 5、化学方程式与物质的量的关系是什么?
2Na + 2H2O = 2NaOH + H2↑
2 2 2 1
① 2 mol __ mol __ mol __ mol
36 g 80 g 22.4 L
② 1 mol __ mol __ mol __ mol
18 g 40 g 11.2 LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 2 2 1 1 1 0.5 7、把6.5 g Zn投入足量盐酸中,Zn完全反应,
求HCl的物质的量和生成气体的体积:
Zn + 2HCl = ZnCl2 + H2↑
1 2 1 1
__ mol __ mol __ mol __ mol
6.5 g ___ g ___ g ____ LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 0.1 0.2 0.1 0.1 7.3 13.6 2.24 7、 (1) 欲将10 g CaCO3溶解,求所需要的稀
HCl的物质的量,及到得气体的体积。
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
1 2 1 1 1
__ mol __ mol ___ mol
10 g ____ LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 0.1 0.2 0.1 2.24 7、(2) 5.3 g Na2CO3恰好与10 mL稀H2SO4
完全反应,求稀H2SO4的物质的量浓度:
Na2CO3+H2SO4=Na2SO4+CO2↑ + H2O
1 1
__ mol __ mol
5.3 g
c = n/V =0.05 mol ÷ 0.01 L = 5 mol/LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 0.05 0.05 7、解题格式:单位上下相等,比例左右相当
把6.5 g Zn投入足量盐酸中,Zn完全反应,
求HCl的物质的量和生成气体的体积:
Zn + 2HCl = ZnCl2 + H2↑
参考量 65 g 2 mol 22.4 L
实际量 6.5 g x y
解得: x = 0.2 mol y = 2.24 L Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 7、解题格式:单位上下相等,比例左右相当
(1) 欲将10 g CaCO3溶解,求所需要的稀
HCl的物质的量,及到得气体的体积。
CaCO3+2HCl=CaCl2+CO2↑+H2O
参考量 100 g 2 mol 22.4 L
实际量 10 g x y
解得: x = 0.2 mol y = 2.24 L Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 7、解题格式:单位上下相等,比例左右相当
(2) 5.3 g Na2CO3恰好与10 mL稀H2SO4
完全反应,求稀H2SO4的物质的量浓度:
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
参考量 106 g 1 mol
实际量 5.3 g x
解得: x = 0.2 mol
c = n/V =0.05 mol ÷ 0.01 L = 5 mol/LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 7、解题格式:单位上下相等,比例左右相当
(3) 把6.5 g Zn放入足量稀盐酸中,计算:
① 6.5 g Zn 的物质的量
② 参加反应的HCl的物质的量
③ 生成H2在标准状况时的体积
Zn + 2HCl = ZnCl2 + H2↑
参考量: 65 g 2 mol 1 mol 22.4 L
实际量:6.5 g __ mol ____L Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 0.2 2.24 【合作运用】8.下下列有关厨房铝制品的使用中 你认为合理的是
A.盛放食醋 B.烧开水
C.用金属丝擦洗表面的污垢 D.用碱水洗涤
9.除去镁粉中的铝粉,应选用的试剂是
A.稀盐酸 B.浓硫酸
C.烧碱(NaOH)溶液 D.纯碱(Na2CO3)
3-1-1 金属与非金属的反应B C 【合作运用】10.0.1 mol Na在氧气中被氧化后得到3.5 g固体,
由此可判断产物
A.只有Na2O B.只有Na2O2
C .Na2O和Na2O2 D.无法确定
4Na + O2 = 2Na2O 2Na + O2 Na2O2
4 2 2 1
0.1 mol 0.05 mol 0.1 mol 0.05 mol
3.1 g 3.9 g3-1-1 金属与非金属的反应C 【合作运用】10.0.1 mol Na在氧气中被氧化后得到3.5 g固体,
由此可判断产物
A.只有Na2O B.只有Na2O2
C .Na2O和Na2O2 D.无法确定
4Na + O2 = 2Na2O
参考量: 4 mol 124 g
实际反应量: 0.1 mol
2Na + O2 Na2O2
参考量: 2 mol 78 g
实际反应量:0.1 mol3-1-1 金属与非金属的反应3.1 g 3.9 g C 【合作运用】11.在铝质易拉罐中灌满CO2气体,然后倒入10 mL
浓NaOH溶液,并迅速用胶带将易拉罐口封住。
(1) 最先够观察到的实验现象是_______________,
原因是________________________________,
反应的离子方程式是_____________________。
(2) 一段时间之后,又可以观察到______________,
原因是________________________________,
_____________________________________,
反应的离子方程式是_____________________。
3-1-1 金属与非金属的反应易拉罐变瘪 CO2被NaOH吸收,使罐内气压降低,变瘪 CO2+2OH- = CO32-+H2O 易拉罐又鼓起来 浓NaOH与易拉罐(Al)反应,产生H2,
随着易拉罐内H2量的增多,易拉罐内气压增大 2Na+2H2O=2NaOH+H2↑ 【合作运用】12.标准状况下,500 mL的浓NaOH溶液与Al粉反应,
铝粉完全溶解,收集到H2 3.36 L。
(1) 铝粉的质量是多少?
(2) 最后溶液中NaAlO2的物质的量浓度是多少?
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
参考量: 57 g 2 mol 67.2 L
实际量:___ g ___ mol 3.36 L
c = n/V = 0.1 mol ÷ 0.5 L = 0.2 mol/L
3-1-1 金属与非金属的反应2.7 0.1 13.选择适当的方法除去下列物质中的杂质
写出有关反应的离子方程式
Fe(Al)
方法____________________________,
离子方程式____________________________;
Cu(Al)
方法____________________________,
离子方程式____________________________。
【当堂作业】加入浓NaOH充分反应后过滤 3-1-1 金属与非金属的反应2Al+2OH-+2H2O=2AlO2-+3H2↑ 加入足量稀硫酸充分反应后过滤 2Al + 6H+ = 2Al3+ + 3H2↑ 14.等物质的量得Na、Mg、Al分别与足量盐酸反应
生成的H2的体积之比是________。
2Na + 2H+ = Na+ + H2↑
2 mol 1 mol
2 mol 1 mol
Mg + 2H+ = Mg2+ + H2↑
1 mol 1 mol
2 mol 2 mol
2Al + 6H+ = 2Al3+ + 3H2↑
2 mol 3 mol
2 mol 3 mol【当堂作业】3-1-1 金属与非金属的反应1:2:3 15.将Na、Mg、Al分别与足量盐酸反应生成H2的
体积相等,则三种金属的物质的量之比为_____
2Na + 2H+ = Na+ + H2↑
2 mol 1 mol
6 mol 3 mol
Mg + 2H+ = Mg2+ + H2↑
1 mol 1 mol
3 mol 3 mol
2Al + 6H+ = 2Al3+ + 3H2↑
2 mol 3 mol
2 mol 3 mol【当堂作业】3-1-1 金属与非金属的反应6:3:2 谢谢诸位!让我们一起努力将化学变得更美好!
团队合作学习 自主管理 先学后教
第三章《金属及其化合物》
第一节《金属的化学性质》【学习目标】
1、铝与NaOH溶液的反应 ;
2、物质的量应用于化学方程式计算的方法和格式 。
Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 2、请写出Al和HCl的反应方程式
2Al + 6HCl = 2AlCl3 + 3H2↑
3、Al还能和NaOH溶液反应,产物有NaAlO2,
以及一种气体。通过氧化还原反应原理,
试推导可能为何种气体?如何验证该气体?
Al + NaOH + H2O = NaAlO2 + ?↑
Al和NaOH溶液反应,Al的化合价升高,
则NaOH或H2O中必有元素化合价降低。
O是最低价,只能H由+1价降为0价,生成H2。
Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 2、请写出Al和HCl的反应方程式
2Al + 6HCl = 2AlCl3 + 3H2↑
3、Al还能和NaOH溶液反应,产物有NaAlO2,
以及一种气体。通过氧化还原反应原理,
试推导可能为何种气体?如何验证该气体?
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2 ↑
Al和NaOH溶液反应,Al的化合价升高,
则NaOH或H2O中必有元素化合价降低。
O是最低价,只能H由+1价降为0价,生成H2。
Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 【实验3-4】铝与盐酸和氢氧化钠溶液的反应 Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 有气泡不断冒出
点燃木条靠近有爆鸣声 有气泡不断冒出
点燃木条靠近有爆鸣声 Al与HCl反应
有H2生成 Al与NaOH溶液反应
有H2生成 (1) 将反应方程式改为离子方程式,并用双线桥法分析:
2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
偏铝酸钠
(2) 铝制餐具是否适宜蒸煮或存放酸性、碱性的食物? 【实验3-4】铝与盐酸和氢氧化钠溶液的反应 Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 有气泡不断冒出
点燃木条靠近有爆鸣声 有气泡不断冒出
点燃木条靠近有爆鸣声 Al与HCl反应
有H2生成 Al与NaOH溶液反应
有H2生成 (1) 将反应方程式改为离子方程式,并用双线桥法分析:
2Al+2Na++ 2OH-+2H2O=2Na++2AlO2-+3H2 ↑
偏铝酸根
(2) 铝制餐具是否适宜蒸煮或存放酸性、碱性的食物? 【实验3-4】铝与盐酸和氢氧化钠溶液的反应 Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 有气泡不断冒出
点燃木条靠近有爆鸣声 有气泡不断冒出
点燃木条靠近有爆鸣声 Al与HCl反应
有H2生成 Al与NaOH溶液反应
有H2生成 (1) 将反应方程式改为离子方程式,并用双线桥法分析:
2Al+2Na++ 2OH-+2H2O=2Na++2AlO2-+3H2 ↑
偏铝酸根
(2) 铝制餐具是否适宜蒸煮或存放酸性、碱性的食物? 【实验3-4】铝与盐酸和氢氧化钠溶液的反应 Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 有气泡不断冒出
点燃木条靠近有爆鸣声 有气泡不断冒出
点燃木条靠近有爆鸣声 Al与HCl反应
有H2生成 Al与NaOH溶液反应
有H2生成 (1) 将反应方程式改为离子方程式,并用双线桥法分析:
(2) 铝制餐具是否适宜蒸煮或存放酸性、碱性的食物?
不能,因为铝既能和强酸反应,也能和强碱反应。 5、化学方程式与物质的量的关系是什么?
2Na + 2H2O = 2NaOH + H2↑
2 2 2 1
① 2 mol __ mol __ mol __ mol
② 1 mol __ mol __ mol __ mol
物质的物质的量之比等于方程式中
化学计量数之比Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 2 2 1 1 1 0.5 5、化学方程式与物质的量的关系是什么?
2Na + 2H2O = 2NaOH + H2↑
2 2 2 1
① 2 mol __ mol __ mol __ mol
36 g 80 g 22.4 L
② 1 mol __ mol __ mol __ mol
18 g 40 g 11.2 LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 2 2 1 1 1 0.5 7、把6.5 g Zn投入足量盐酸中,Zn完全反应,
求HCl的物质的量和生成气体的体积:
Zn + 2HCl = ZnCl2 + H2↑
1 2 1 1
__ mol __ mol __ mol __ mol
6.5 g ___ g ___ g ____ LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 0.1 0.2 0.1 0.1 7.3 13.6 2.24 7、 (1) 欲将10 g CaCO3溶解,求所需要的稀
HCl的物质的量,及到得气体的体积。
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
1 2 1 1 1
__ mol __ mol ___ mol
10 g ____ LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 0.1 0.2 0.1 2.24 7、(2) 5.3 g Na2CO3恰好与10 mL稀H2SO4
完全反应,求稀H2SO4的物质的量浓度:
Na2CO3+H2SO4=Na2SO4+CO2↑ + H2O
1 1
__ mol __ mol
5.3 g
c = n/V =0.05 mol ÷ 0.01 L = 5 mol/LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 0.05 0.05 7、解题格式:单位上下相等,比例左右相当
把6.5 g Zn投入足量盐酸中,Zn完全反应,
求HCl的物质的量和生成气体的体积:
Zn + 2HCl = ZnCl2 + H2↑
参考量 65 g 2 mol 22.4 L
实际量 6.5 g x y
解得: x = 0.2 mol y = 2.24 L Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 7、解题格式:单位上下相等,比例左右相当
(1) 欲将10 g CaCO3溶解,求所需要的稀
HCl的物质的量,及到得气体的体积。
CaCO3+2HCl=CaCl2+CO2↑+H2O
参考量 100 g 2 mol 22.4 L
实际量 10 g x y
解得: x = 0.2 mol y = 2.24 L Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 7、解题格式:单位上下相等,比例左右相当
(2) 5.3 g Na2CO3恰好与10 mL稀H2SO4
完全反应,求稀H2SO4的物质的量浓度:
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
参考量 106 g 1 mol
实际量 5.3 g x
解得: x = 0.2 mol
c = n/V =0.05 mol ÷ 0.01 L = 5 mol/LAl与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 7、解题格式:单位上下相等,比例左右相当
(3) 把6.5 g Zn放入足量稀盐酸中,计算:
① 6.5 g Zn 的物质的量
② 参加反应的HCl的物质的量
③ 生成H2在标准状况时的体积
Zn + 2HCl = ZnCl2 + H2↑
参考量: 65 g 2 mol 1 mol 22.4 L
实际量:6.5 g __ mol ____L Al与NaOH溶液的反应 3-1-3 Al与NaOH溶液的反应 化学方程式的计算化学方程式的计算 四、物质的量在化学方程式计算中的应用 0.2 2.24 【合作运用】8.下下列有关厨房铝制品的使用中 你认为合理的是
A.盛放食醋 B.烧开水
C.用金属丝擦洗表面的污垢 D.用碱水洗涤
9.除去镁粉中的铝粉,应选用的试剂是
A.稀盐酸 B.浓硫酸
C.烧碱(NaOH)溶液 D.纯碱(Na2CO3)
3-1-1 金属与非金属的反应B C 【合作运用】10.0.1 mol Na在氧气中被氧化后得到3.5 g固体,
由此可判断产物
A.只有Na2O B.只有Na2O2
C .Na2O和Na2O2 D.无法确定
4Na + O2 = 2Na2O 2Na + O2 Na2O2
4 2 2 1
0.1 mol 0.05 mol 0.1 mol 0.05 mol
3.1 g 3.9 g3-1-1 金属与非金属的反应C 【合作运用】10.0.1 mol Na在氧气中被氧化后得到3.5 g固体,
由此可判断产物
A.只有Na2O B.只有Na2O2
C .Na2O和Na2O2 D.无法确定
4Na + O2 = 2Na2O
参考量: 4 mol 124 g
实际反应量: 0.1 mol
2Na + O2 Na2O2
参考量: 2 mol 78 g
实际反应量:0.1 mol3-1-1 金属与非金属的反应3.1 g 3.9 g C 【合作运用】11.在铝质易拉罐中灌满CO2气体,然后倒入10 mL
浓NaOH溶液,并迅速用胶带将易拉罐口封住。
(1) 最先够观察到的实验现象是_______________,
原因是________________________________,
反应的离子方程式是_____________________。
(2) 一段时间之后,又可以观察到______________,
原因是________________________________,
_____________________________________,
反应的离子方程式是_____________________。
3-1-1 金属与非金属的反应易拉罐变瘪 CO2被NaOH吸收,使罐内气压降低,变瘪 CO2+2OH- = CO32-+H2O 易拉罐又鼓起来 浓NaOH与易拉罐(Al)反应,产生H2,
随着易拉罐内H2量的增多,易拉罐内气压增大 2Na+2H2O=2NaOH+H2↑ 【合作运用】12.标准状况下,500 mL的浓NaOH溶液与Al粉反应,
铝粉完全溶解,收集到H2 3.36 L。
(1) 铝粉的质量是多少?
(2) 最后溶液中NaAlO2的物质的量浓度是多少?
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
参考量: 57 g 2 mol 67.2 L
实际量:___ g ___ mol 3.36 L
c = n/V = 0.1 mol ÷ 0.5 L = 0.2 mol/L
3-1-1 金属与非金属的反应2.7 0.1 13.选择适当的方法除去下列物质中的杂质
写出有关反应的离子方程式
Fe(Al)
方法____________________________,
离子方程式____________________________;
Cu(Al)
方法____________________________,
离子方程式____________________________。
【当堂作业】加入浓NaOH充分反应后过滤 3-1-1 金属与非金属的反应2Al+2OH-+2H2O=2AlO2-+3H2↑ 加入足量稀硫酸充分反应后过滤 2Al + 6H+ = 2Al3+ + 3H2↑ 14.等物质的量得Na、Mg、Al分别与足量盐酸反应
生成的H2的体积之比是________。
2Na + 2H+ = Na+ + H2↑
2 mol 1 mol
2 mol 1 mol
Mg + 2H+ = Mg2+ + H2↑
1 mol 1 mol
2 mol 2 mol
2Al + 6H+ = 2Al3+ + 3H2↑
2 mol 3 mol
2 mol 3 mol【当堂作业】3-1-1 金属与非金属的反应1:2:3 15.将Na、Mg、Al分别与足量盐酸反应生成H2的
体积相等,则三种金属的物质的量之比为_____
2Na + 2H+ = Na+ + H2↑
2 mol 1 mol
6 mol 3 mol
Mg + 2H+ = Mg2+ + H2↑
1 mol 1 mol
3 mol 3 mol
2Al + 6H+ = 2Al3+ + 3H2↑
2 mol 3 mol
2 mol 3 mol【当堂作业】3-1-1 金属与非金属的反应6:3:2 谢谢诸位!让我们一起努力将化学变得更美好!
