【全国百强校】海南省国兴中学高中化学必修一课件:3-2-3 铁的重要化合物 氧化性还原性判断 (共26张PPT)
文档属性
| 名称 | 【全国百强校】海南省国兴中学高中化学必修一课件:3-2-3 铁的重要化合物 氧化性还原性判断 (共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 543.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-27 00:00:00 | ||
图片预览








文档简介
课件26张PPT。3-2-3 铁的重要化合物海南省国兴中学
曾垂云团队合作学习 自主管理 先学后教
第三章《金属及其化合物》
第二节《几种重要的金属化合物》【学习目标】
1、 Fe(OH)2的制备与性质;
2、 Fe、Fe2+与Fe3+的价态与氧化性还原性关系。 Fe(OH)2的制备与性质3-2-3 铁的重要化合物Fe2+与Fe3+ 3-2-3 铁的重要化合物3、阅读课本59页:
FeO Fe2O3 Fe3O4[FeO· Fe2O3]
Fe3O4里的铁元素的化合价是多少?
Fe3O4属于复杂氧化物,Fe的化合价有+2、+3。(一) 铁的氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ +2 +3 +2 +3 3-2-3 铁的重要化合物3、阅读课本59页:
FeO Fe2O3 Fe3O4[FeO· Fe2O3]
(2) 写出Fe3O4与HCl反应的化学方程式和离子方程式:
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O(一) 铁的氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ +2 +3 +2 +3 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备 (二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备(二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备 (二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备
(1) 用化学方程式表示Fe(OH)2↓颜色变化的过程
Fe2+ + 2OH- = Fe(OH)2↓ (灰白色沉淀)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓ (红褐色沉淀) (二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备
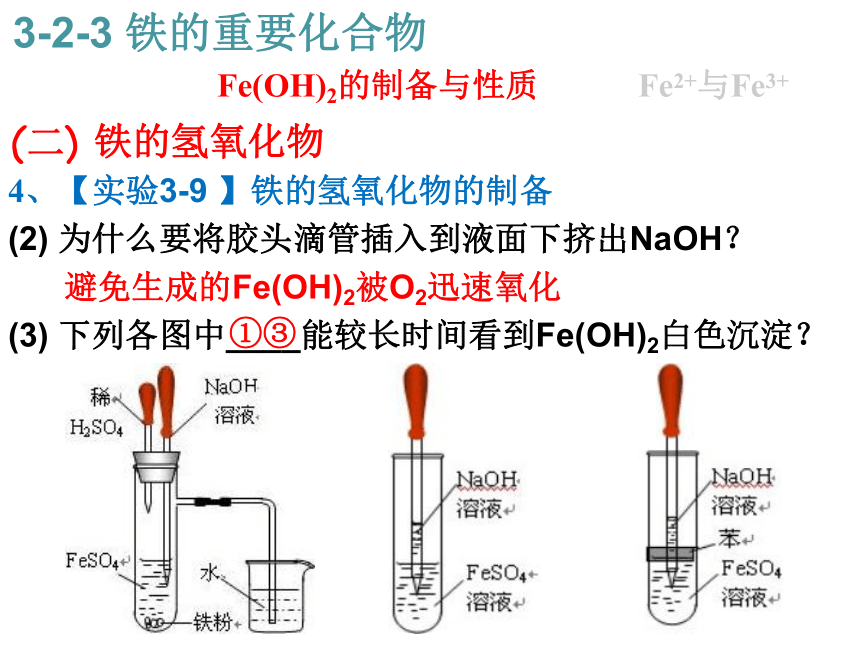
(2) 为什么要将胶头滴管插入到液面下挤出NaOH?
避免生成的Fe(OH)2被O2迅速氧化
(3) 下列各图中____能较长时间看到Fe(OH)2白色沉淀? (二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ ①③ 3-2-3 铁的重要化合物5、【实验3-10 】 Fe3+的检验 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物5、【实验3-10 】 Fe3+的检验 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物5、【实验3-10 】 Fe3+的检验 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化
(1) 用双线桥法分析上述两组反应的离子方程式: (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化
(1) 用双线桥法分析上述两组反应的离子方程式:
(2) 反应①中,Fe表现_____性,Fe3+表现_____性;
反应②中, Fe2+表现了_____性,
Fe2+还有_____性,如反应__________________
元素在最高价时有____性,最低价时有____性,
属于中间价态时,则同时具有____性和____性。
(三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 氧化 还原 还原 氧化 Zn + Fe2+ = Fe + Zn2+ 氧化 还原 氧化 还原 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化
(三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 还原性 氧化性 还原性 氧化性 3-2-3 铁的重要化合物7、怎样检验Fe2+?
① 先加KSCN溶液不变色,再滴加Cl2水溶液变红。
② 滴入酸性KMnO4溶液,振荡后紫红色褪去。
8、Fe2+与MnO4-能否在同一溶液中共存?
Fe3+与I-呢?为什么?
Fe2+有还原性,MnO4-有强氧化性;
Fe3+有氧化性,I-有还原性。
会发生氧化还原反应而不共存。
(三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 【合作运用】9.下列关于Fe2+和Fe3+的叙述中,错误的是
A、Fe2+的水溶液呈浅绿色、Fe3+的水溶液呈黄褐色
B、缺铁性贫血的患者,应该补充Fe2+而不是Fe3+
C、Fe2+具有还原性,Fe3+具有氧化性
D、Fe2+溶液中滴入KSCN溶液,出现血红色
10.下列物质能够在空气中长时间稳定存在的是
A.Na2O2 B.Fe(OH)2
C.Na2O D.Al2O3
D 3-2-2 铁的重要化合物D 【合作运用】11.向某溶液中加入无色的KSCN溶液,
立即呈现红色,则 该溶液中一定含有
A.Na+ B.Mg2+
C.Fe3+ D.Al3+
12.反应2FeCl3+Fe=3FeCl2中,
氧化剂是______ ;还原剂是______ 。
说明Fe3+具有______ ;Fe具有______ 。3-2-2 铁的重要化合物C FeCl3 Fe 氧化性 还原性 【合作运用】13.小伶为了验证黄瓜中是否含有铁元素,榨取了
一定量的黄瓜汁,进行如下两个实验:
① 新鲜黄瓜汁加入KSCN溶液,无现象
② 黄瓜汁露置在空气中过夜后,再加入
KSCN溶液,出现血红色
以上实验说明黄瓜中是否含有铁元素?
如果有,是以Fe2+还是以Fe3+的形式存在?
黄瓜中铁元素以Fe2+形式存在,
过夜被氧化成Fe3+后,
再加入KSCN溶液,就出现血红色。3-2-2 铁的重要化合物【合作运用】14.A、B、C、D四种物质都含有一种共同的元素,
A是常见的金属,C的溶液呈现黄色,
A、B、C、D之间有如图所示转化关系:
(1) A是_____,C是_____。
(2) C溶液与NaOH混合后的现象是_____________。
(3) 反应①的反应类型是_________。
反应②的离子方程式:____________________。3-2-2 铁的重要化合物Fe FeCl3 生成红褐色沉淀 置换反应 2Fe2+ + Cl2 = 2Fe3++ 2Cl- 15.NaCl、AlCl3、FeCl2、FeCl3、MgCl2五种溶液,
用一种试剂经一步实验就能加以区别,该试剂是
A.KSCN?????? ? B.BaCl2 ???
??? C.NaOH??? ?? ?? D.HCl
16.下列操作中,溶液的颜色不发生变化的是
A.碳酸氢钠溶液中滴加稀盐酸? ??
B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘酒中滴加淀粉溶液? ??
D.氯化铁溶液中加入还原性铁粉
【当堂作业】3-2-1 铁的重要化合物C A 17.下列离子中,能与Fe2+共存与同一溶液的是
A.OH-? ? ?B.H+ C.MnO4-? ?? D.CO32-
18.在试管中加入适量FeSO4溶液,
并覆盖一层苯,
再用长滴管注入不含O2的
1 mol · L-1 NaOH溶液。
苯的作用是:___________________________,
因而可较长时间观察到____色Fe(OH) 2沉淀。
【当堂作业】3-2-1 铁的重要化合物白 隔绝空气,避免Fe2+被O2氧化B 19.A、B、C三种Y的氧化物,均能与某溶液E反应;
与黑色固体单质G在相同的条件下反应均能生成
金属Y和化合物H,
【当堂作业】3-2-1 铁的重要化合物C Fe CO2 Fe3O4 HCl FeCl2 FeCl3 FeO Fe2O3 谢谢诸位!让我们一起努力将化学变得更美好!
曾垂云团队合作学习 自主管理 先学后教
第三章《金属及其化合物》
第二节《几种重要的金属化合物》【学习目标】
1、 Fe(OH)2的制备与性质;
2、 Fe、Fe2+与Fe3+的价态与氧化性还原性关系。 Fe(OH)2的制备与性质3-2-3 铁的重要化合物Fe2+与Fe3+ 3-2-3 铁的重要化合物3、阅读课本59页:
FeO Fe2O3 Fe3O4[FeO· Fe2O3]
Fe3O4里的铁元素的化合价是多少?
Fe3O4属于复杂氧化物,Fe的化合价有+2、+3。(一) 铁的氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ +2 +3 +2 +3 3-2-3 铁的重要化合物3、阅读课本59页:
FeO Fe2O3 Fe3O4[FeO· Fe2O3]
(2) 写出Fe3O4与HCl反应的化学方程式和离子方程式:
Fe3O4 + 8HCl = 2FeCl3 + FeCl2 + 4H2O
Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O(一) 铁的氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ +2 +3 +2 +3 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备 (二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备(二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备 (二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备
(1) 用化学方程式表示Fe(OH)2↓颜色变化的过程
Fe2+ + 2OH- = Fe(OH)2↓ (灰白色沉淀)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3↓ (红褐色沉淀) (二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物4、【实验3-9 】铁的氢氧化物的制备
(2) 为什么要将胶头滴管插入到液面下挤出NaOH?
避免生成的Fe(OH)2被O2迅速氧化
(3) 下列各图中____能较长时间看到Fe(OH)2白色沉淀? (二) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ ①③ 3-2-3 铁的重要化合物5、【实验3-10 】 Fe3+的检验 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物5、【实验3-10 】 Fe3+的检验 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物5、【实验3-10 】 Fe3+的检验 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化 (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化
(1) 用双线桥法分析上述两组反应的离子方程式: (三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化
(1) 用双线桥法分析上述两组反应的离子方程式:
(2) 反应①中,Fe表现_____性,Fe3+表现_____性;
反应②中, Fe2+表现了_____性,
Fe2+还有_____性,如反应__________________
元素在最高价时有____性,最低价时有____性,
属于中间价态时,则同时具有____性和____性。
(三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 氧化 还原 还原 氧化 Zn + Fe2+ = Fe + Zn2+ 氧化 还原 氧化 还原 3-2-3 铁的重要化合物6、【科学探究 】 Fe3+和Fe2+的转化
(三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 还原性 氧化性 还原性 氧化性 3-2-3 铁的重要化合物7、怎样检验Fe2+?
① 先加KSCN溶液不变色,再滴加Cl2水溶液变红。
② 滴入酸性KMnO4溶液,振荡后紫红色褪去。
8、Fe2+与MnO4-能否在同一溶液中共存?
Fe3+与I-呢?为什么?
Fe2+有还原性,MnO4-有强氧化性;
Fe3+有氧化性,I-有还原性。
会发生氧化还原反应而不共存。
(三) 铁的氢氧化物 Fe(OH)2的制备与性质Fe2+与Fe3+ 【合作运用】9.下列关于Fe2+和Fe3+的叙述中,错误的是
A、Fe2+的水溶液呈浅绿色、Fe3+的水溶液呈黄褐色
B、缺铁性贫血的患者,应该补充Fe2+而不是Fe3+
C、Fe2+具有还原性,Fe3+具有氧化性
D、Fe2+溶液中滴入KSCN溶液,出现血红色
10.下列物质能够在空气中长时间稳定存在的是
A.Na2O2 B.Fe(OH)2
C.Na2O D.Al2O3
D 3-2-2 铁的重要化合物D 【合作运用】11.向某溶液中加入无色的KSCN溶液,
立即呈现红色,则 该溶液中一定含有
A.Na+ B.Mg2+
C.Fe3+ D.Al3+
12.反应2FeCl3+Fe=3FeCl2中,
氧化剂是______ ;还原剂是______ 。
说明Fe3+具有______ ;Fe具有______ 。3-2-2 铁的重要化合物C FeCl3 Fe 氧化性 还原性 【合作运用】13.小伶为了验证黄瓜中是否含有铁元素,榨取了
一定量的黄瓜汁,进行如下两个实验:
① 新鲜黄瓜汁加入KSCN溶液,无现象
② 黄瓜汁露置在空气中过夜后,再加入
KSCN溶液,出现血红色
以上实验说明黄瓜中是否含有铁元素?
如果有,是以Fe2+还是以Fe3+的形式存在?
黄瓜中铁元素以Fe2+形式存在,
过夜被氧化成Fe3+后,
再加入KSCN溶液,就出现血红色。3-2-2 铁的重要化合物【合作运用】14.A、B、C、D四种物质都含有一种共同的元素,
A是常见的金属,C的溶液呈现黄色,
A、B、C、D之间有如图所示转化关系:
(1) A是_____,C是_____。
(2) C溶液与NaOH混合后的现象是_____________。
(3) 反应①的反应类型是_________。
反应②的离子方程式:____________________。3-2-2 铁的重要化合物Fe FeCl3 生成红褐色沉淀 置换反应 2Fe2+ + Cl2 = 2Fe3++ 2Cl- 15.NaCl、AlCl3、FeCl2、FeCl3、MgCl2五种溶液,
用一种试剂经一步实验就能加以区别,该试剂是
A.KSCN?????? ? B.BaCl2 ???
??? C.NaOH??? ?? ?? D.HCl
16.下列操作中,溶液的颜色不发生变化的是
A.碳酸氢钠溶液中滴加稀盐酸? ??
B.硫酸铁溶液中滴加硫氰化钾溶液
C.碘酒中滴加淀粉溶液? ??
D.氯化铁溶液中加入还原性铁粉
【当堂作业】3-2-1 铁的重要化合物C A 17.下列离子中,能与Fe2+共存与同一溶液的是
A.OH-? ? ?B.H+ C.MnO4-? ?? D.CO32-
18.在试管中加入适量FeSO4溶液,
并覆盖一层苯,
再用长滴管注入不含O2的
1 mol · L-1 NaOH溶液。
苯的作用是:___________________________,
因而可较长时间观察到____色Fe(OH) 2沉淀。
【当堂作业】3-2-1 铁的重要化合物白 隔绝空气,避免Fe2+被O2氧化B 19.A、B、C三种Y的氧化物,均能与某溶液E反应;
与黑色固体单质G在相同的条件下反应均能生成
金属Y和化合物H,
【当堂作业】3-2-1 铁的重要化合物C Fe CO2 Fe3O4 HCl FeCl2 FeCl3 FeO Fe2O3 谢谢诸位!让我们一起努力将化学变得更美好!
