2016年秋 高一备课 人教版化学 必修2 1-2元素周期律1 (共31张PPT)
文档属性
| 名称 | 2016年秋 高一备课 人教版化学 必修2 1-2元素周期律1 (共31张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 545.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-08-30 21:59:49 | ||
图片预览









文档简介
课件31张PPT。第二节 元素周期律 原子核核外电子(Z个)质子(Z个)中子(A-Z)个构成原子的“三微粒”: 原子很小,原子核更小(直径不及原子直径的万分之一),电子在核外作高速运动,所占的空间相对较大;一、原子核外电子的排布
1、核外电子运动的特点:
(1)高速运动(运动的速度接近光速,约为108m/s);(2)运动没有确定的轨道,不能精确测定或计算电子在任一时刻所在的位置,也不能描绘出其运动轨迹。
(3)多电子的原子里,电子的能量不同。有些电子能量较低,在离核较近的区域里运动;有些电子能量较高,在离核较远的区域里运动。
2、电子层:能量不同的电子的运动区域(即不连续的壳层——该电子层模型称洋葱式结构)哪个区域能量最高,电子最活泼,最易参与化学反应?KL
MNOPQ
(3)最外层电子数 8个(K层是最外层时不超2个)
次外层电子数 18,倒数第三层电子数 32;
(以上规律是相互联系的,不能孤立运用)3、电子排布的重要规律(1)核外电子是分层排布的。
电子总是尽先排布在能量最低的电子层里,
由里向外,当一层充满后,再填充下一层;(2)各电子层最多容纳的电子数是2n2
(n表示电子层数);[练习] 判断下列示意图是否正确?为什么?
A、 B、
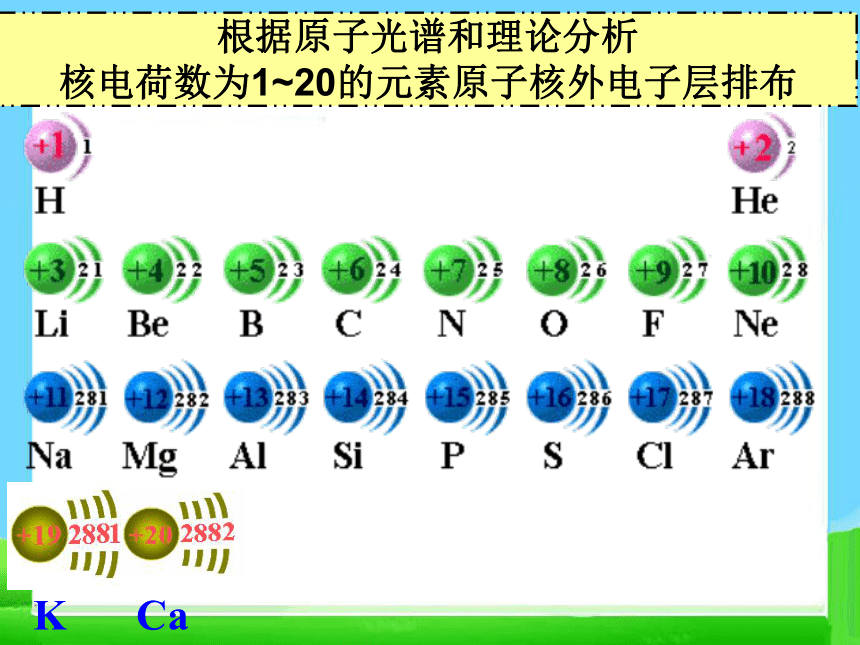
C、 D、根据原子光谱和理论分析
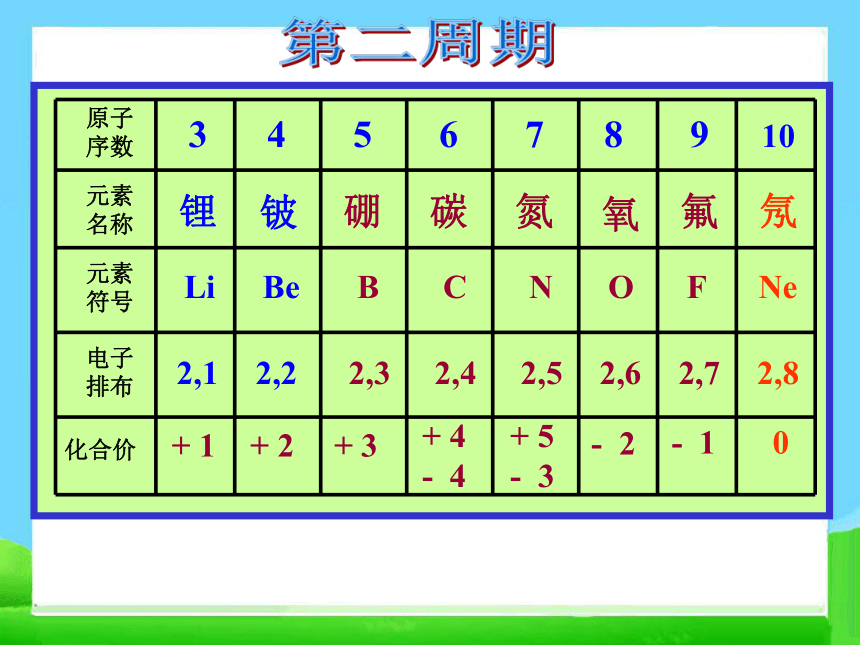
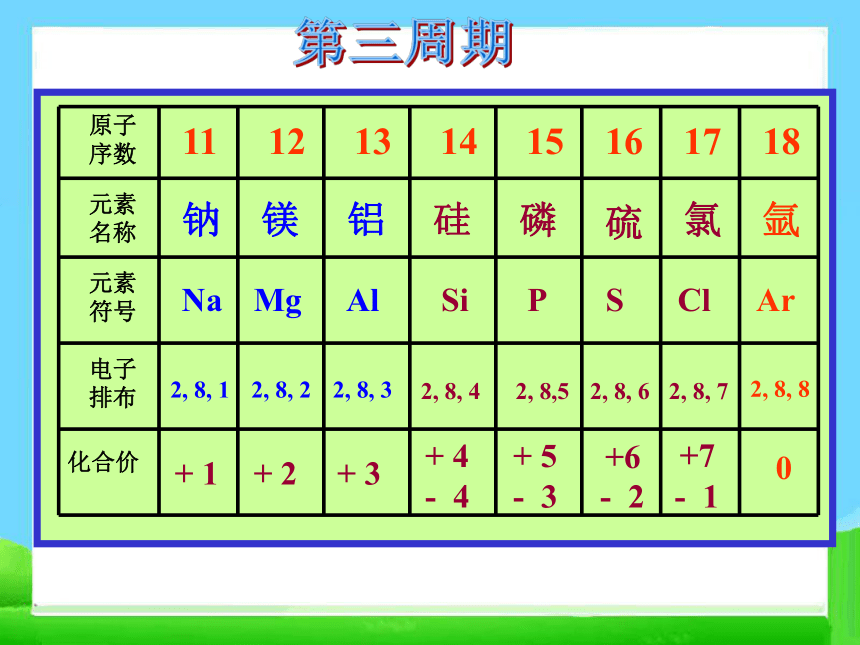
核电荷数为1~20的元素原子核外电子层排布二、元素周期律 请阅读并比较表1-2中1~18号元素的有关数据,从中能找出什么规律?+ 1 0 HHe 1 2第一周期2,12,22,32,42,52,62,72,8第二周期2, 8, 12, 8, 22, 8, 32, 8, 42, 8,52, 8, 62, 8, 72, 8, 8第三周期思考并讨论: 随着原子序数的递增,原子的核外电子层排布、元素的原子半径、元素的化合价呈现什么规律性的变化?原子序数电子层数最外层电子数原子半径变化1~2
H~He3~10
Li~Ne11~18
Na~Ar11→2最高正价:+1 → +5 (O,F无正价) 21 → 8负价始于C , - 4 → -1 →031 → 8大→小大→小最高正价:+1 → +7负价始于Si , - 4 → -1 →0+1 →0最高正化合价、最低负化合价的变化结论:随着原子序数的递增,元素原子的电子层
排布、原子半径、化合价呈现周期性的变化疑问 为什么随原子序数的递增,元素原子的电子层排布、原子半径、化合价呈现周期性变化呢? ▲ 随原子序数的递增,元素原子核外电子排布的周期性变化,决定了原子半径、化合价呈现周期性变化。 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?疑问①金属与水或酸反应越容易,金属性越强;
②最高价氧化物对应的水化物(氢氧化物)
碱性越强,金属性越强。
③金属与某些盐溶液的置换 元素金属性强弱判断依据:①非金属与H2化合越容易,非金属性越强;
②气态氢化物越稳定, 非金属性越强;
③最高价氧化物对应的水化物(含氧酸)
酸性越强,非金属性越强。
④非金属与某些盐溶液的置换 元素非金属性强弱判断依据:科学探究: 镁与冷水反应缓慢,滴入酚酞试液粉红色。而镁与沸水反应加快,产生气泡,溶液红色加深。镁的金属性比钠弱与金属钠对比 镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。镁的金属性比铝强科学探究:列表总结:NaOHMg(OH)2 Al(OH)3剧烈 迅速 强碱中强碱两性氢
氧化物 非金属性:Si < P < S < Cl科学事实 非金属性:Si < P < S < Cl科学事实本节总结: 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强 对其他周期元素性质进行研究,也可以得到类似的结论。 同一周期元素,从左到右, 金属性逐渐减弱,非金属性逐渐增强。元素周期律 元素的性质随着原子序数的递增而呈周期性的变化。实质:元素原子核外电子排布的周期性变化,决定了元素性质的周期性变化 (量变质变)小结:元素周期表中元素性质递变规律相同增多从1-2或1-8相同从大到小从小到大从+1--+7或-4---- -1相同减弱增强增强 减弱失减弱,得增强失增强,得减弱氧化性增强,还原性减弱还原性增强,氧化性减弱小结、“位、构、性”的关系 结构位置性质周期
族判断元素推出位置通过位置运用
递变规律(1)核电荷数、原子序数(2)核外电子电子层最外层电子物理性质元素性质单质性质化合物的性质离子性质反映决定决定反映1、写出下列微粒的半径由大到小的顺序:
F-、O2-、Na+、Mg2+练习:答案:半径:F- > O2- > Na+ > Mg2+2. 比较下列微粒的半径大小
Cl- 、 S2- 、 Na+ 、Mg2+ 、F-答案:半径 S2- > Cl- > F- >Na+ >Mg2+从元素周期律的发现
你想到了些什么? 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。
先辈们对真理执着追求的精神是我们人类不尽的财富。
他们的追求除了其优秀的个人素质以外,真理本身那种理性的美,也给了他们人生以巨大的乐趣。
同学们的学习是辛苦的,又是幸福的,每一门学科中都隐含着无穷的美。能引起情感共鸣的诗歌、散文和音乐,陶冶我们的情操;而化学学科中的新奇、和谐、简约,同样闪耀着美的光辉。
1、核外电子运动的特点:
(1)高速运动(运动的速度接近光速,约为108m/s);(2)运动没有确定的轨道,不能精确测定或计算电子在任一时刻所在的位置,也不能描绘出其运动轨迹。
(3)多电子的原子里,电子的能量不同。有些电子能量较低,在离核较近的区域里运动;有些电子能量较高,在离核较远的区域里运动。
2、电子层:能量不同的电子的运动区域(即不连续的壳层——该电子层模型称洋葱式结构)哪个区域能量最高,电子最活泼,最易参与化学反应?KL
MNOPQ
(3)最外层电子数 8个(K层是最外层时不超2个)
次外层电子数 18,倒数第三层电子数 32;
(以上规律是相互联系的,不能孤立运用)3、电子排布的重要规律(1)核外电子是分层排布的。
电子总是尽先排布在能量最低的电子层里,
由里向外,当一层充满后,再填充下一层;(2)各电子层最多容纳的电子数是2n2
(n表示电子层数);[练习] 判断下列示意图是否正确?为什么?
A、 B、
C、 D、根据原子光谱和理论分析
核电荷数为1~20的元素原子核外电子层排布二、元素周期律 请阅读并比较表1-2中1~18号元素的有关数据,从中能找出什么规律?+ 1 0 HHe 1 2第一周期2,12,22,32,42,52,62,72,8第二周期2, 8, 12, 8, 22, 8, 32, 8, 42, 8,52, 8, 62, 8, 72, 8, 8第三周期思考并讨论: 随着原子序数的递增,原子的核外电子层排布、元素的原子半径、元素的化合价呈现什么规律性的变化?原子序数电子层数最外层电子数原子半径变化1~2
H~He3~10
Li~Ne11~18
Na~Ar11→2最高正价:+1 → +5 (O,F无正价) 21 → 8负价始于C , - 4 → -1 →031 → 8大→小大→小最高正价:+1 → +7负价始于Si , - 4 → -1 →0+1 →0最高正化合价、最低负化合价的变化结论:随着原子序数的递增,元素原子的电子层
排布、原子半径、化合价呈现周期性的变化疑问 为什么随原子序数的递增,元素原子的电子层排布、原子半径、化合价呈现周期性变化呢? ▲ 随原子序数的递增,元素原子核外电子排布的周期性变化,决定了原子半径、化合价呈现周期性变化。 元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?疑问①金属与水或酸反应越容易,金属性越强;
②最高价氧化物对应的水化物(氢氧化物)
碱性越强,金属性越强。
③金属与某些盐溶液的置换 元素金属性强弱判断依据:①非金属与H2化合越容易,非金属性越强;
②气态氢化物越稳定, 非金属性越强;
③最高价氧化物对应的水化物(含氧酸)
酸性越强,非金属性越强。
④非金属与某些盐溶液的置换 元素非金属性强弱判断依据:科学探究: 镁与冷水反应缓慢,滴入酚酞试液粉红色。而镁与沸水反应加快,产生气泡,溶液红色加深。镁的金属性比钠弱与金属钠对比 镁与铝均能与盐酸反应产生气泡。但镁反应比铝剧烈。镁的金属性比铝强科学探究:列表总结:NaOHMg(OH)2 Al(OH)3剧烈 迅速 强碱中强碱两性氢
氧化物 非金属性:Si < P < S < Cl科学事实 非金属性:Si < P < S < Cl科学事实本节总结: 根据实验,可得出第三周期元素金属性、非金属性的递变规律: Na Mg Al Si P S Cl 金属性逐渐减弱,非金属性逐渐增强 对其他周期元素性质进行研究,也可以得到类似的结论。 同一周期元素,从左到右, 金属性逐渐减弱,非金属性逐渐增强。元素周期律 元素的性质随着原子序数的递增而呈周期性的变化。实质:元素原子核外电子排布的周期性变化,决定了元素性质的周期性变化 (量变质变)小结:元素周期表中元素性质递变规律相同增多从1-2或1-8相同从大到小从小到大从+1--+7或-4---- -1相同减弱增强增强 减弱失减弱,得增强失增强,得减弱氧化性增强,还原性减弱还原性增强,氧化性减弱小结、“位、构、性”的关系 结构位置性质周期
族判断元素推出位置通过位置运用
递变规律(1)核电荷数、原子序数(2)核外电子电子层最外层电子物理性质元素性质单质性质化合物的性质离子性质反映决定决定反映1、写出下列微粒的半径由大到小的顺序:
F-、O2-、Na+、Mg2+练习:答案:半径:F- > O2- > Na+ > Mg2+2. 比较下列微粒的半径大小
Cl- 、 S2- 、 Na+ 、Mg2+ 、F-答案:半径 S2- > Cl- > F- >Na+ >Mg2+从元素周期律的发现
你想到了些什么? 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。
先辈们对真理执着追求的精神是我们人类不尽的财富。
他们的追求除了其优秀的个人素质以外,真理本身那种理性的美,也给了他们人生以巨大的乐趣。
同学们的学习是辛苦的,又是幸福的,每一门学科中都隐含着无穷的美。能引起情感共鸣的诗歌、散文和音乐,陶冶我们的情操;而化学学科中的新奇、和谐、简约,同样闪耀着美的光辉。
