第13章 地球、矿物与材料 地球上的矿产资源 矿物的组成
文档属性
| 名称 | 第13章 地球、矿物与材料 地球上的矿产资源 矿物的组成 |

|
|
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 牛津上海版(试用本) | ||
| 科目 | 科学 | ||
| 更新时间 | 2016-09-05 10:52:15 | ||
图片预览










文档简介
课件100张PPT。
矿物的组成 研究意义:
①矿物的化学成分是区别不同矿物
的重要依据;
②矿物化学成分的变化特点常作为
反映矿物形成条件的标志;
③矿物化学成分是人类利用矿物资源
的一个重要方面。
内容:
地壳的化学成分
元素的地球化学分类
矿物化学成分的变化
矿物中的水
矿物的化学式及其计算 矿物的形成,取决于:
① 元素的丰度;
② 元素的地球化学性质一、元素克拉克值(clarke):
各种化学元素在地壳中的平均含量。
即元素在地壳中的含量百分比。 §1 地壳中化学元素的丰度元素克拉克值:
1. 确定了地壳中各种地球化学作用的总背景
2. 它是衡量元素集中、分散及其程度的标尺如东秦岭Mo的区域丰度为2.3×10-6,而Mo的地壳丰度
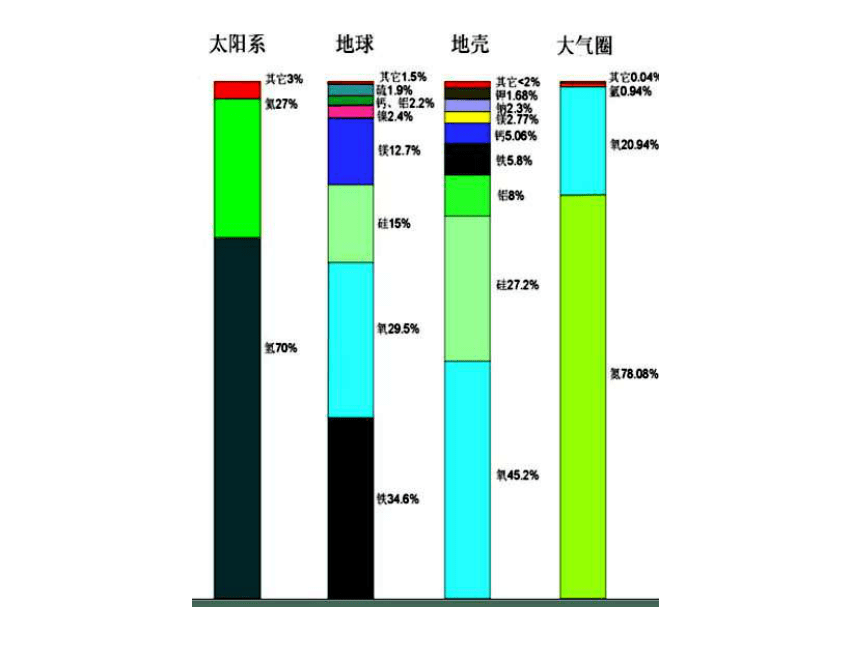
是1×10-6。所以,东秦岭是一个富Mo的地球化学省地壳中O、Si、Al、Fe、K、Na、Ca等元素丰度最高,浓度大,容易达到形成相应矿物的条件,而浓度小的元素较难形成独立矿物。这也是自然界矿物种类远远低于实验室条件下的化合物种类的原因二、地壳中化学元素的分布特征
1)元素丰度悬殊很大
丰度最大者: 氧 O —— 46.6%
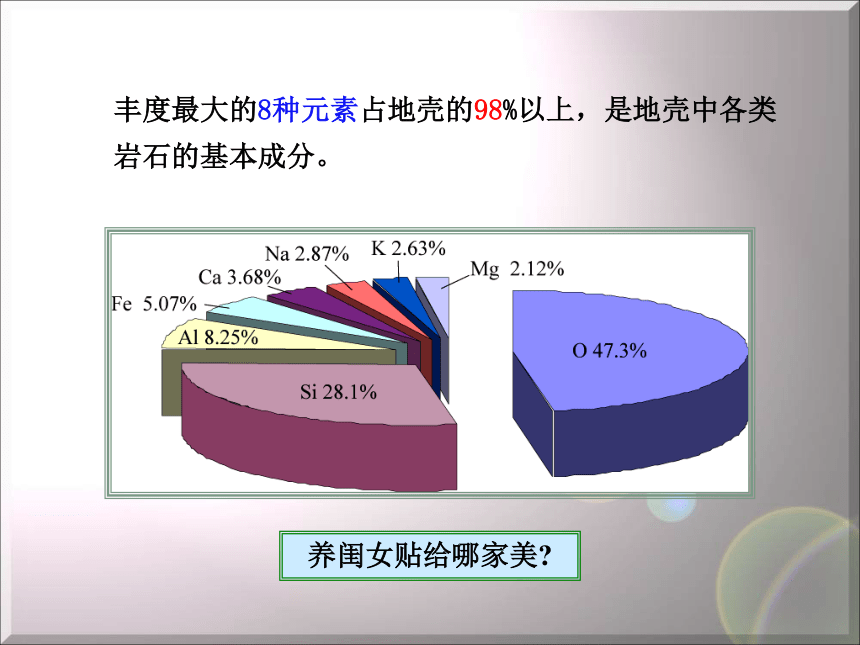
丰度最小者:砹 At ——3×10-24 %,一共只有0.28克 用于常量元素用于微量元素用于超微量元素丰度最大的8种元素占地壳的98%以上,是地壳中各类
岩石的基本成分。养闺女贴给哪家美? Composition of the crust含氧盐和氧化物矿物分布最广。其中:
硅酸盐矿物占矿物总种数的24%
占地壳总重量的3/4
氧化物矿物占矿物种总数的14%
占地壳总重量的17%2)元素不仅含量差别很大,而且它们分布
情况也不一样。聚集元素: aggregated element
趋向于集中,形成独立的矿物种,甚至聚集成矿床:Ti、Bi、Hg、Ag、Au等
分散元素: dispersed element
常常仅作为微量元素混入物赋存于主要由其它元素
组成的矿物中:Rb、Cs、Ga、Sc等§2 元素的地球化学性质在矿物形成的具体物理化学环境中,
该元素最喜欢形成什么类型的物质?
它是否呈一定价态阳离子或阴离子出现?
矿物将具有什么类型的化学键?……元素的离子类型惰性气体型离子:
最外层具8个电子(ns2np6)或2个电子(1s2)的离子
铜型离子:指外层具有18个电子(ns2np6nd10)或
(18+2)个电子(ns2np6nd10(n+1)s2)的离子
过渡型离子:指最外层电子数为9~17(ns2np6nd1~9)的离子惰性气体族
主要造岩元素族:碱金属和碱土金属、Si、Al
矿化剂族:B、C、N、O、F、P、S、Cl
铁族元素:Sc、Ti、V、Cr、Mn、Fe、Co、Ni
稀有金属元素:Y、REE、Zr、Hf、Nb、Ta放射性元素族:U、Th、Ra
钨钼族:W、Mo、Tc、Re
铂族元素:Os、Ir、Pt、Ru、Rh、Pd
金属矿床成矿元素族:
Cu、Ag、Au、Zn、Cd、Hg、Ga、In、Tl、
Ge、Sn、Pb。也称为“ 造矿元素”
半金属和重矿化剂族:
As、Sb、Bi、Se、Te、Po
重卤素族离子的结合还受外在环境的影响,如Fe、Mn :1. 在还原条件下多与硫结合形成:
黄铁矿或白铁矿(FeS2)、 硫锰矿(MnS);在氧化条件下多与氧形成:
赤铁矿(Fe2O3)、 磁铁矿(Fe3O4)、
软锰矿(MnO2)矿石青铜合金添加锡、铅浇铸冶炼过程中,矿石中的微量元素按其
化学亲和性的不同发生了再分配现象。富集于铜锭中的元素:
Cu、Bi、Ag、Au、As、Sb、Sn、Cd、Se、
Te、Ge等亲铜亲硫元素;
富集于炉渣中的元素:
Fe、Ca、Si、Al、K、Na、Zn、Ti、W、
Mo、Mn、Nb、Ta、Zr、Hf、V、Th、Be等
亲石亲铁元素和稀土元素;
在冶炼过程中挥发丢失了的元素:
S、B、W等。化学
组成
变化
化学组成
基本固定的矿物
非化学
计量矿物
化学组成
不固定的矿物类质同像矿物含层间水和 沸石水矿物胶体矿物如NaCl如Fe1-xS§3 矿物化学成分及其变化矿物化学成分的变化晶质矿物主要是类质同像
胶体矿物主要是吸附作用
任何结晶完全的矿物均不免存在包裹体等混入物§5 矿物的化学式及其计算一、矿物的化学式
1.概念
以组成矿物的化学元素符号按一定原则
表示矿物的化学成分。
2.表示方法
(1)“实验式”:
只表示矿物化学成分中各种组分的种类、数量比的化学式。
它不能反映原子在矿物中的结合关系。
白云母 K2O·3Al2O3·6SiO2·2H2O(2)“晶体化学式”或“结构式”:
除了能表示化学组分的种类、数量比外,
还能反映矿物中原子的结合情况:
白云母 K2O· 3Al2O3· 6SiO2· 2H2O
KAl2[(Si3Al)O10](OH)2 3BeO. Al2O3 .6SiO2------实验式
Be3Al2[Si6O18] ------结构式矿物晶体结构式的书写原则:
(1)阳离子写在化学式的开始,阴离子写在阳离子
之后,络阴离子要用方括弧括起来,以此与矿物
中其它构造单位区分;
如方解石Ca [CO3]
(2)在复盐中的阳离子要按离子的碱性强→弱排列;
如白云石 CaMg[CO3]2
(3)附加阴离子写在主要阴离子的后面;
如黄晶Al2[SiO4](F,OH)2(4)结晶水写在化学式的最后,用点号把它与矿物的
其它成分分开;若含水量不定,则常用nH2O或aq表示,
如绿松石CuAl6[PO4]4(OH)8?4H2O
蛋白石 SiO2·nH2O或SiO2·aq 。
(5)相互以类质同像置换的离子用圆括弧括起来,彼此
用“,”分开,按含量由多→少排列;
如堇青石(Mg,Fe)2Al3[Si5AlO18]
(6)有时为了详尽地表示出矿物的化学成分,还要说明
离子电价(变价离子)和对应的离子数目,按价态从
低→高排列。
如磁铁矿 FeFe2O4即Fe2+Fe3+2O4 特别说明:
在计算出矿物中各元素的离子数之后书写晶体化学式时,
习惯上将其具体数值分别写在各元素符号之右下角,同时
呈类质同像替代关系的各元素之间无需再加逗号,并在
小括号之后下角列出小括号内各元素离子数之总和。 如透辉石
(Ca0.960Na0.040)1.000(Mg0.820Fe2+0.060Fe3+0.050Al0.030
Mn0.020Ti0.020)1.000[(Si1.920Al0.080)2.000O6] CaMg [Si2O6] 二、矿物晶体化学式的计算
(一)依据
①. 单矿物的化学全分析数据;
②. 晶体化学理论及晶体结构知识,对矿物中各
元素的存在形式作出合理的判断,并按照电价
平衡原则,将其分配到适当的晶格位置上;
③. X射线结构分析资料。 说明:
单矿物的化学全分析的结果,其一般
允许误差≤1%,即矿物中的各元素或
氧化物的质量百分含量(WB%)之总和
应在99%~101%。 (二)方法
1.成分较简单的矿物化学式计算
步骤:
① 检查矿物化学分析结果是否符合精度要求。
②
③ 将各组分的摩尔数化为简单的整数。
④ 写出矿物的化学式。某黄铜矿的化学式计算 2.成分复杂的矿物化学式计算
计算原则:
⑴ 尽量使占位的离子数目保持合理;
⑵ 尽量使正负电荷总数保持平衡。
计算前提:
⑴ 必须有矿物的化学全分析数据;
⑵ 必须已知矿物的化学通式。阳离子法
氧原子法
例如: 辉石R2[Si2O6]
阳离子数为4 阴离子数为6SiO2 60.08 1 2 65.9 1.097 Si4+ 1.097 2.194 2.937
Al2O3 100.16 2 3 19.45 0.194 Al3+ 0.388 0.583 1.040
Fe2O3 159.68 2 3 1.03 0.006 Fe3+ 0.013 0.019 0.035
CaO 56.08 1 1 0.61 0.011 Ca2+ 0.011 0.011 0.029
Na2O 61.96 2 1 7.12 0.115 Na+ 0.230 0.115 0.615
K2O 94.2 2 1 6.2 0.066 K+ 0.132 0.066 0.353
total 100.31 2.988 5.009 These columns can be omittedFactor = #ox. in formula/Σ(oxygens)= 8/2.988=2.677(Na,K) AlSi3O8Finally, we can write the formula:
(Ca0.03Na0.62K0.35)1(Fe0.04Al1.04Si2.94)4.02O8Ca+Na+K = 1.00 Fe+Al+Si = 4.02A: 50%B: 40%C: 10%辉石 R2+2[Si2O6]1.在总结了世界各地5759个矿样(矿物、岩石、土壤和天然水)的分析数据后,第一次提出元素在地壳中的平均含量值(平均重量百分比),即地壳中元素的丰度
2.为表彰他的卓越贡献,国际地质学会将地壳元素丰度命名为克拉克值。Frank Wigglesworth Clarke
美国地球化学家 (1847-1931)碱金属、碱土金属以及Si、Al元素可以形成8e或2e的
稳定惰性气体型离子。
它们有较大的半径和较弱的极化能力。
原子与离子半径差别很大,因而有着强烈的形成离子
的趋势,从而易以离子键与阴离子相结合,特别是与
氧结合,形成氧化物或含氧盐,组成大部分的造岩矿
物。所以,它们被称为“造岩元素”、“亲石元素”、
“亲氧元素”。Cu、Ag、Zn、Cd、Hg、Ga、In、Tl、Ge、Pb等
元素的矿物常形成金属矿床,即“造矿元素”。它们的
离子最外层具18e,称为铜型离子,具有强极化性。
它们的原子和离子半径差别很小,不易丢失外层电子
而形成阳离子,所以与带负电的阴离子无显著亲合性,
相反却倾向与易形成共价键的硫相结合,因此称它们
为“亲硫元素”。定比定律 Law of definite proportions
?化合物无论其来源或制备方法为何,其组成
元素之间有恒定的质量比。?
例如:二氧化碳(CO2)不论是动物呼吸作用所呼出
的二氧化碳,或是燃烧木材产生的二氧化碳,
抑或是碳酸钙热解后所产生的二氧化碳,其中
所含的碳元素与氧元素的质量量比都一定是
3 :8 非化学计量矿物
某些含变价元素的矿物,因形成过程中常处于
不同的氧化还原条件下,其价态会发生变化。
由于受化合物电中性的制约,其内部必然存在
某种晶格缺陷,致使其化学组成偏离理想化合
比,不再遵循定比定律。如:
磁黄铁矿 Fe1-xS
相对于S来说,Fe是不足的, x = 0~0.223 原因是有部分Fe2+被Fe3+替代,为了保持电价平衡,
在结构中Fe2+位置上出现了部分空位。化学计量矿物:
在各晶格位置上的组分之间遵守定比定律、
具严格化合比的矿物。 如 水晶 SiO2
定比定律:
即每一种化合物,不论它是天然存在的,还是人工合成的,也不论它是用什么方法制备的,它的组成元素的质量都有一定的比例关系 化学计量矿物:
在发生类质同像替代的矿物中,虽然互相替换的
元素之间的数量是可变的,但它们的总和与其它
元素之间仍遵守定比定律。
如 橄榄石 (Mg,Fe)2[SiO4]等。类质同像 在晶体结构中部分质点为它种质点所代替,
只引起晶格常数不大的变化,而晶体结构
保持不变的现像。 等价类质同像:相互代换的质点电价相同 异价类质同像:相互代换的质点电价不相同
完全类质同像:
不完全类质同像:如ZnS中的Fe。类质同像的形成条件质点大小相近,两者有近似的半径:
< 15%:完全类质同像;
15?25%:低温不完全类质同像,高温完全类质同像;25?40%:即使在高温下也只能形成有限代换,
低温条件下不能形成类质同像。 但异价类质同像替换中,离子半径的限制不起决定作用,如rAl3+为0.039,rSi4+为0.026,相差50%类质同像的形成条件相似的化学键性:
惰气型离子易形成离子键,铜型离子易形成共价键。
这两种不同类型的离子之间,不易形成类质同像代换。
热力学条件:
温度升高有利于类质同像。
压力增大将限制类质同像代替的范围电价的总和平衡:
代换前后,离子电价总和应保持平衡,
否则会引起晶体结构的破坏。 组分浓度:
一种矿物晶体,其组成成分间有一定的量比。
当它从熔体或溶液中结晶时,介质中各组分若不能与上述量比相适应,即某种组分不足时.则将有与之类似的组分以类质同像的方式混入晶格加以补偿。类质同像的形成条件异价类质同像点电荷补偿法电价较高的阳离子被数量较多的低价阳离子代换,或者相反。
(云母中3Mg2+→2Al3+)
高价阳离子代换低价阳离子的同时,另有低价阳离子代换
高价阳离子,即离子成对的代换。(斜长石中Ca2++Al3+→Na++Si4+)
高价阳离子代换低价阳离子,电价由附加阴离子来补偿。
(萤石中Y3++F-→ Ca2+)
低价阳离子代换高价阳离子,伴随着低价阴离子置换高价阴离子(磷灰石中Na++CO32-→ Ca2++PO43-)研究类质同像的意义它是引起矿物化学成分变化的主要因素,对其研究有助于阐明矿床中元素的赋存状态,寻找稀有分散元素。如Re本身很少或根本不形成独立的矿物。类质同像的形成与矿物生成条件有关,对其研究有助于了解成矿条件类质同像替换会导致矿物相应的物理性质变化。如颜色、光泽、条痕、折射率、比重、硬度、熔点等的规律变化类质同像的分解常造成某些元素的次生富集,对其研究有助于分析氧化带的分布情况,以进一步寻找原生矿床研究类质同像的意义一、水的存在形式
H2O、(OH)-、H+ 和 (H3O)+
二、“水” 的类型§4 矿物中的水吸附水
结晶水
结构水
沸石水
层间水过渡类型 1.吸附水
被机械地吸附于矿物颗粒的表面和裂隙中,
或渗入矿物集合体中的中性水分子(H2O)。
它不参加晶格,不属于矿物的化学组成。
含量不固定,随环境温度和湿度而变表示方法:H2O-(负水)说明:
1)吸附水含量不定,随温度和湿度而异。
常压下,温度增至100~110℃时,矿物
中吸附水即全部失去而不破坏晶格。
2)吸附水的一种特殊类型——胶体水,
是胶体矿物本身的固有特征,应列入
矿物的化学式,但其含量不固定。
如蛋白石:SiO2·nH2O。
胶体水的失水温度一般100~250℃。 2.结晶水
以H2O的形成存在于矿物晶格中一定位置上的水,
是矿物固有组分之一,水含量一定,其数目与其他组分的含量成简单的比例关系。结晶水受到晶格的束缚,结合较牢固。Cu[SO4](H2O)5 ? Cu[SO4](H2O)3 ? Cu[SO4](H2O) ? Cu[SO4]
胆矾 三水胆矾 泼水胆矾 铜锭石
(三斜) (单斜) (单斜) (斜方)30 ?C100 ?C400 ?C 说明:
1)结晶水出现于大半径络阴离子的含氧盐矿物中。
2)结晶水的作用:
通过以一定的配位形式环绕小半径的阳离子
形成水化阳离子,以增大阳离子的体积而
不改变其电价,从而与大的络阴离子组成
稳定的化合物。
3)结晶水的失水温度一般均在200~500℃,
个别可高达600℃。
4)失去结晶水后,矿物晶格即完全被破坏、
改造而成新的结构。可利用脱水温度
鉴定矿物。3.结构水(化合水)
以(OH)-、H+ 或(H3O)+离子形式存在于晶格之中,在晶格中占据严格的位置并有确定的含量比,与其他离子的联系相当牢固。
平衡晶体中多余的电荷
充填结构空隙 高岭石: Al4[Si4O10](OH)8说明:
1)结构水以(OH)-最常见,主要存在于
氢氧化物和层状硅酸盐等矿物中。如:
水镁石 Mg(OH)2
水云母 (K,H3O)Al2[AlSi3O10](OH)2
2)结构水的失水温度一般约在600~1000℃。
失水后结构完全被破坏。 4.层间水
以中性水分子的形式存在于某些层状结构硅酸盐(如粘土矿物)晶格中结构层之间的H2O,其主要与层间阳离子结合成水合离子。
参与晶格但含量有变化,主要与吸附阳离子的种类以及环境的温度和湿度有关,介于结晶水和吸附水之间。其含量可在相当大的范围内变化,并可有确定的上限值。如:
钠蒙脱石为1个水分子层、钙蒙脱石为2个;
多水高岭石Al4[Si4O10](OH)8·4H2O的C0为10埃,
400°时C0为7埃。1)失水温度一般100~250℃±。
通常加热至几十度即开始脱水,
常压下至110℃±则大量失水。
2)失水后,晶格并不被破坏,仅结构层
之间距离缩短,晶胞参数c0减小,矿物
的比重和折射率增大;
且在潮湿的环境中又可重新吸水。说明: 5.沸石水
以中性水分子的形式存在架状结构硅酸盐沸石族矿物结构的孔隙和空洞中,与其中的阳离子结合成水合离子。有一定的配位数,失水后,矿物结构基本不变,只是矿物的物理化学性质发生一些变化,失水温度低,失水后可以重新获得 说明:
1)水的含量随温度和湿度而异,上限值与其他组分
含量具简单比例关系。
2)失水一般从80℃开始,400℃时沸石水可全部失去。
3)沸石水易失去也易复得,其得失不会破坏晶格,
只是矿物的晶格常数和某些物理性质稍有变化。
失水后的沸石可重新吸水,并恢复到原来的
含水限度,再现其原来的物理性质。
如钠沸石 Na2[(Al2Si3O10]·2H2O 。特别说明:
1)单矿物的化学全分析数据中,H2O-称负水,通常
意指不参加晶格的吸附水,当样品烘干到110℃
之前即全部逸去;而正水H2O+ 系指参加晶格的
结构水或结晶水,其失水温度通常高于110℃。
2)有些参加晶格的层间水、沸石水及部分结晶水在
低于110℃也可逸出晶格,故分析时应以特殊方法
处理样品中的水。 一、有关胶体的概念
胶体矿物及其化学成分特点胶体是一种物质的微粒(粒径100-l0000nm)分散于
另一种物质之中所形成的均匀的细分散系。
前种物质称为分散相(或分散质),
后种物质称为分散媒(或分散介质)。胶体的结构多数胶体的分散相质点都是晶质的,它们的表面
电性不饱和,称这个微粒为胶核。
胶核优先吸附存在于介质中的与自己组成相同
(或相似)的离子,在胶核外面形成一个吸附层,
构成带一定电荷的胶粒,为了平衡吸附层的电荷,
带电的胶粒还要吸附介质中的其他异性离子,
这种离子在介质中有一定的自由移动能力,
因而形成一个扩散层。胶体的结构核表面离子吸附层反离子扩散层胶体带电规律:
(1)正胶体:胶粒带正电。
(2)负胶体:胶粒带负电。 在自然界中负胶体比正胶体分布更为广泛胶体的选择吸附性胶体的选择吸附,是指胶粒在不同溶液中仅能吸附
某些与胶粒电荷相反的离子,而对其他物质吸附
很少或完全不吸附。如:
MnO2负胶体可以吸附Cu+、Pb2+、Zn2+、Co2+、Ni2+、
K+、Li+等40余种阳离子;
Fe(OH)3正胶体能吸附V、P、As、Cr等元素的络阴离子一般情况下,阳离子电价愈高,置换能力愈强,
一旦被粘土吸附,就难被置换。
在电价相等时,置换能力随离子半径增大而增强,金属阳离子置换能力按下列顺序递减:
Al3+ >Ba2+ >Sr2+ >Ca2+ >Mg2+ >NH4+ >K+ >Na+> Li+
若左边的离子被吸附后,很难用右边的离子去置换胶体对离子吸附的选择性,还表现在对一些离子
吸附的难易程度不同,进而表现为被吸附离子之
间的交换。最常见的是粘土矿物的离子交换现像。 二、胶体矿物的概念
由以水为分散媒、以固相为分散相的水胶凝体
而形成的非晶质或超显微的隐晶质矿物。
严格地说,它只是含吸附水的准矿物。
如:粘土矿物、
铁、铝、锰、硅等水合氧化物 三. 胶体矿物的形成形成胶体溶液:
物理风化作用:
出离地表的矿物或矿物集合体,由于机械破碎
或磨蚀而形成胶粒大小的质点,当它们分散于
水中即成为胶体溶液;
化学风化作用:
原生矿物分解成离子或分子状态,然后进一步
饱和聚集而成胶体溶液。2. 胶体溶液的凝聚胶体溶液在迁移过程中或汇聚于水盆地后,
或因与带有相反电荷的质点发生电性中和而沉淀,
或因水分蒸发而凝聚,从而形成各种胶体矿物。四. 胶体矿物的特点:
①多形成于表生作用中,少数为热液或火山成因。
②主要形成Fe、Mn、Al、Si、P质等矿物。
③为隐晶质或非晶质体,故呈现鲕状、肾状、
钟乳状和葡萄状等特殊形态。
④由于胶体形成时的吸附作用,故胶体矿物的
化学成分变化大。具有不固定性和复杂性。五、胶体的老化
胶体矿物形成后,随着时间的推移或热力学
因素的改变,胶粒会自发地凝聚,进一步发
生脱水作用,颗粒逐渐增大而成为隐晶质,
最终可转变为显晶质矿物。 变胶体矿物:
由胶体矿物老化形成的隐晶质或显晶质矿物,
往往可保留原胶体矿物的外貌。
如蛋白石经老化成为玉髓。胶粒细
分
散
系非晶质
无规则几何外形
可变性和复杂性极大比表面积
带电荷
选择性吸附胶体的特点胶体矿物特点胶体 胶体矿物主要形成于岩石风化壳中 鲕状肾状Mg(OH)2的结构即元素丰度就是化学元素在一定自然体中
的相对平均含量一种化学元素在某个自然体中的重量占这个自然体总重量的相对份额(如百分数),称为该元素在自然体中的丰度主要是含水的Al、Fe和Mg的层状结构硅酸盐矿物,晶体一般小于2微米
矿物的组成 研究意义:
①矿物的化学成分是区别不同矿物
的重要依据;
②矿物化学成分的变化特点常作为
反映矿物形成条件的标志;
③矿物化学成分是人类利用矿物资源
的一个重要方面。
内容:
地壳的化学成分
元素的地球化学分类
矿物化学成分的变化
矿物中的水
矿物的化学式及其计算 矿物的形成,取决于:
① 元素的丰度;
② 元素的地球化学性质一、元素克拉克值(clarke):
各种化学元素在地壳中的平均含量。
即元素在地壳中的含量百分比。 §1 地壳中化学元素的丰度元素克拉克值:
1. 确定了地壳中各种地球化学作用的总背景
2. 它是衡量元素集中、分散及其程度的标尺如东秦岭Mo的区域丰度为2.3×10-6,而Mo的地壳丰度
是1×10-6。所以,东秦岭是一个富Mo的地球化学省地壳中O、Si、Al、Fe、K、Na、Ca等元素丰度最高,浓度大,容易达到形成相应矿物的条件,而浓度小的元素较难形成独立矿物。这也是自然界矿物种类远远低于实验室条件下的化合物种类的原因二、地壳中化学元素的分布特征
1)元素丰度悬殊很大
丰度最大者: 氧 O —— 46.6%
丰度最小者:砹 At ——3×10-24 %,一共只有0.28克 用于常量元素用于微量元素用于超微量元素丰度最大的8种元素占地壳的98%以上,是地壳中各类
岩石的基本成分。养闺女贴给哪家美? Composition of the crust含氧盐和氧化物矿物分布最广。其中:
硅酸盐矿物占矿物总种数的24%
占地壳总重量的3/4
氧化物矿物占矿物种总数的14%
占地壳总重量的17%2)元素不仅含量差别很大,而且它们分布
情况也不一样。聚集元素: aggregated element
趋向于集中,形成独立的矿物种,甚至聚集成矿床:Ti、Bi、Hg、Ag、Au等
分散元素: dispersed element
常常仅作为微量元素混入物赋存于主要由其它元素
组成的矿物中:Rb、Cs、Ga、Sc等§2 元素的地球化学性质在矿物形成的具体物理化学环境中,
该元素最喜欢形成什么类型的物质?
它是否呈一定价态阳离子或阴离子出现?
矿物将具有什么类型的化学键?……元素的离子类型惰性气体型离子:
最外层具8个电子(ns2np6)或2个电子(1s2)的离子
铜型离子:指外层具有18个电子(ns2np6nd10)或
(18+2)个电子(ns2np6nd10(n+1)s2)的离子
过渡型离子:指最外层电子数为9~17(ns2np6nd1~9)的离子惰性气体族
主要造岩元素族:碱金属和碱土金属、Si、Al
矿化剂族:B、C、N、O、F、P、S、Cl
铁族元素:Sc、Ti、V、Cr、Mn、Fe、Co、Ni
稀有金属元素:Y、REE、Zr、Hf、Nb、Ta放射性元素族:U、Th、Ra
钨钼族:W、Mo、Tc、Re
铂族元素:Os、Ir、Pt、Ru、Rh、Pd
金属矿床成矿元素族:
Cu、Ag、Au、Zn、Cd、Hg、Ga、In、Tl、
Ge、Sn、Pb。也称为“ 造矿元素”
半金属和重矿化剂族:
As、Sb、Bi、Se、Te、Po
重卤素族离子的结合还受外在环境的影响,如Fe、Mn :1. 在还原条件下多与硫结合形成:
黄铁矿或白铁矿(FeS2)、 硫锰矿(MnS);在氧化条件下多与氧形成:
赤铁矿(Fe2O3)、 磁铁矿(Fe3O4)、
软锰矿(MnO2)矿石青铜合金添加锡、铅浇铸冶炼过程中,矿石中的微量元素按其
化学亲和性的不同发生了再分配现象。富集于铜锭中的元素:
Cu、Bi、Ag、Au、As、Sb、Sn、Cd、Se、
Te、Ge等亲铜亲硫元素;
富集于炉渣中的元素:
Fe、Ca、Si、Al、K、Na、Zn、Ti、W、
Mo、Mn、Nb、Ta、Zr、Hf、V、Th、Be等
亲石亲铁元素和稀土元素;
在冶炼过程中挥发丢失了的元素:
S、B、W等。化学
组成
变化
化学组成
基本固定的矿物
非化学
计量矿物
化学组成
不固定的矿物类质同像矿物含层间水和 沸石水矿物胶体矿物如NaCl如Fe1-xS§3 矿物化学成分及其变化矿物化学成分的变化晶质矿物主要是类质同像
胶体矿物主要是吸附作用
任何结晶完全的矿物均不免存在包裹体等混入物§5 矿物的化学式及其计算一、矿物的化学式
1.概念
以组成矿物的化学元素符号按一定原则
表示矿物的化学成分。
2.表示方法
(1)“实验式”:
只表示矿物化学成分中各种组分的种类、数量比的化学式。
它不能反映原子在矿物中的结合关系。
白云母 K2O·3Al2O3·6SiO2·2H2O(2)“晶体化学式”或“结构式”:
除了能表示化学组分的种类、数量比外,
还能反映矿物中原子的结合情况:
白云母 K2O· 3Al2O3· 6SiO2· 2H2O
KAl2[(Si3Al)O10](OH)2 3BeO. Al2O3 .6SiO2------实验式
Be3Al2[Si6O18] ------结构式矿物晶体结构式的书写原则:
(1)阳离子写在化学式的开始,阴离子写在阳离子
之后,络阴离子要用方括弧括起来,以此与矿物
中其它构造单位区分;
如方解石Ca [CO3]
(2)在复盐中的阳离子要按离子的碱性强→弱排列;
如白云石 CaMg[CO3]2
(3)附加阴离子写在主要阴离子的后面;
如黄晶Al2[SiO4](F,OH)2(4)结晶水写在化学式的最后,用点号把它与矿物的
其它成分分开;若含水量不定,则常用nH2O或aq表示,
如绿松石CuAl6[PO4]4(OH)8?4H2O
蛋白石 SiO2·nH2O或SiO2·aq 。
(5)相互以类质同像置换的离子用圆括弧括起来,彼此
用“,”分开,按含量由多→少排列;
如堇青石(Mg,Fe)2Al3[Si5AlO18]
(6)有时为了详尽地表示出矿物的化学成分,还要说明
离子电价(变价离子)和对应的离子数目,按价态从
低→高排列。
如磁铁矿 FeFe2O4即Fe2+Fe3+2O4 特别说明:
在计算出矿物中各元素的离子数之后书写晶体化学式时,
习惯上将其具体数值分别写在各元素符号之右下角,同时
呈类质同像替代关系的各元素之间无需再加逗号,并在
小括号之后下角列出小括号内各元素离子数之总和。 如透辉石
(Ca0.960Na0.040)1.000(Mg0.820Fe2+0.060Fe3+0.050Al0.030
Mn0.020Ti0.020)1.000[(Si1.920Al0.080)2.000O6] CaMg [Si2O6] 二、矿物晶体化学式的计算
(一)依据
①. 单矿物的化学全分析数据;
②. 晶体化学理论及晶体结构知识,对矿物中各
元素的存在形式作出合理的判断,并按照电价
平衡原则,将其分配到适当的晶格位置上;
③. X射线结构分析资料。 说明:
单矿物的化学全分析的结果,其一般
允许误差≤1%,即矿物中的各元素或
氧化物的质量百分含量(WB%)之总和
应在99%~101%。 (二)方法
1.成分较简单的矿物化学式计算
步骤:
① 检查矿物化学分析结果是否符合精度要求。
②
③ 将各组分的摩尔数化为简单的整数。
④ 写出矿物的化学式。某黄铜矿的化学式计算 2.成分复杂的矿物化学式计算
计算原则:
⑴ 尽量使占位的离子数目保持合理;
⑵ 尽量使正负电荷总数保持平衡。
计算前提:
⑴ 必须有矿物的化学全分析数据;
⑵ 必须已知矿物的化学通式。阳离子法
氧原子法
例如: 辉石R2[Si2O6]
阳离子数为4 阴离子数为6SiO2 60.08 1 2 65.9 1.097 Si4+ 1.097 2.194 2.937
Al2O3 100.16 2 3 19.45 0.194 Al3+ 0.388 0.583 1.040
Fe2O3 159.68 2 3 1.03 0.006 Fe3+ 0.013 0.019 0.035
CaO 56.08 1 1 0.61 0.011 Ca2+ 0.011 0.011 0.029
Na2O 61.96 2 1 7.12 0.115 Na+ 0.230 0.115 0.615
K2O 94.2 2 1 6.2 0.066 K+ 0.132 0.066 0.353
total 100.31 2.988 5.009 These columns can be omittedFactor = #ox. in formula/Σ(oxygens)= 8/2.988=2.677(Na,K) AlSi3O8Finally, we can write the formula:
(Ca0.03Na0.62K0.35)1(Fe0.04Al1.04Si2.94)4.02O8Ca+Na+K = 1.00 Fe+Al+Si = 4.02A: 50%B: 40%C: 10%辉石 R2+2[Si2O6]1.在总结了世界各地5759个矿样(矿物、岩石、土壤和天然水)的分析数据后,第一次提出元素在地壳中的平均含量值(平均重量百分比),即地壳中元素的丰度
2.为表彰他的卓越贡献,国际地质学会将地壳元素丰度命名为克拉克值。Frank Wigglesworth Clarke
美国地球化学家 (1847-1931)碱金属、碱土金属以及Si、Al元素可以形成8e或2e的
稳定惰性气体型离子。
它们有较大的半径和较弱的极化能力。
原子与离子半径差别很大,因而有着强烈的形成离子
的趋势,从而易以离子键与阴离子相结合,特别是与
氧结合,形成氧化物或含氧盐,组成大部分的造岩矿
物。所以,它们被称为“造岩元素”、“亲石元素”、
“亲氧元素”。Cu、Ag、Zn、Cd、Hg、Ga、In、Tl、Ge、Pb等
元素的矿物常形成金属矿床,即“造矿元素”。它们的
离子最外层具18e,称为铜型离子,具有强极化性。
它们的原子和离子半径差别很小,不易丢失外层电子
而形成阳离子,所以与带负电的阴离子无显著亲合性,
相反却倾向与易形成共价键的硫相结合,因此称它们
为“亲硫元素”。定比定律 Law of definite proportions
?化合物无论其来源或制备方法为何,其组成
元素之间有恒定的质量比。?
例如:二氧化碳(CO2)不论是动物呼吸作用所呼出
的二氧化碳,或是燃烧木材产生的二氧化碳,
抑或是碳酸钙热解后所产生的二氧化碳,其中
所含的碳元素与氧元素的质量量比都一定是
3 :8 非化学计量矿物
某些含变价元素的矿物,因形成过程中常处于
不同的氧化还原条件下,其价态会发生变化。
由于受化合物电中性的制约,其内部必然存在
某种晶格缺陷,致使其化学组成偏离理想化合
比,不再遵循定比定律。如:
磁黄铁矿 Fe1-xS
相对于S来说,Fe是不足的, x = 0~0.223 原因是有部分Fe2+被Fe3+替代,为了保持电价平衡,
在结构中Fe2+位置上出现了部分空位。化学计量矿物:
在各晶格位置上的组分之间遵守定比定律、
具严格化合比的矿物。 如 水晶 SiO2
定比定律:
即每一种化合物,不论它是天然存在的,还是人工合成的,也不论它是用什么方法制备的,它的组成元素的质量都有一定的比例关系 化学计量矿物:
在发生类质同像替代的矿物中,虽然互相替换的
元素之间的数量是可变的,但它们的总和与其它
元素之间仍遵守定比定律。
如 橄榄石 (Mg,Fe)2[SiO4]等。类质同像 在晶体结构中部分质点为它种质点所代替,
只引起晶格常数不大的变化,而晶体结构
保持不变的现像。 等价类质同像:相互代换的质点电价相同 异价类质同像:相互代换的质点电价不相同
完全类质同像:
不完全类质同像:如ZnS中的Fe。类质同像的形成条件质点大小相近,两者有近似的半径:
< 15%:完全类质同像;
15?25%:低温不完全类质同像,高温完全类质同像;25?40%:即使在高温下也只能形成有限代换,
低温条件下不能形成类质同像。 但异价类质同像替换中,离子半径的限制不起决定作用,如rAl3+为0.039,rSi4+为0.026,相差50%类质同像的形成条件相似的化学键性:
惰气型离子易形成离子键,铜型离子易形成共价键。
这两种不同类型的离子之间,不易形成类质同像代换。
热力学条件:
温度升高有利于类质同像。
压力增大将限制类质同像代替的范围电价的总和平衡:
代换前后,离子电价总和应保持平衡,
否则会引起晶体结构的破坏。 组分浓度:
一种矿物晶体,其组成成分间有一定的量比。
当它从熔体或溶液中结晶时,介质中各组分若不能与上述量比相适应,即某种组分不足时.则将有与之类似的组分以类质同像的方式混入晶格加以补偿。类质同像的形成条件异价类质同像点电荷补偿法电价较高的阳离子被数量较多的低价阳离子代换,或者相反。
(云母中3Mg2+→2Al3+)
高价阳离子代换低价阳离子的同时,另有低价阳离子代换
高价阳离子,即离子成对的代换。(斜长石中Ca2++Al3+→Na++Si4+)
高价阳离子代换低价阳离子,电价由附加阴离子来补偿。
(萤石中Y3++F-→ Ca2+)
低价阳离子代换高价阳离子,伴随着低价阴离子置换高价阴离子(磷灰石中Na++CO32-→ Ca2++PO43-)研究类质同像的意义它是引起矿物化学成分变化的主要因素,对其研究有助于阐明矿床中元素的赋存状态,寻找稀有分散元素。如Re本身很少或根本不形成独立的矿物。类质同像的形成与矿物生成条件有关,对其研究有助于了解成矿条件类质同像替换会导致矿物相应的物理性质变化。如颜色、光泽、条痕、折射率、比重、硬度、熔点等的规律变化类质同像的分解常造成某些元素的次生富集,对其研究有助于分析氧化带的分布情况,以进一步寻找原生矿床研究类质同像的意义一、水的存在形式
H2O、(OH)-、H+ 和 (H3O)+
二、“水” 的类型§4 矿物中的水吸附水
结晶水
结构水
沸石水
层间水过渡类型 1.吸附水
被机械地吸附于矿物颗粒的表面和裂隙中,
或渗入矿物集合体中的中性水分子(H2O)。
它不参加晶格,不属于矿物的化学组成。
含量不固定,随环境温度和湿度而变表示方法:H2O-(负水)说明:
1)吸附水含量不定,随温度和湿度而异。
常压下,温度增至100~110℃时,矿物
中吸附水即全部失去而不破坏晶格。
2)吸附水的一种特殊类型——胶体水,
是胶体矿物本身的固有特征,应列入
矿物的化学式,但其含量不固定。
如蛋白石:SiO2·nH2O。
胶体水的失水温度一般100~250℃。 2.结晶水
以H2O的形成存在于矿物晶格中一定位置上的水,
是矿物固有组分之一,水含量一定,其数目与其他组分的含量成简单的比例关系。结晶水受到晶格的束缚,结合较牢固。Cu[SO4](H2O)5 ? Cu[SO4](H2O)3 ? Cu[SO4](H2O) ? Cu[SO4]
胆矾 三水胆矾 泼水胆矾 铜锭石
(三斜) (单斜) (单斜) (斜方)30 ?C100 ?C400 ?C 说明:
1)结晶水出现于大半径络阴离子的含氧盐矿物中。
2)结晶水的作用:
通过以一定的配位形式环绕小半径的阳离子
形成水化阳离子,以增大阳离子的体积而
不改变其电价,从而与大的络阴离子组成
稳定的化合物。
3)结晶水的失水温度一般均在200~500℃,
个别可高达600℃。
4)失去结晶水后,矿物晶格即完全被破坏、
改造而成新的结构。可利用脱水温度
鉴定矿物。3.结构水(化合水)
以(OH)-、H+ 或(H3O)+离子形式存在于晶格之中,在晶格中占据严格的位置并有确定的含量比,与其他离子的联系相当牢固。
平衡晶体中多余的电荷
充填结构空隙 高岭石: Al4[Si4O10](OH)8说明:
1)结构水以(OH)-最常见,主要存在于
氢氧化物和层状硅酸盐等矿物中。如:
水镁石 Mg(OH)2
水云母 (K,H3O)Al2[AlSi3O10](OH)2
2)结构水的失水温度一般约在600~1000℃。
失水后结构完全被破坏。 4.层间水
以中性水分子的形式存在于某些层状结构硅酸盐(如粘土矿物)晶格中结构层之间的H2O,其主要与层间阳离子结合成水合离子。
参与晶格但含量有变化,主要与吸附阳离子的种类以及环境的温度和湿度有关,介于结晶水和吸附水之间。其含量可在相当大的范围内变化,并可有确定的上限值。如:
钠蒙脱石为1个水分子层、钙蒙脱石为2个;
多水高岭石Al4[Si4O10](OH)8·4H2O的C0为10埃,
400°时C0为7埃。1)失水温度一般100~250℃±。
通常加热至几十度即开始脱水,
常压下至110℃±则大量失水。
2)失水后,晶格并不被破坏,仅结构层
之间距离缩短,晶胞参数c0减小,矿物
的比重和折射率增大;
且在潮湿的环境中又可重新吸水。说明: 5.沸石水
以中性水分子的形式存在架状结构硅酸盐沸石族矿物结构的孔隙和空洞中,与其中的阳离子结合成水合离子。有一定的配位数,失水后,矿物结构基本不变,只是矿物的物理化学性质发生一些变化,失水温度低,失水后可以重新获得 说明:
1)水的含量随温度和湿度而异,上限值与其他组分
含量具简单比例关系。
2)失水一般从80℃开始,400℃时沸石水可全部失去。
3)沸石水易失去也易复得,其得失不会破坏晶格,
只是矿物的晶格常数和某些物理性质稍有变化。
失水后的沸石可重新吸水,并恢复到原来的
含水限度,再现其原来的物理性质。
如钠沸石 Na2[(Al2Si3O10]·2H2O 。特别说明:
1)单矿物的化学全分析数据中,H2O-称负水,通常
意指不参加晶格的吸附水,当样品烘干到110℃
之前即全部逸去;而正水H2O+ 系指参加晶格的
结构水或结晶水,其失水温度通常高于110℃。
2)有些参加晶格的层间水、沸石水及部分结晶水在
低于110℃也可逸出晶格,故分析时应以特殊方法
处理样品中的水。 一、有关胶体的概念
胶体矿物及其化学成分特点胶体是一种物质的微粒(粒径100-l0000nm)分散于
另一种物质之中所形成的均匀的细分散系。
前种物质称为分散相(或分散质),
后种物质称为分散媒(或分散介质)。胶体的结构多数胶体的分散相质点都是晶质的,它们的表面
电性不饱和,称这个微粒为胶核。
胶核优先吸附存在于介质中的与自己组成相同
(或相似)的离子,在胶核外面形成一个吸附层,
构成带一定电荷的胶粒,为了平衡吸附层的电荷,
带电的胶粒还要吸附介质中的其他异性离子,
这种离子在介质中有一定的自由移动能力,
因而形成一个扩散层。胶体的结构核表面离子吸附层反离子扩散层胶体带电规律:
(1)正胶体:胶粒带正电。
(2)负胶体:胶粒带负电。 在自然界中负胶体比正胶体分布更为广泛胶体的选择吸附性胶体的选择吸附,是指胶粒在不同溶液中仅能吸附
某些与胶粒电荷相反的离子,而对其他物质吸附
很少或完全不吸附。如:
MnO2负胶体可以吸附Cu+、Pb2+、Zn2+、Co2+、Ni2+、
K+、Li+等40余种阳离子;
Fe(OH)3正胶体能吸附V、P、As、Cr等元素的络阴离子一般情况下,阳离子电价愈高,置换能力愈强,
一旦被粘土吸附,就难被置换。
在电价相等时,置换能力随离子半径增大而增强,金属阳离子置换能力按下列顺序递减:
Al3+ >Ba2+ >Sr2+ >Ca2+ >Mg2+ >NH4+ >K+ >Na+> Li+
若左边的离子被吸附后,很难用右边的离子去置换胶体对离子吸附的选择性,还表现在对一些离子
吸附的难易程度不同,进而表现为被吸附离子之
间的交换。最常见的是粘土矿物的离子交换现像。 二、胶体矿物的概念
由以水为分散媒、以固相为分散相的水胶凝体
而形成的非晶质或超显微的隐晶质矿物。
严格地说,它只是含吸附水的准矿物。
如:粘土矿物、
铁、铝、锰、硅等水合氧化物 三. 胶体矿物的形成形成胶体溶液:
物理风化作用:
出离地表的矿物或矿物集合体,由于机械破碎
或磨蚀而形成胶粒大小的质点,当它们分散于
水中即成为胶体溶液;
化学风化作用:
原生矿物分解成离子或分子状态,然后进一步
饱和聚集而成胶体溶液。2. 胶体溶液的凝聚胶体溶液在迁移过程中或汇聚于水盆地后,
或因与带有相反电荷的质点发生电性中和而沉淀,
或因水分蒸发而凝聚,从而形成各种胶体矿物。四. 胶体矿物的特点:
①多形成于表生作用中,少数为热液或火山成因。
②主要形成Fe、Mn、Al、Si、P质等矿物。
③为隐晶质或非晶质体,故呈现鲕状、肾状、
钟乳状和葡萄状等特殊形态。
④由于胶体形成时的吸附作用,故胶体矿物的
化学成分变化大。具有不固定性和复杂性。五、胶体的老化
胶体矿物形成后,随着时间的推移或热力学
因素的改变,胶粒会自发地凝聚,进一步发
生脱水作用,颗粒逐渐增大而成为隐晶质,
最终可转变为显晶质矿物。 变胶体矿物:
由胶体矿物老化形成的隐晶质或显晶质矿物,
往往可保留原胶体矿物的外貌。
如蛋白石经老化成为玉髓。胶粒细
分
散
系非晶质
无规则几何外形
可变性和复杂性极大比表面积
带电荷
选择性吸附胶体的特点胶体矿物特点胶体 胶体矿物主要形成于岩石风化壳中 鲕状肾状Mg(OH)2的结构即元素丰度就是化学元素在一定自然体中
的相对平均含量一种化学元素在某个自然体中的重量占这个自然体总重量的相对份额(如百分数),称为该元素在自然体中的丰度主要是含水的Al、Fe和Mg的层状结构硅酸盐矿物,晶体一般小于2微米
