鲁教版(五四制)九年级化学全册《4.2 金属的化学性质》第一课时课件 (共29张PPT)
文档属性
| 名称 | 鲁教版(五四制)九年级化学全册《4.2 金属的化学性质》第一课时课件 (共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-04 00:00:00 | ||
图片预览




文档简介
(共29张PPT)
烟台十三中
王美玉
金属和氧气、酸的反应
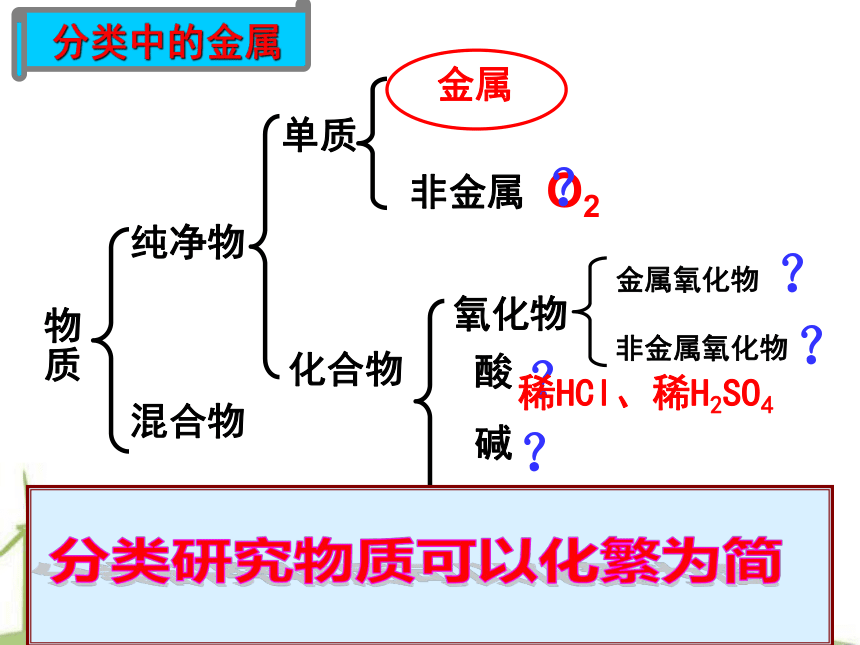
纯净物
混合物
单质
化合物
非金属
金属
氧化物
酸
碱
盐
O2
物质
分类中的金属
金属氧化物
非金属氧化物
?
?
?
?
?
?
稀HCl、稀H2SO4
1
2
3
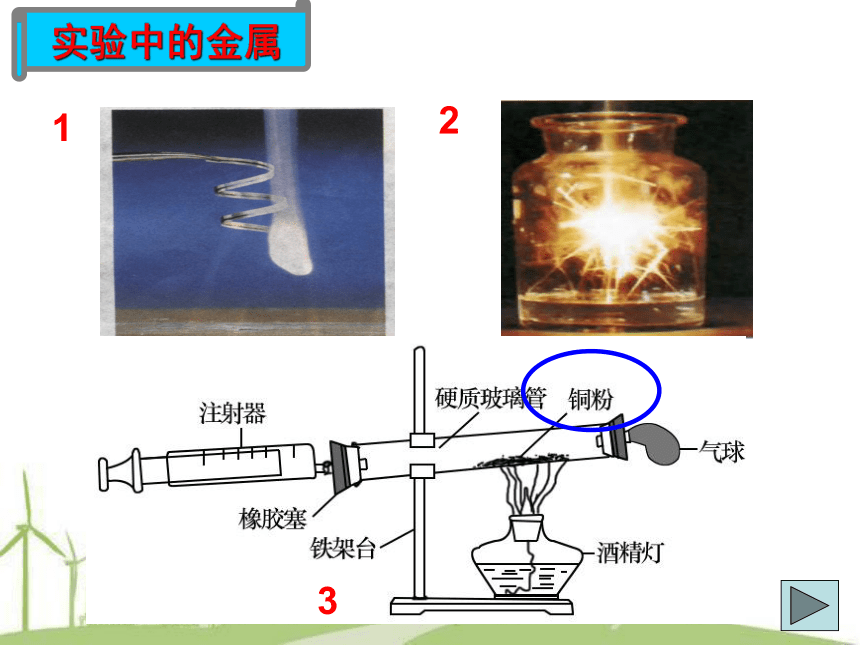
实验中的金属
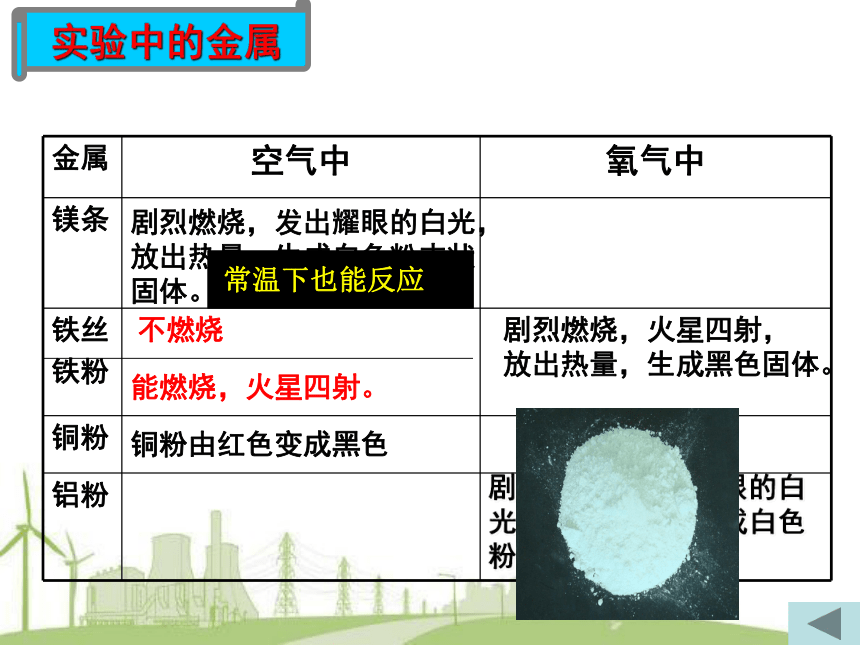
金属
空气中
氧气中
镁条
铁丝
铁粉
铜粉
铝粉
剧烈燃烧,发出耀眼的白光,
放出热量,生成白色粉末状
固体。
剧烈燃烧,火星四射,
放出热量,生成黑色固体。
铜粉由红色变成黑色
剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体
不燃烧
常温下也能反应
能燃烧,火星四射。
实验中的金属
①金属的性质、纯度、表面积、
表面氧化膜的处理程度、
②氧气的浓度
③反应的温度等
不相同
1.这些金属和O2反应的难易和剧烈程度是否相同?
2.哪些因素影响金属与氧气反应的难易和剧烈程度?
实验中的金属
2Mg+O2
2MgO
点燃
3Fe+2O2
Fe3O4
点燃
2Cu+O2
2CuO
△
4Al+3O2
2Al2O3
点燃
金属+氧气
金属氧化物
一定条件
(Au等例外)
实验中的金属
2Mg+O2
2MgO
点燃
+8
2
6
O
+12
2
8
2
Mg
+8
2
8
O2-
+12
2
8
Mg2+
Mg2+
O2-
微观结构中的金属
阅读课本P92多识一点
1
.为什么铝制品不易腐蚀?
铝常温下就很容易和氧气反应,生成一层致密而
坚固的氧化铝薄膜,阻止了内层的铝进一步氧化。
生活中的金属
照明弹
烟花
2
.镁粉、铝粉的应用
生活中的金属
纯净物
混合物
单质
化合物
非金属
金属
氧化物
酸
碱
盐
O2
物质
金属氧化物
非金属氧化物
?
?
?
?
稀HCl、稀H2SO4
你知道哪些金属能与酸反应?
它们与酸反应的共同现象是什么?
分类中的金属
1.所有的金属是否都能与酸反应?
2.不同金属与酸反应的剧烈程度是否相同?
提出
问题:
你的设计方案是什么?
思考:1.
你将选择哪些药品?
2.
你认为哪些因素会影响金属与酸反应的速率?
3.
你想通过观察什么现象来获得结论?
药品:镁片、锌片、铁片、铁粉、铜片、
3%的稀盐酸、
6%的稀盐酸、6%的稀硫酸、砂纸等
影响金属与酸反应速率的因素可能有:
①酸的种类、浓度、体积
②金属的性质、纯度、表面积、
表面氧化膜的处理情况等
③温度
观察金属丝表面是否有气泡产生,以及产生气泡速率的快慢。
镁片、锌片、铁片、铜片和
等浓度等体积的酸
说说本组的实验方案吧
实验中的金属
实验步骤
温馨提示:
1
盐酸、硫酸都有腐蚀性,实验时要小心,注意安全哦!
2
实验后把金属丝放回烧杯中
1
.向4支试管中加入2滴管的稀H2SO4
或稀HCl
2
.把镁片、锌片、铁片、铜片同时插入
稀H2SO4或稀HCl中,观察现象。
实验中的金属
实验现象
化学方程式
镁
锌
铁
铜
产生气泡,速度非常快,
固体减少
产生气泡,速度较快,
固体逐渐减少
无气泡产生
观察并记录实验现象写出有关方程式
产生气泡,速度很慢,
固体逐渐减少,溶液
逐渐变成浅绿色
Fe+H2SO4=FeSO4+H2↑
Fe
+
2HCl
=
FeCl2
+
H2↑
Mg+H2SO4=
MgSO4+
H2↑
Mg
+2HCl
=
MgCl2
+
H2↑
Zn+H2SO4=
ZnSO4+
H2↑
Zn+2HCl
=
ZnCl2
+
H2↑
不反应
实验中的金属
1.和酸反应的金属有________________,
不反应的金属有_______
,
因此_________所有的金属都能与酸反应。
获得结论
Mg、Zn、Fe
Cu
Mg
>Zn
>
Fe
>
Cu
不是
2.
这四种金属的活动性由强到弱的顺序是
__________________
实验中的金属
Mg
Zn
Fe
Cu
(H)
俄国化学家贝开托夫
已知:已知Al和酸反应,产生气泡
的速率比Mg慢但比Zn快
Al
Ag和酸不反应
比较金属活动性的方法:
利用金属与酸溶液反应的剧烈程度
Ag
实验中的金属
金属活动性由强到弱
常见金属在溶液中的活动性顺序
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
2
排在氢前面的金属能与酸反应放出氢气,
排在氢后面的金属不能与酸反应放出氢气
锡
铅
铂
金
意义
汞
1
在金属活动顺序中,金属的位置越
靠前,它的活动性就越强。
实验中的金属
Zn
Zn
SO4
2-
SO4
2-
H
+
H
+
H
+
H
+
Zn
2+
Zn
2+
H
H
H
H
H2
微观结构中的金属
H2
+11
2
8
1
Na
+13
+13
2
8
3
Al
+12
2
8
2
Mg
+19
2
8
1
8
+20
2
8
2
8
K
Ca
金属原子________电子------有共性
金属原子
_________的能力不同-----有差异性
微观结构中的金属
易失去
失去电子
即金属活动性顺序
2Mg
+
O2
2MgO
点燃
HCl
+
NaOH
NaCl
+
H2O
1
2
3
分类依据:根据反应前后物质的种类和类别进行分类
MgCl2
Mg
+
Cl2
通电
Zn
+
H2SO4
=
ZnSO4
+
H2↑
Zn
+
2HCl
=
ZnCl2
+
H2↑
Mg
+
H2SO4
=
MgSO4
+
H2↑
Mg
+
2HCl
=
MgCl2
+
H2↑
化合反应
分解反应
复分解反应
由一种单质和一种化合物生成另一种单质和另一种化合物的反应,叫做置换反应。
置换反应:
四大基本反应类型
2
.用铁锅炒菜时,最好加点食醋(主要成分是醋酸),
你知道其中的奥妙吗?
提示:已知铁元素是人体中必须元素,
缺铁会导致贫血。
利用了铁能与酸反应,可以生成可溶性的铁盐
被人体吸收,可预防缺铁性贫血。
1.制取氢气
思考:你认为选择哪种金属较好呢 为什么?
Zn
反应速率适中,便于控制
生活中看金属
假如你是金属原子的最外层电子,请参照本节内容,小组内进行自我介绍
嗨,大家好,我是金属原子的最外层电子。
…
…
金秋时节话收获
纯净物
混合物
单质
化合物
非金属
金属
氧化物
酸
碱
盐
O2
物质的分类
金属氧化物
非金属氧化物
?
?
?
稀HCl、稀H2SO4
金秋时节话收获
从物质类别入手,选择合适物质进行探究。
根据现象
获得结论
共性
个性
应用
分类法
实验法
控制变量法
观察法
归纳法
对比法
研究一类物质的方法
结构
性质
用途
金属
原子
金属
易失电子,有共性
物理性质
非常广泛
化学性质:能与氧气和酸反应
失电子的能力不同,有差异性,
金属活动顺序
金秋时节话收获
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
1、比较不同金属活动性的强弱
2、判断金属与酸(主要指盐酸、稀硫酸)
溶液能否发生置换发应
氢前的金属能置换出酸中的氢
前金>后金
金属活动性顺序的应用
金属活动性顺序将金属和酸溶液的知识由纷繁变得简单、条理。
它是我们学习金属、金属化合物的有力工具。
不法分子利用黄铜(Cu、Zn合金)冒充
黄金(Au)欺骗消费者,我们可用哪些
方法来鉴别真假黄金呢?
1.
测密度
2.
比较硬度
3.
看能否与O2反应而变黑
4.
看能否与酸反应生成气泡
巩固练习
独立包装的月饼包装袋里都有一小袋食品脱氧保鲜剂,它是以铁粉为主要物质制成的,如何辨别其是否失效?
课外探究
烟台十三中
王美玉
金属和氧气、酸的反应
纯净物
混合物
单质
化合物
非金属
金属
氧化物
酸
碱
盐
O2
物质
分类中的金属
金属氧化物
非金属氧化物
?
?
?
?
?
?
稀HCl、稀H2SO4
1
2
3
实验中的金属
金属
空气中
氧气中
镁条
铁丝
铁粉
铜粉
铝粉
剧烈燃烧,发出耀眼的白光,
放出热量,生成白色粉末状
固体。
剧烈燃烧,火星四射,
放出热量,生成黑色固体。
铜粉由红色变成黑色
剧烈燃烧,发出耀眼的白光,放出热量,生成白色粉末状固体
不燃烧
常温下也能反应
能燃烧,火星四射。
实验中的金属
①金属的性质、纯度、表面积、
表面氧化膜的处理程度、
②氧气的浓度
③反应的温度等
不相同
1.这些金属和O2反应的难易和剧烈程度是否相同?
2.哪些因素影响金属与氧气反应的难易和剧烈程度?
实验中的金属
2Mg+O2
2MgO
点燃
3Fe+2O2
Fe3O4
点燃
2Cu+O2
2CuO
△
4Al+3O2
2Al2O3
点燃
金属+氧气
金属氧化物
一定条件
(Au等例外)
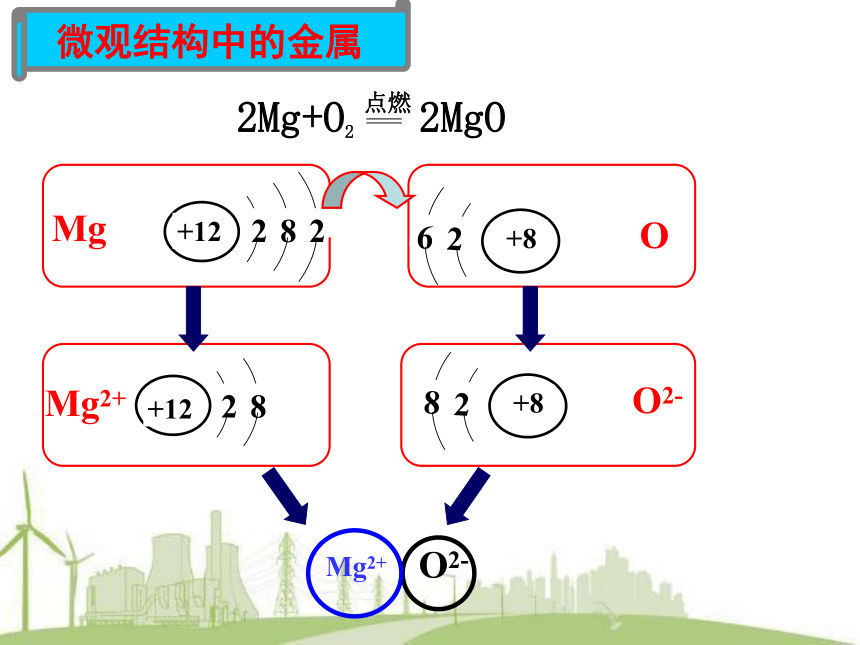
实验中的金属
2Mg+O2
2MgO
点燃
+8
2
6
O
+12
2
8
2
Mg
+8
2
8
O2-
+12
2
8
Mg2+
Mg2+
O2-
微观结构中的金属
阅读课本P92多识一点
1
.为什么铝制品不易腐蚀?
铝常温下就很容易和氧气反应,生成一层致密而
坚固的氧化铝薄膜,阻止了内层的铝进一步氧化。
生活中的金属
照明弹
烟花
2
.镁粉、铝粉的应用
生活中的金属
纯净物
混合物
单质
化合物
非金属
金属
氧化物
酸
碱
盐
O2
物质
金属氧化物
非金属氧化物
?
?
?
?
稀HCl、稀H2SO4
你知道哪些金属能与酸反应?
它们与酸反应的共同现象是什么?
分类中的金属
1.所有的金属是否都能与酸反应?
2.不同金属与酸反应的剧烈程度是否相同?
提出
问题:
你的设计方案是什么?
思考:1.
你将选择哪些药品?
2.
你认为哪些因素会影响金属与酸反应的速率?
3.
你想通过观察什么现象来获得结论?
药品:镁片、锌片、铁片、铁粉、铜片、
3%的稀盐酸、
6%的稀盐酸、6%的稀硫酸、砂纸等
影响金属与酸反应速率的因素可能有:
①酸的种类、浓度、体积
②金属的性质、纯度、表面积、
表面氧化膜的处理情况等
③温度
观察金属丝表面是否有气泡产生,以及产生气泡速率的快慢。
镁片、锌片、铁片、铜片和
等浓度等体积的酸
说说本组的实验方案吧
实验中的金属
实验步骤
温馨提示:
1
盐酸、硫酸都有腐蚀性,实验时要小心,注意安全哦!
2
实验后把金属丝放回烧杯中
1
.向4支试管中加入2滴管的稀H2SO4
或稀HCl
2
.把镁片、锌片、铁片、铜片同时插入
稀H2SO4或稀HCl中,观察现象。
实验中的金属
实验现象
化学方程式
镁
锌
铁
铜
产生气泡,速度非常快,
固体减少
产生气泡,速度较快,
固体逐渐减少
无气泡产生
观察并记录实验现象写出有关方程式
产生气泡,速度很慢,
固体逐渐减少,溶液
逐渐变成浅绿色
Fe+H2SO4=FeSO4+H2↑
Fe
+
2HCl
=
FeCl2
+
H2↑
Mg+H2SO4=
MgSO4+
H2↑
Mg
+2HCl
=
MgCl2
+
H2↑
Zn+H2SO4=
ZnSO4+
H2↑
Zn+2HCl
=
ZnCl2
+
H2↑
不反应
实验中的金属
1.和酸反应的金属有________________,
不反应的金属有_______
,
因此_________所有的金属都能与酸反应。
获得结论
Mg、Zn、Fe
Cu
Mg
>Zn
>
Fe
>
Cu
不是
2.
这四种金属的活动性由强到弱的顺序是
__________________
实验中的金属
Mg
Zn
Fe
Cu
(H)
俄国化学家贝开托夫
已知:已知Al和酸反应,产生气泡
的速率比Mg慢但比Zn快
Al
Ag和酸不反应
比较金属活动性的方法:
利用金属与酸溶液反应的剧烈程度
Ag
实验中的金属
金属活动性由强到弱
常见金属在溶液中的活动性顺序
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
2
排在氢前面的金属能与酸反应放出氢气,
排在氢后面的金属不能与酸反应放出氢气
锡
铅
铂
金
意义
汞
1
在金属活动顺序中,金属的位置越
靠前,它的活动性就越强。
实验中的金属
Zn
Zn
SO4
2-
SO4
2-
H
+
H
+
H
+
H
+
Zn
2+
Zn
2+
H
H
H
H
H2
微观结构中的金属
H2
+11
2
8
1
Na
+13
+13
2
8
3
Al
+12
2
8
2
Mg
+19
2
8
1
8
+20
2
8
2
8
K
Ca
金属原子________电子------有共性
金属原子
_________的能力不同-----有差异性
微观结构中的金属
易失去
失去电子
即金属活动性顺序
2Mg
+
O2
2MgO
点燃
HCl
+
NaOH
NaCl
+
H2O
1
2
3
分类依据:根据反应前后物质的种类和类别进行分类
MgCl2
Mg
+
Cl2
通电
Zn
+
H2SO4
=
ZnSO4
+
H2↑
Zn
+
2HCl
=
ZnCl2
+
H2↑
Mg
+
H2SO4
=
MgSO4
+
H2↑
Mg
+
2HCl
=
MgCl2
+
H2↑
化合反应
分解反应
复分解反应
由一种单质和一种化合物生成另一种单质和另一种化合物的反应,叫做置换反应。
置换反应:
四大基本反应类型
2
.用铁锅炒菜时,最好加点食醋(主要成分是醋酸),
你知道其中的奥妙吗?
提示:已知铁元素是人体中必须元素,
缺铁会导致贫血。
利用了铁能与酸反应,可以生成可溶性的铁盐
被人体吸收,可预防缺铁性贫血。
1.制取氢气
思考:你认为选择哪种金属较好呢 为什么?
Zn
反应速率适中,便于控制
生活中看金属
假如你是金属原子的最外层电子,请参照本节内容,小组内进行自我介绍
嗨,大家好,我是金属原子的最外层电子。
…
…
金秋时节话收获
纯净物
混合物
单质
化合物
非金属
金属
氧化物
酸
碱
盐
O2
物质的分类
金属氧化物
非金属氧化物
?
?
?
稀HCl、稀H2SO4
金秋时节话收获
从物质类别入手,选择合适物质进行探究。
根据现象
获得结论
共性
个性
应用
分类法
实验法
控制变量法
观察法
归纳法
对比法
研究一类物质的方法
结构
性质
用途
金属
原子
金属
易失电子,有共性
物理性质
非常广泛
化学性质:能与氧气和酸反应
失电子的能力不同,有差异性,
金属活动顺序
金秋时节话收获
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
1、比较不同金属活动性的强弱
2、判断金属与酸(主要指盐酸、稀硫酸)
溶液能否发生置换发应
氢前的金属能置换出酸中的氢
前金>后金
金属活动性顺序的应用
金属活动性顺序将金属和酸溶液的知识由纷繁变得简单、条理。
它是我们学习金属、金属化合物的有力工具。
不法分子利用黄铜(Cu、Zn合金)冒充
黄金(Au)欺骗消费者,我们可用哪些
方法来鉴别真假黄金呢?
1.
测密度
2.
比较硬度
3.
看能否与O2反应而变黑
4.
看能否与酸反应生成气泡
巩固练习
独立包装的月饼包装袋里都有一小袋食品脱氧保鲜剂,它是以铁粉为主要物质制成的,如何辨别其是否失效?
课外探究
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
