人教版必修二第一章第一节《元素周期表》教学设计
文档属性
| 名称 | 人教版必修二第一章第一节《元素周期表》教学设计 |  | |
| 格式 | zip | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-08 21:36:46 | ||
图片预览




文档简介
第一章
物质结构
元素周期律
第一节
元素周期表
一、学习目标分析
(一)学习目标确定的依据
《课程标准》
《模块学习要求》
能描述元素周期表的结构。
知道周期与族的概念,能描述元素周期表的结构。认识元素在周期表中的位置与其原子的电子层结构的关系。
(二)学习目标
知识与技能目标
(1)能描述元素周期表的结构
(2)知道常见金属、非金属在元素周期表中的位置
(3)初步了解原子结构与元素在周期表位置的关系
过程与方法目标
(1)引导学生自主学习:认识周期表的结构。
(2)培养学生通过分析和处理数据得出结论,形成概念,发现规律的思维方法。
3、情感态度与价值观目标
(1)通过化学史学习,培养勇于创新、不断探索的科学品质。
(2)通过各种元素周期表的图片,让学生认识到物质分类的多样性
二、教学重点难点分析
1、教学重点:元素周期表的结构。
2、教学难点:元素在元素周期表中的位置与原子结构之间的关系。
三、本课时内容在教材中的地位
《元素周期表》是人教版教材高一化学必修2第一章第一节内容。
本章以元素周期表和元素周期律为框架,先介绍元素周期表,再通过一些事实和实验归纳元素周期律。
本节从化学史引入,直接呈现元素周期表的结构。在学生了解一些元素性质和原子结构示意图的基础上,以周期表的纵向结构为线索,以碱金属和卤族元素为代表,通过比较原子结构(电子层数,最外层电子数)的异同,并通过实验和事实来呈现同主族元素性质的相似性和递变性。帮助学生认识元素性质与原子核外电子的关系。在此基础上,提出元素性质与原子核的关系,并由此引出核素和同位素的有关知识。
根据本教材的结构和内容分析,根据《新课标》,本节内容要求达到“能结合有关数据和实验事实认识元素周期律,了解原子结构与元素性质的关系;能描述元素周期表的结构,知道金属、非金属在元素周期表中的位置及其性质的递变规律”。
四、教学设计
【新课引入】这里有一份手稿,你知道它是什么吗?
【展示】门捷列夫最初绘制的元素周期表
【提问】你能看出门捷列夫的元素周期表是按照什么顺序排列的吗?
【回答】按照相对原子质量排列,且元素性质相似的元素在同一行。
【过渡】门捷列夫研制元素周期表的过程并不是一帆风顺的,是经历了很多波折的,下面我们就来看一看门捷列夫的故事。
【演示】门捷列夫发现周期表的故事(资料一)
【板书】第一节
元素周期表
一、元素周期表
【设问】那么我们现在所用的周期表和门捷列夫的周期表有何不同呢?
设计意图:通过看门捷列夫所绘制的周期表的原稿,让学生从中发现早期周期表的编排方法,激发学生学习元素周期表的兴趣,并对后面现代周期表编排原则的学习有一个对比,体会科学的进步。此外通过元素周期表发现的过程,让学生从门捷列夫研究发现周期表的故事中体会科学家孜孜以求的品质。
【过渡】目前我们最常使用的元素周期表是什么样的?在化学书的什么地方能找到元素周期表?
【活动】仔细观察元素周期表后,结合初中你所学的有关知识,回答下列问题:
1、元素周期表中共有多少行?多少列?
2、周期表中一个横行叫做什么?每一行各有多少种元素?
3、周期表中一个纵行叫做什么?每个纵行的名称分别是什么?用什么符号表示的?
4、是否还有未发现的元素没有填入元素周期表?如何知道的
5、元素周期表的每一个方格内都告诉了我们哪些有关元素的信息?
6、元素周期表中共有几种底色?分别代表什么?分布有什么特点?
7、周期表中有些元素用红框圈了起来,这些元素是哪类元素?
【回答】学生回答,教师补充。
1、元素周期表中共有7行18列。
2、周期表中一个横行叫做周期。(强调每个周期的元素种类,为后面根据原子序数推断元素位置做准备)
第一周期
第二周期
第三周期
第四周期
第五周期
第六周期
第七周期
2
8
8
18
18
32
26
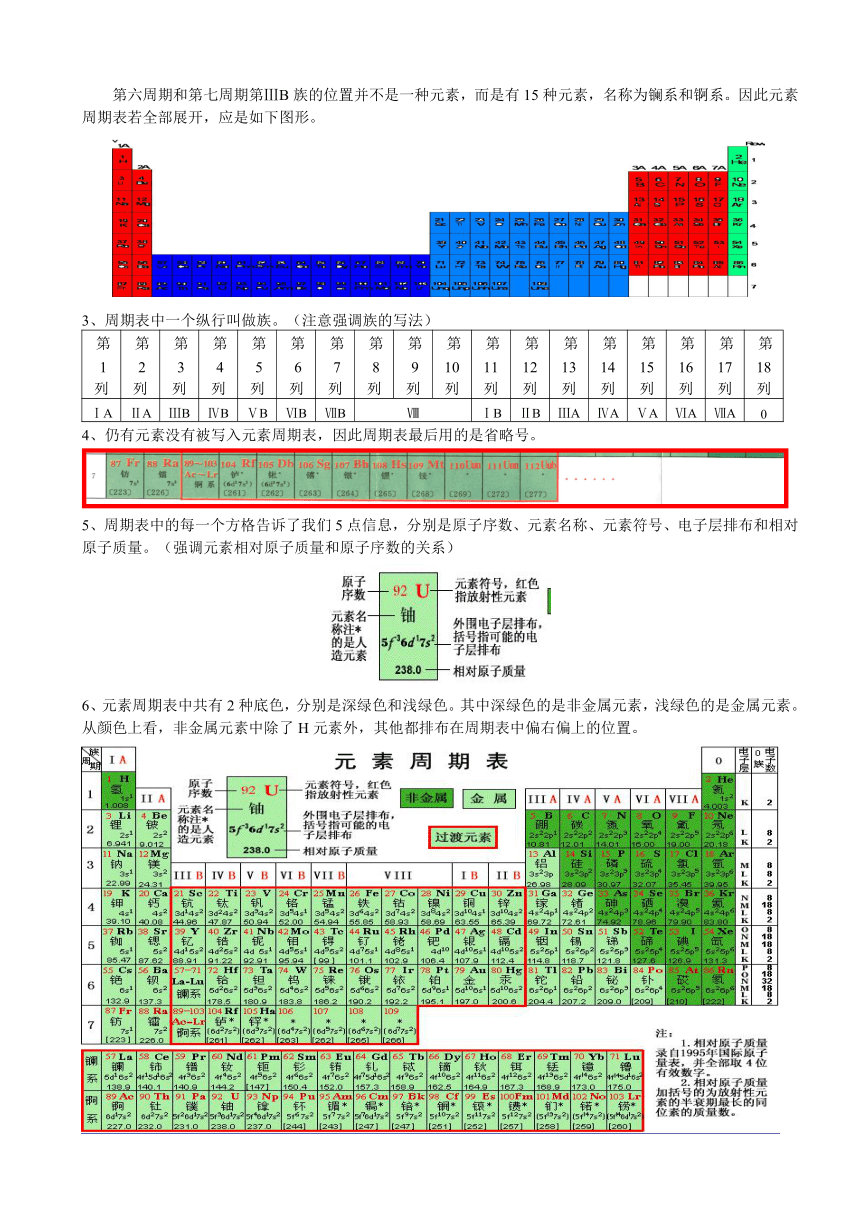
第六周期和第七周期第ⅢB族的位置并不是一种元素,而是有15种元素,名称为镧系和锕系。因此元素周期表若全部展开,应是如下图形。
3、周期表中一个纵行叫做族。(注意强调族的写法)
第1列
第2列
第3列
第4列
第5列
第6列
第7列
第8列
第9列
第10列
第11列
第12列
第13列
第14列
第15列
第16列
第17列
第18列
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
4、仍有元素没有被写入元素周期表,因此周期表最后用的是省略号。
5、周期表中的每一个方格告诉了我们5点信息,分别是原子序数、元素名称、元素符号、电子层排布和相对原子质量。(强调元素相对原子质量和原子序数的关系)
6、元素周期表中共有2种底色,分别是深绿色和浅绿色。其中深绿色的是非金属元素,浅绿色的是金属元素。从颜色上看,非金属元素中除了H元素外,其他都排布在周期表中偏右偏上的位置。
7、周期表中用红框圈起来的元素是过渡金属元素。(强调:金属元素不都是过渡金属元素,但过渡金属元素全都是金属元素)
设计意图:问题的设置是对元素周期表的充分认识,要让学生能够掌握对图表的整体阅读和具体阅读,提高学生分析的能力。
【讲解】周期表中前三个周期没有过渡金属元素,因此叫做短周期;周期表中后四个周期既有主族元素又有过渡元素,因此叫做长周期。周期表中共有16个族,其中七个主族,七个副族,一个0族,一个第Ⅷ族。
【板书】1、元素周期表的结构
短周期(1-3周期)
行→周期
三短四长未填全
7
七
长周期(4-7周期)
主族(七个)
列
→
族
副族(七个)
七主七副零Ⅷ族
18
十六
0族
第Ⅷ族
【过渡】周期表是如何排列的呢?其编排方法又经历了哪些变化呢?
【演示】元素周期表发展史(资料二)
【活动】我们现在使用的元素周期表是根据什么编排的呢?请阅读P4第一至第五段,回答下列问题:
1、元素周期表中的元素是按照什么顺序排列的?这与门捷列夫的元素周期表是否相同?
2、原子序数是如何确定的?它和原子结构有何关系?
3、什么样的元素位于同一周期?
4、什么样的元素位于周一主族?
【回答】边回答边记录板书
1、元素周期表中的元素是按照原子叙述排列的。而门捷列夫的元素周期表是按照相对原子质量排列的。
2、按照元素在周期表中的顺序给元素编号,得到原子序数。原子序数=质子数=核电荷数=核外电子数
3、电子层数相同的元素位于同一周期。
4、最外层电子数相同的元素位于同一主族。
【板书】2、元素周期表中的编排原则
(1)元素按原子叙述递增顺序排列
原子序数=质子数=核电荷数=核外电子数
(2)电子层数相同位于同周期
(3)最外层电子数相同位于同主族
设计意图:通过对数据的分析,找到元素周期表的编排原则,这有利于学生理解元素周期表的结构,并且对后面元素性质与原子结构关系的学习打下基础。【过渡】按照这样的编排原则,可以做出各种各样的元素周期表。
【展示】1、元素单质实物型元素周期表
2、元素性质图示型元素周期表
3、幽默对话式元素周期表
【展示】各种形状的元素周期表
【展示】学生作品展示
设计意图:体会元素周期表的多样性,并激发学生绘制周期表的兴趣。并能进一步从中体会周期表的编排原则。
【课堂练习】根据考点完成下列练习
考点1
元素周期表的结构和编排原则★
1、下列关于元素周期表的叙述中不正确的是(C)
A同周期元素的电子层数相同
B元素周期表共有7个周期,16个族
C过渡元素都是金属元素,金属元素都是过渡元素
D主族元素原子的最外层电子数与族序数相同
2、下列说法中正确的是(D)
A周期表是按相对原子质量逐渐增大的顺序从左到右排列的(原子序数)
B最外层电子数相同的元素都是同一族(稀有气体)
C同族元素的最外层电子数一定相同(稀有气体)
D同周期元素的电子层数相同
解题技巧和方法:熟记本节板书内容
考点2
判断元素在周期表中的位置★
1、根据原子结构示意图判断
第三周期第IIIA族
第三周期第VIA族
第三周期第IVA族
第五周期第VIIA族
解题技巧和方法:周期数=电子层数;主族数=最外层电子数
2、根据原子序数判断
Mg
C
H
Ne
Cl
第三周期第IIA族
第二周期第IVA族
第一周期第IA族
第二周期0族
第三周期第VIIA族
56
35
53
82
第六周期第IIA族
第四周期第VIIA族
第五周期第VIIA族
第六周期第IVA族
解题技巧和方法:每一周期的元素数量2
8
8
18
18
32
26
考点3
判断元素是否同周期、是否同主族★★
1、下列各组元素中,属于同一周期的是(B)
A碳、氧、硫
B硅、磷、氯
C锂、钠、钾
D氟、氯、溴
2、下列各组元素中,属于同一主族的是(A)
A氯、溴、碘
B氮、氧、氟
C碳、氧、硅
D钾、钙、钠
解题技巧和方法:熟记碱金属元素、卤族元素和前三周期元素
设计意图:通过练习巩固对周期表的认识。
【小结】元素周期表是按元素的原子序数的大小,电子层数相同的在同一周期,最外层电子数相同的在同一族,整个周期表共7个周期,16个族。
【检测】背诵1-20号元素及碱金属、卤族元素的名称和符号,并以周期表的形式默写。
【作业】设计一张元素周期表(或仿照示例绘制一幅元素周期表)
五、板书设计
第一章
物质结构
元素周期律
第一节
元素周期表
一、元素周期表
1、元素周期表的结构
短周期(1-3周期)
行→周期
三短四长未填全
7
七
长周期(4-7周期)
主族(七个)
列
→
族
副族(七个)
七主七副零Ⅷ族
18
十六
0族
第Ⅷ族
2、元素周期表中的编排原则
(1)元素按原子序数递增顺序排列
原子序数=质子数=核电荷数=核外电子数
(2)电子层数相同位于同周期
(3)最外层电子数相同位于同主族
六、学案设计
第一章第一节
元素周期表1-1
一、学习提纲
(一)仔细观察元素周期表后,结合初中你所学的有关知识,回答下列问题,:
1、元素周期表中共有多少行?多少列?
2、周期表中一个横行叫做什么?每一行各有多少种元素?
3、周期表中一个纵行叫做什么?每个纵行的名称分别是什么?用什么符号表示的?
4、是否还有未发现的元素没有填入元素周期表?如何知道的
5、元素周期表的每一个方格内都告诉了我们哪些有关元素的信息?
6、元素周期表中共有几种底色?分别代表什么?分布有什么特点?
7、周期表中有些元素用红框圈了起来,这些元素是哪类元素?
【课堂记录】
(二)元素周期表是根据什么编排的呢?请仔细观察1-18号元素的原子结构示意图,回答下列问题:
1、元素周期表中的元素是按照什么顺序排列的?这与门捷列夫的元素周期表是否相同?
2、原子序数是如何确定的?它和原子结构有何关系?
3、什么样的元素位于同一周期?
4、什么样的元素位于周一主族?
【课堂记录】
二、课堂练习
考点1
元素周期表的结构和编排原则★
1、下列关于元素周期表的叙述中不正确的是(
)
A同周期元素的电子层数相同
B元素周期表共有7个周期,16个族
C过渡元素都是金属元素,金属元素都是过渡元素
D主族元素原子的最外层电子数与族序数相同2、下列说法中正确的是(
)
A周期表是按相对原子质量逐渐增大的顺序从左到右排列的
B最外层电子数相同的元素都是同一族
C同族元素的最外层电子数一定相同
D同周期元素的电子层数相同解题技巧和方法:丰练中相应习题:
考点2判断元素在周期表中的位置★
1、根据原子结构示意图判断
解题技巧和方法:丰练中相应习题:
2、根据原子序数判断
Mg
C
H
Ne
Cl56
35
53
82解题技巧和方法:丰练中相应习题:
考点3
判断元素是否同周期、是否同主族★★
1、下列各组元素中,属于同一周期的是(
)
A碳、氧、硫
B硅、磷、氯
C锂、钠、钾
D氟、氯、溴2、下列各组元素中,属于同一主族的是(
)
A氯、溴、碘
B氮、氧、氟
C碳、氧、硅
D钾、钙、钠解题技巧和方法:丰练中相应习题:
七、下堂课前检测
(
)1、下列各组元素中,属于同一主族的是
A
碳、氧、硫
B
硅、磷、氯
C
锂、钠、钾
D
氟、氯、氮
(
)2、下列各组元素中,属于同一周期的是
A
氯、溴、碘
B
氮、氧、氟
C
碳、氧、硅
D
钾、钙、钠
(
)3、Si在元素周期表的位置
A第二周期第VIA族
B第三周期第VIA族
C第二周期第IVA族
D第三周期第IVA族
(
)4、55号元素位于元素周期表的位置是
A第五周期第IA族
B第五周期第VIIA族
C第六周期第IA族
D第六周期第VIIA族
(
)5、下列关于元素周期表的叙述中不正确的是
A同周期元素的电子层数相同
B元素周期表共有7个周期,16个族
C过渡元素都是金属元素,金属元素都是过渡元素
D主族元素原子的最外层电子数与族序数相同
(
)6、下列关于2mol二氧化碳的叙述,正确的是
A
质量是44g
B
体积是44.8L
C
分子数目是2NA
D
原子总数是2NA
(
)7、下列物质中既能和盐酸反应,又能和NaOH溶液反应的
A
Fe2O3
B
Al2O3
C
Na2O
D
SO2
(
)8、下列物质是电解质的是
A.Fe
B.SO2
C.NaCl
D.蔗糖
八、课后记
本节课引用的资料丰富,学生对此兴趣很浓,这使学生在课堂上自始至终都保持了较高的热情,这在教学中是非常重要的。此外学生通过学习提纲中提出的问题,自己对图表和数据进行分析得出答案,让学生体会自主解决问题的快乐。在知识的落实上,改变学生对元素的整体认识,以周期表的方式记忆元素,为后续学习打下基础。
资料一:门捷列夫发现周期表的故事
1834年2月7日,伊万诺维奇·门捷列夫诞生于西伯利亚的托波尔斯克,父亲是中学校长。16岁时,进入圣彼得堡师范学院自然科学教育系学习。毕业后,门捷列夫去德国深造,集中精力研究物理化学。1861年回国,任圣彼得堡大学教授。当门捷列夫编写有关化学元素及其化合物性质的章节时,他遇到了难题。按照什么次序排列它们的位置呢?当时化学界发现的化学元索已达63种。为了寻找元素的科学分类方法,他不得不研究有关元素之间的内在联系。
研究某一学科的历史,是把握该学科发展进程的最好方法。门捷列夫深刻地了解这一点,他迈进了圣彼得堡大学的图书馆,在数不尽的卷帙中逐一整理以往人们研究化学元素分类的原始资料……
门捷列夫抓住了化学家研究元素分类的历史脉络,夜以继日地分析思考,简直着了迷。夜深人静,圣彼得堡大学主楼左侧的的门捷列夫的居室仍然亮着灯光,仆人为了安全起见,推开了门捷列夫书房的门。
门捷列大不知疲倦地工作着。他在每一张卡片上都写上了元素名称、原于量、化合物的化学式和主要性质。筐里逐渐装满了卡片。门捷列夫把它们分成几类,然后摆放在一个宽大的实验台上。
接下来的日子,门捷列夫把元素卡片进行系统地整理。门捷列夫的家人看到一向珍惜时间的教授突然热衷于“纸牌”感到奇怪。门捷列夫旁若无人,每天手拿元素卡片像玩纸牌那样,收起、摆开,再收起、再摆开,皱着眉头地玩“牌”……
冬去春来。门捷列夫没有在杂乱无章的元素卡片中找到内在的规律。有一大,他又坐到桌前摆弄起“纸牌”来了,摆着,摆着,门捷列夫像触电似的站了起来,在他面前出现了完全没有料到的现象,每一行元素的性质都是按照原子量的增大而从上到下地逐渐变化着。
门捷列夫激动得双手不断颤抖着。“这就是说,元素的性质与它们的原子量呈周期性有关系。”门捷列夫兴奋地在室内踱着步子,然后,迅速地抓起记事簿在上面写道:“根据元素原子量及其化学性质的近似性试排元素表。”
门捷列夫将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表,揭示了化学元素间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。
资料二:元素周期表发展史
18世纪中叶至19世纪中叶的一百年间,一系列的新元素接连不断地被发现。关于这些元素的理化性质,也积累得相当丰富。但一个更大的黑洞吸引着科学家们前行,元素间的内在联系又是怎样的呢?
让我们记住这一个个令人起敬的名字和他们的发现。
1789年著名的法国化学家拉瓦锡就提出了“四类元素分类法”:气体元素、金属元素、非金属元素、能成盐的土质元素。
1829年法国化学家德贝莱纳提出了“三素组”学说。但在当时已知的54种元素中他却只能把15种元素归入“三素组”,尚不能揭示出其他大部分元素间的关系。1、锂钠钾;2、硫硒碲;3、氯溴碘;4、钙锶钡;5、锰铬铁。
1864年德国人迈耶尔发表了“六元素表”。但同样的“六元素表”包括的元素并不多,还不及当时知道元素的一半。
1865年英国人纽兰兹又发表了关于元素性质的“八音律”。但他的元素表在很多地方是混乱的。
1869年俄国化学家门捷列夫研制出了元素周期表。
物质结构
元素周期律
第一节
元素周期表
一、学习目标分析
(一)学习目标确定的依据
《课程标准》
《模块学习要求》
能描述元素周期表的结构。
知道周期与族的概念,能描述元素周期表的结构。认识元素在周期表中的位置与其原子的电子层结构的关系。
(二)学习目标
知识与技能目标
(1)能描述元素周期表的结构
(2)知道常见金属、非金属在元素周期表中的位置
(3)初步了解原子结构与元素在周期表位置的关系
过程与方法目标
(1)引导学生自主学习:认识周期表的结构。
(2)培养学生通过分析和处理数据得出结论,形成概念,发现规律的思维方法。
3、情感态度与价值观目标
(1)通过化学史学习,培养勇于创新、不断探索的科学品质。
(2)通过各种元素周期表的图片,让学生认识到物质分类的多样性
二、教学重点难点分析
1、教学重点:元素周期表的结构。
2、教学难点:元素在元素周期表中的位置与原子结构之间的关系。
三、本课时内容在教材中的地位
《元素周期表》是人教版教材高一化学必修2第一章第一节内容。
本章以元素周期表和元素周期律为框架,先介绍元素周期表,再通过一些事实和实验归纳元素周期律。
本节从化学史引入,直接呈现元素周期表的结构。在学生了解一些元素性质和原子结构示意图的基础上,以周期表的纵向结构为线索,以碱金属和卤族元素为代表,通过比较原子结构(电子层数,最外层电子数)的异同,并通过实验和事实来呈现同主族元素性质的相似性和递变性。帮助学生认识元素性质与原子核外电子的关系。在此基础上,提出元素性质与原子核的关系,并由此引出核素和同位素的有关知识。
根据本教材的结构和内容分析,根据《新课标》,本节内容要求达到“能结合有关数据和实验事实认识元素周期律,了解原子结构与元素性质的关系;能描述元素周期表的结构,知道金属、非金属在元素周期表中的位置及其性质的递变规律”。
四、教学设计
【新课引入】这里有一份手稿,你知道它是什么吗?
【展示】门捷列夫最初绘制的元素周期表
【提问】你能看出门捷列夫的元素周期表是按照什么顺序排列的吗?
【回答】按照相对原子质量排列,且元素性质相似的元素在同一行。
【过渡】门捷列夫研制元素周期表的过程并不是一帆风顺的,是经历了很多波折的,下面我们就来看一看门捷列夫的故事。
【演示】门捷列夫发现周期表的故事(资料一)
【板书】第一节
元素周期表
一、元素周期表
【设问】那么我们现在所用的周期表和门捷列夫的周期表有何不同呢?
设计意图:通过看门捷列夫所绘制的周期表的原稿,让学生从中发现早期周期表的编排方法,激发学生学习元素周期表的兴趣,并对后面现代周期表编排原则的学习有一个对比,体会科学的进步。此外通过元素周期表发现的过程,让学生从门捷列夫研究发现周期表的故事中体会科学家孜孜以求的品质。
【过渡】目前我们最常使用的元素周期表是什么样的?在化学书的什么地方能找到元素周期表?
【活动】仔细观察元素周期表后,结合初中你所学的有关知识,回答下列问题:
1、元素周期表中共有多少行?多少列?
2、周期表中一个横行叫做什么?每一行各有多少种元素?
3、周期表中一个纵行叫做什么?每个纵行的名称分别是什么?用什么符号表示的?
4、是否还有未发现的元素没有填入元素周期表?如何知道的
5、元素周期表的每一个方格内都告诉了我们哪些有关元素的信息?
6、元素周期表中共有几种底色?分别代表什么?分布有什么特点?
7、周期表中有些元素用红框圈了起来,这些元素是哪类元素?
【回答】学生回答,教师补充。
1、元素周期表中共有7行18列。
2、周期表中一个横行叫做周期。(强调每个周期的元素种类,为后面根据原子序数推断元素位置做准备)
第一周期
第二周期
第三周期
第四周期
第五周期
第六周期
第七周期
2
8
8
18
18
32
26
第六周期和第七周期第ⅢB族的位置并不是一种元素,而是有15种元素,名称为镧系和锕系。因此元素周期表若全部展开,应是如下图形。
3、周期表中一个纵行叫做族。(注意强调族的写法)
第1列
第2列
第3列
第4列
第5列
第6列
第7列
第8列
第9列
第10列
第11列
第12列
第13列
第14列
第15列
第16列
第17列
第18列
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
4、仍有元素没有被写入元素周期表,因此周期表最后用的是省略号。
5、周期表中的每一个方格告诉了我们5点信息,分别是原子序数、元素名称、元素符号、电子层排布和相对原子质量。(强调元素相对原子质量和原子序数的关系)
6、元素周期表中共有2种底色,分别是深绿色和浅绿色。其中深绿色的是非金属元素,浅绿色的是金属元素。从颜色上看,非金属元素中除了H元素外,其他都排布在周期表中偏右偏上的位置。
7、周期表中用红框圈起来的元素是过渡金属元素。(强调:金属元素不都是过渡金属元素,但过渡金属元素全都是金属元素)
设计意图:问题的设置是对元素周期表的充分认识,要让学生能够掌握对图表的整体阅读和具体阅读,提高学生分析的能力。
【讲解】周期表中前三个周期没有过渡金属元素,因此叫做短周期;周期表中后四个周期既有主族元素又有过渡元素,因此叫做长周期。周期表中共有16个族,其中七个主族,七个副族,一个0族,一个第Ⅷ族。
【板书】1、元素周期表的结构
短周期(1-3周期)
行→周期
三短四长未填全
7
七
长周期(4-7周期)
主族(七个)
列
→
族
副族(七个)
七主七副零Ⅷ族
18
十六
0族
第Ⅷ族
【过渡】周期表是如何排列的呢?其编排方法又经历了哪些变化呢?
【演示】元素周期表发展史(资料二)
【活动】我们现在使用的元素周期表是根据什么编排的呢?请阅读P4第一至第五段,回答下列问题:
1、元素周期表中的元素是按照什么顺序排列的?这与门捷列夫的元素周期表是否相同?
2、原子序数是如何确定的?它和原子结构有何关系?
3、什么样的元素位于同一周期?
4、什么样的元素位于周一主族?
【回答】边回答边记录板书
1、元素周期表中的元素是按照原子叙述排列的。而门捷列夫的元素周期表是按照相对原子质量排列的。
2、按照元素在周期表中的顺序给元素编号,得到原子序数。原子序数=质子数=核电荷数=核外电子数
3、电子层数相同的元素位于同一周期。
4、最外层电子数相同的元素位于同一主族。
【板书】2、元素周期表中的编排原则
(1)元素按原子叙述递增顺序排列
原子序数=质子数=核电荷数=核外电子数
(2)电子层数相同位于同周期
(3)最外层电子数相同位于同主族
设计意图:通过对数据的分析,找到元素周期表的编排原则,这有利于学生理解元素周期表的结构,并且对后面元素性质与原子结构关系的学习打下基础。【过渡】按照这样的编排原则,可以做出各种各样的元素周期表。
【展示】1、元素单质实物型元素周期表
2、元素性质图示型元素周期表
3、幽默对话式元素周期表
【展示】各种形状的元素周期表
【展示】学生作品展示
设计意图:体会元素周期表的多样性,并激发学生绘制周期表的兴趣。并能进一步从中体会周期表的编排原则。
【课堂练习】根据考点完成下列练习
考点1
元素周期表的结构和编排原则★
1、下列关于元素周期表的叙述中不正确的是(C)
A同周期元素的电子层数相同
B元素周期表共有7个周期,16个族
C过渡元素都是金属元素,金属元素都是过渡元素
D主族元素原子的最外层电子数与族序数相同
2、下列说法中正确的是(D)
A周期表是按相对原子质量逐渐增大的顺序从左到右排列的(原子序数)
B最外层电子数相同的元素都是同一族(稀有气体)
C同族元素的最外层电子数一定相同(稀有气体)
D同周期元素的电子层数相同
解题技巧和方法:熟记本节板书内容
考点2
判断元素在周期表中的位置★
1、根据原子结构示意图判断
第三周期第IIIA族
第三周期第VIA族
第三周期第IVA族
第五周期第VIIA族
解题技巧和方法:周期数=电子层数;主族数=最外层电子数
2、根据原子序数判断
Mg
C
H
Ne
Cl
第三周期第IIA族
第二周期第IVA族
第一周期第IA族
第二周期0族
第三周期第VIIA族
56
35
53
82
第六周期第IIA族
第四周期第VIIA族
第五周期第VIIA族
第六周期第IVA族
解题技巧和方法:每一周期的元素数量2
8
8
18
18
32
26
考点3
判断元素是否同周期、是否同主族★★
1、下列各组元素中,属于同一周期的是(B)
A碳、氧、硫
B硅、磷、氯
C锂、钠、钾
D氟、氯、溴
2、下列各组元素中,属于同一主族的是(A)
A氯、溴、碘
B氮、氧、氟
C碳、氧、硅
D钾、钙、钠
解题技巧和方法:熟记碱金属元素、卤族元素和前三周期元素
设计意图:通过练习巩固对周期表的认识。
【小结】元素周期表是按元素的原子序数的大小,电子层数相同的在同一周期,最外层电子数相同的在同一族,整个周期表共7个周期,16个族。
【检测】背诵1-20号元素及碱金属、卤族元素的名称和符号,并以周期表的形式默写。
【作业】设计一张元素周期表(或仿照示例绘制一幅元素周期表)
五、板书设计
第一章
物质结构
元素周期律
第一节
元素周期表
一、元素周期表
1、元素周期表的结构
短周期(1-3周期)
行→周期
三短四长未填全
7
七
长周期(4-7周期)
主族(七个)
列
→
族
副族(七个)
七主七副零Ⅷ族
18
十六
0族
第Ⅷ族
2、元素周期表中的编排原则
(1)元素按原子序数递增顺序排列
原子序数=质子数=核电荷数=核外电子数
(2)电子层数相同位于同周期
(3)最外层电子数相同位于同主族
六、学案设计
第一章第一节
元素周期表1-1
一、学习提纲
(一)仔细观察元素周期表后,结合初中你所学的有关知识,回答下列问题,:
1、元素周期表中共有多少行?多少列?
2、周期表中一个横行叫做什么?每一行各有多少种元素?
3、周期表中一个纵行叫做什么?每个纵行的名称分别是什么?用什么符号表示的?
4、是否还有未发现的元素没有填入元素周期表?如何知道的
5、元素周期表的每一个方格内都告诉了我们哪些有关元素的信息?
6、元素周期表中共有几种底色?分别代表什么?分布有什么特点?
7、周期表中有些元素用红框圈了起来,这些元素是哪类元素?
【课堂记录】
(二)元素周期表是根据什么编排的呢?请仔细观察1-18号元素的原子结构示意图,回答下列问题:
1、元素周期表中的元素是按照什么顺序排列的?这与门捷列夫的元素周期表是否相同?
2、原子序数是如何确定的?它和原子结构有何关系?
3、什么样的元素位于同一周期?
4、什么样的元素位于周一主族?
【课堂记录】
二、课堂练习
考点1
元素周期表的结构和编排原则★
1、下列关于元素周期表的叙述中不正确的是(
)
A同周期元素的电子层数相同
B元素周期表共有7个周期,16个族
C过渡元素都是金属元素,金属元素都是过渡元素
D主族元素原子的最外层电子数与族序数相同2、下列说法中正确的是(
)
A周期表是按相对原子质量逐渐增大的顺序从左到右排列的
B最外层电子数相同的元素都是同一族
C同族元素的最外层电子数一定相同
D同周期元素的电子层数相同解题技巧和方法:丰练中相应习题:
考点2判断元素在周期表中的位置★
1、根据原子结构示意图判断
解题技巧和方法:丰练中相应习题:
2、根据原子序数判断
Mg
C
H
Ne
Cl56
35
53
82解题技巧和方法:丰练中相应习题:
考点3
判断元素是否同周期、是否同主族★★
1、下列各组元素中,属于同一周期的是(
)
A碳、氧、硫
B硅、磷、氯
C锂、钠、钾
D氟、氯、溴2、下列各组元素中,属于同一主族的是(
)
A氯、溴、碘
B氮、氧、氟
C碳、氧、硅
D钾、钙、钠解题技巧和方法:丰练中相应习题:
七、下堂课前检测
(
)1、下列各组元素中,属于同一主族的是
A
碳、氧、硫
B
硅、磷、氯
C
锂、钠、钾
D
氟、氯、氮
(
)2、下列各组元素中,属于同一周期的是
A
氯、溴、碘
B
氮、氧、氟
C
碳、氧、硅
D
钾、钙、钠
(
)3、Si在元素周期表的位置
A第二周期第VIA族
B第三周期第VIA族
C第二周期第IVA族
D第三周期第IVA族
(
)4、55号元素位于元素周期表的位置是
A第五周期第IA族
B第五周期第VIIA族
C第六周期第IA族
D第六周期第VIIA族
(
)5、下列关于元素周期表的叙述中不正确的是
A同周期元素的电子层数相同
B元素周期表共有7个周期,16个族
C过渡元素都是金属元素,金属元素都是过渡元素
D主族元素原子的最外层电子数与族序数相同
(
)6、下列关于2mol二氧化碳的叙述,正确的是
A
质量是44g
B
体积是44.8L
C
分子数目是2NA
D
原子总数是2NA
(
)7、下列物质中既能和盐酸反应,又能和NaOH溶液反应的
A
Fe2O3
B
Al2O3
C
Na2O
D
SO2
(
)8、下列物质是电解质的是
A.Fe
B.SO2
C.NaCl
D.蔗糖
八、课后记
本节课引用的资料丰富,学生对此兴趣很浓,这使学生在课堂上自始至终都保持了较高的热情,这在教学中是非常重要的。此外学生通过学习提纲中提出的问题,自己对图表和数据进行分析得出答案,让学生体会自主解决问题的快乐。在知识的落实上,改变学生对元素的整体认识,以周期表的方式记忆元素,为后续学习打下基础。
资料一:门捷列夫发现周期表的故事
1834年2月7日,伊万诺维奇·门捷列夫诞生于西伯利亚的托波尔斯克,父亲是中学校长。16岁时,进入圣彼得堡师范学院自然科学教育系学习。毕业后,门捷列夫去德国深造,集中精力研究物理化学。1861年回国,任圣彼得堡大学教授。当门捷列夫编写有关化学元素及其化合物性质的章节时,他遇到了难题。按照什么次序排列它们的位置呢?当时化学界发现的化学元索已达63种。为了寻找元素的科学分类方法,他不得不研究有关元素之间的内在联系。
研究某一学科的历史,是把握该学科发展进程的最好方法。门捷列夫深刻地了解这一点,他迈进了圣彼得堡大学的图书馆,在数不尽的卷帙中逐一整理以往人们研究化学元素分类的原始资料……
门捷列夫抓住了化学家研究元素分类的历史脉络,夜以继日地分析思考,简直着了迷。夜深人静,圣彼得堡大学主楼左侧的的门捷列夫的居室仍然亮着灯光,仆人为了安全起见,推开了门捷列夫书房的门。
门捷列大不知疲倦地工作着。他在每一张卡片上都写上了元素名称、原于量、化合物的化学式和主要性质。筐里逐渐装满了卡片。门捷列夫把它们分成几类,然后摆放在一个宽大的实验台上。
接下来的日子,门捷列夫把元素卡片进行系统地整理。门捷列夫的家人看到一向珍惜时间的教授突然热衷于“纸牌”感到奇怪。门捷列夫旁若无人,每天手拿元素卡片像玩纸牌那样,收起、摆开,再收起、再摆开,皱着眉头地玩“牌”……
冬去春来。门捷列夫没有在杂乱无章的元素卡片中找到内在的规律。有一大,他又坐到桌前摆弄起“纸牌”来了,摆着,摆着,门捷列夫像触电似的站了起来,在他面前出现了完全没有料到的现象,每一行元素的性质都是按照原子量的增大而从上到下地逐渐变化着。
门捷列夫激动得双手不断颤抖着。“这就是说,元素的性质与它们的原子量呈周期性有关系。”门捷列夫兴奋地在室内踱着步子,然后,迅速地抓起记事簿在上面写道:“根据元素原子量及其化学性质的近似性试排元素表。”
门捷列夫将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表,揭示了化学元素间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。
资料二:元素周期表发展史
18世纪中叶至19世纪中叶的一百年间,一系列的新元素接连不断地被发现。关于这些元素的理化性质,也积累得相当丰富。但一个更大的黑洞吸引着科学家们前行,元素间的内在联系又是怎样的呢?
让我们记住这一个个令人起敬的名字和他们的发现。
1789年著名的法国化学家拉瓦锡就提出了“四类元素分类法”:气体元素、金属元素、非金属元素、能成盐的土质元素。
1829年法国化学家德贝莱纳提出了“三素组”学说。但在当时已知的54种元素中他却只能把15种元素归入“三素组”,尚不能揭示出其他大部分元素间的关系。1、锂钠钾;2、硫硒碲;3、氯溴碘;4、钙锶钡;5、锰铬铁。
1864年德国人迈耶尔发表了“六元素表”。但同样的“六元素表”包括的元素并不多,还不及当时知道元素的一半。
1865年英国人纽兰兹又发表了关于元素性质的“八音律”。但他的元素表在很多地方是混乱的。
1869年俄国化学家门捷列夫研制出了元素周期表。
