选修3 3.3 原子晶体与分子晶体 课件 (2)
文档属性
| 名称 | 选修3 3.3 原子晶体与分子晶体 课件 (2) |  | |
| 格式 | zip | ||
| 文件大小 | 657.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-09 22:44:24 | ||
图片预览



文档简介
课件24张PPT。第3节 原子晶体与分子晶体1.概念:
相邻原子间以共价键相结合而形成的具有空间立体网状结构的晶体.
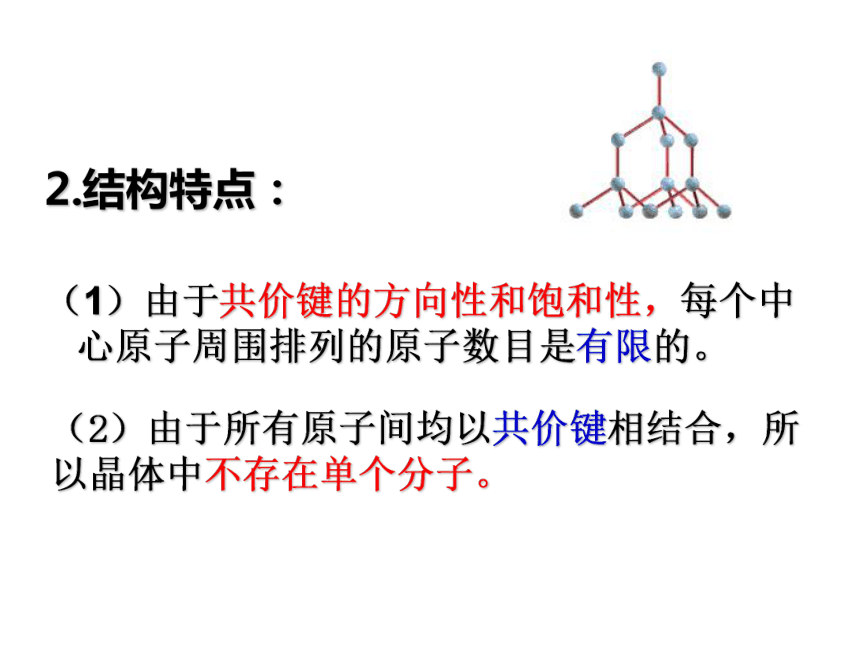
一.原子晶体金刚石2.结构特点:
(1)由于共价键的方向性和饱和性,每个中心原子周围排列的原子数目是有限的。(2)由于所有原子间均以共价键相结合,所以晶体中不存在单个分子。
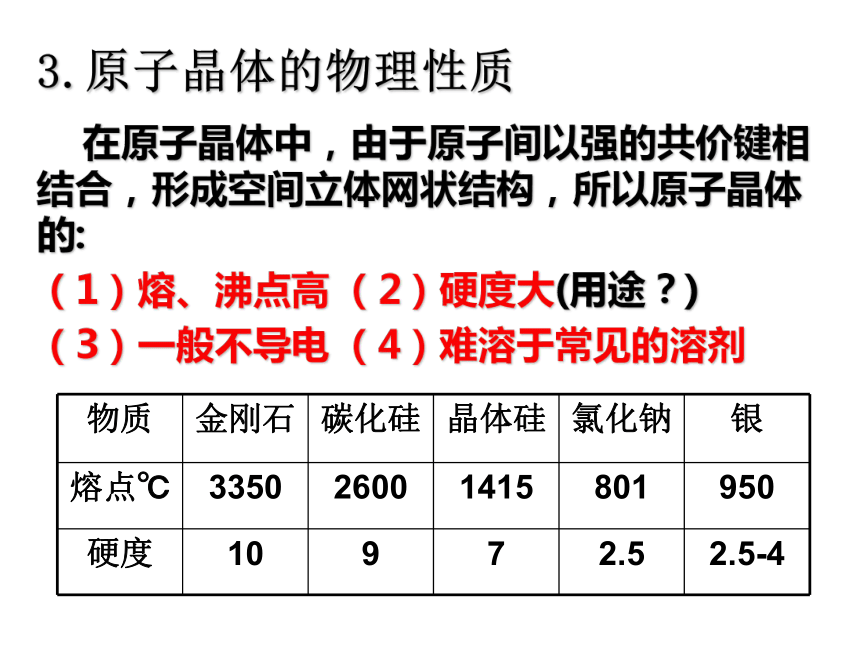
在原子晶体中,由于原子间以强的共价键相结合,形成空间立体网状结构,所以原子晶体的:
(1)熔、沸点高 (2)硬度大(用途?)
(3)一般不导电 (4)难溶于常见的溶剂 3.原子晶体的物理性质4.常见的原子晶体
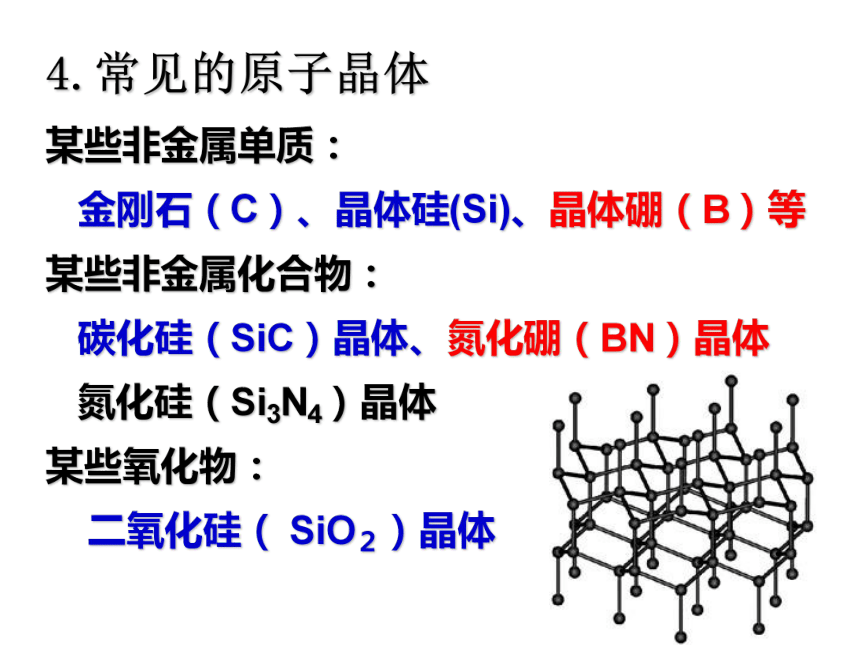
某些非金属单质:
金刚石(C)、晶体硅(Si)、晶体硼(B)等
某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
氮化硅(Si3N4)晶体
某些氧化物:
二氧化硅( SiO2)晶体(1)金刚石
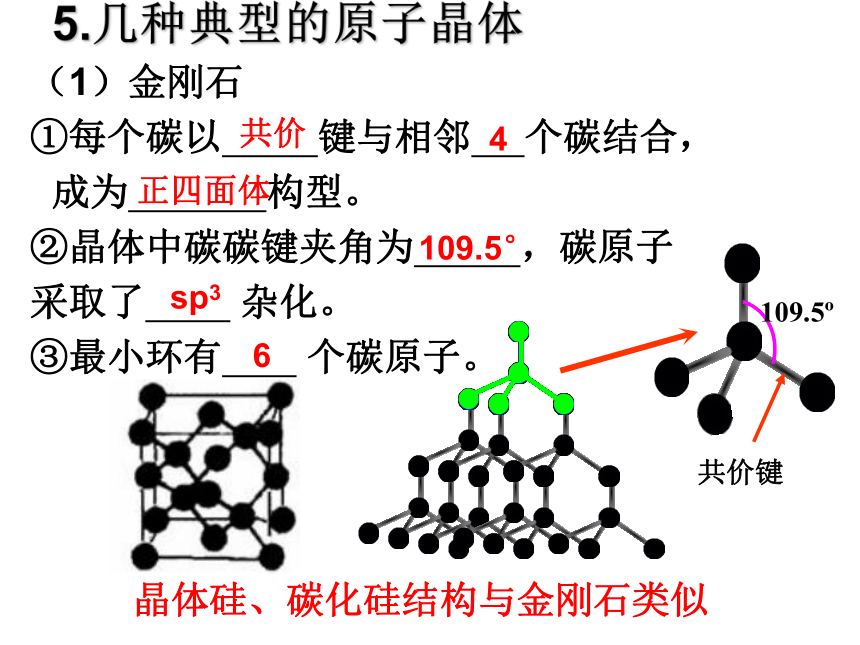
①每个碳以 键与相邻 个碳结合,
成为 构型。
②晶体中碳碳键夹角为 ,碳原子
采取了 杂化。
③最小环有 个碳原子。 5.几种典型的原子晶体 109.5o共价键共价6sp3109.5°正四面体4晶体硅、碳化硅结构与金刚石类似(2)二氧化硅
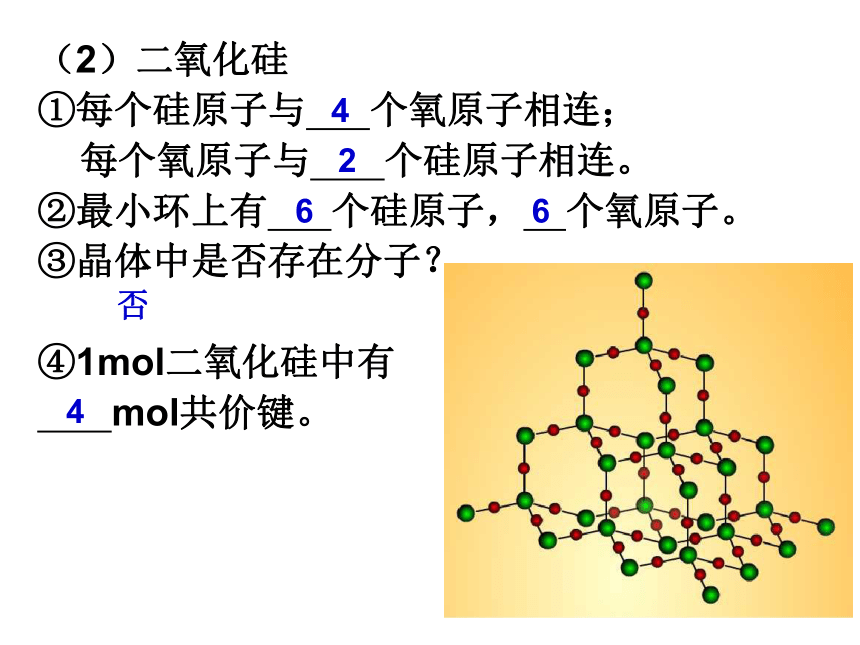
①每个硅原子与 个氧原子相连;
每个氧原子与 个硅原子相连。
②最小环上有 个硅原子, 个氧原子。
③晶体中是否存在分子?
④1mol二氧化硅中有
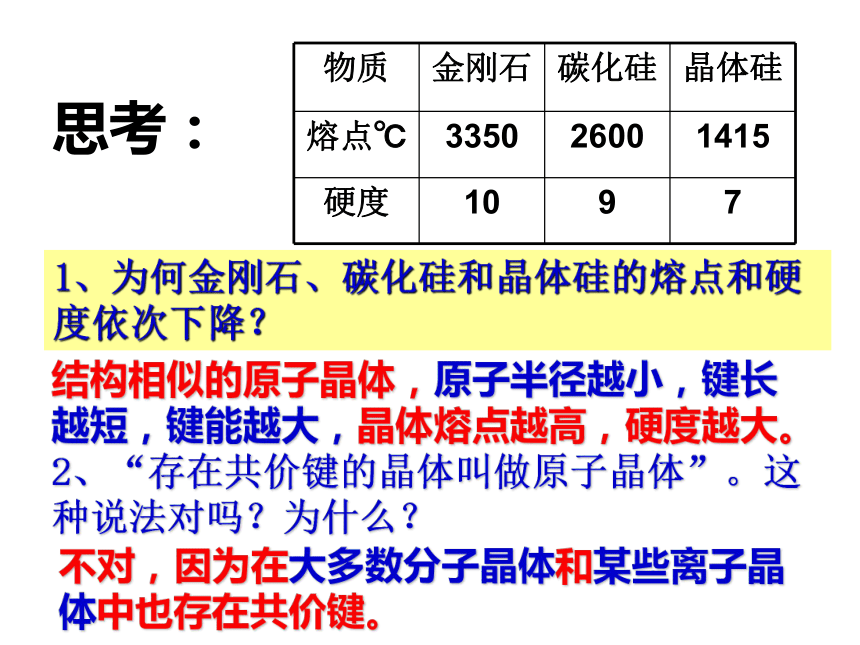
mol共价键。2446否6结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高,硬度越大。1、为何金刚石、碳化硅和晶体硅的熔点和硬度依次下降?2、“存在共价键的晶体叫做原子晶体”。这种说法对吗?为什么?思考:不对,因为在大多数分子晶体和某些离子晶体中也存在共价键。二、分子晶体 1、概念
分子间通过分子间作用力结合而形成的晶体。
2、结构特点
一般来说,由于分子间作用力不具有方向性和饱和性,故分子晶体在堆积排列时尽可能利用空间,采取紧密堆积的方式。C60晶胞 由于分子间作用力很弱,所以分子晶体一般具有:① 较低的熔点、沸点 ② 较小的硬度
③ 一般都是绝缘体,熔融状态不导电。3.分子晶体的物理性质(1)所有非金属氢化物: H2O, H2S, NH3, CH4, HX
(2) 部分非金属单质: X2, N2, O2, H2, S8, P4, C60
(3) 部分非金属氧化物: CO2, SO2, N2O4, P4O10
(4) 几乎所有的酸: H2SO4, HNO3, H3PO4
(5) 大多数有机物: 乙醇,冰醋酸,蔗糖4.常见的分子晶体5.典型的分子晶体
(1)单质碘
晶胞为长方体,每个顶点
和面心各有一个分子。
①平均每个晶胞中有 个
碘分子,
②微粒间的作用力是 。
4范德华力(2)干冰
晶胞为正方体,每个顶点
和面心各有一个分子。
①平均每个晶胞中有 个
CO2分子,
②微粒间的作用力是 ,
③配位数为 。
4范德华力范德华力共价键12(3)冰
冰晶体主要是水分子依靠氢键形成的(亦有范德华力)。由于氢键的方向性和饱和性,分子间距比较大,有很多空隙,结构比较松散。每个水分子周周有4个水分子,故配位数为4。
氢键具有方向性和饱和性(4)其他分子晶体①硫黄:硫的同素异形体最稳定的是S8,不溶于水,微溶于酒精和乙醚,易溶于CS2。
试管壁上的硫如何洗涤?②磷:白磷白色蜡状固体,剧毒,着火点很低;
红磷红色粉末固体,无毒,着火点较高。白磷为何不能制造安全火柴?三、石墨范德华力,层间距0.335nm石墨中C-C键角为120。, C-C键长为0.142nm
1.结构特点:①石墨晶体是层状结构,每一层碳原子排列成六边形,则碳原子采用 杂化。未成对电子形成 键。
②石墨晶体中C原子数与C-C键数之比是 。其中每个正六边形占有的 C原子数平均为 个。
22︰3大πsp22.晶体类型:
每一层上以共价键结合,层与层之间为范德华力,未成对电子能在整个平面上运动,具有金属键的性质。
这种晶体称为混合键型晶体(过渡型晶体)3.性质:
熔点高(σ键和大π键共同作用,键能大)
质软(层间范德华力作用弱)
易导电(大π键有金属键的性质)4.用途:制造电极,润滑剂,铅笔芯,中子减速剂等四种晶体的比较:阴、阳离子原子分子金属原子离子键共价键分子间作用力金属键一般较高,少部分低较高很高较低较大很大一般较小一般较大,少部分小一般易溶水难溶相似相溶难溶,钠等除外晶体不导电,溶于水能电离其水溶液可导电,熔化不导电晶体不导电, 溶于水或熔化导电有的能导电,如硅晶体导电,熔化导电四、物质熔沸点高低比较规律:(金榜P47)(1)不同晶体类型的物质的熔沸点高低顺序一般是:(2)原子晶体要比较共价键的强弱(3)离子晶体要比较离子键的强弱 原子晶体>离子晶体>分子晶体同一晶体类型的物质,则晶体内部粒子间的作用越强,熔、沸点越高。一般地说,原子半径越小,形成的共价键的键长越短,键能越大,其晶体熔、沸点越高。如:金刚石>碳化硅>晶体硅一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔、沸点就越高。如:NaCl>KCl>RbCl>CsCl(4)分子晶体:(5)金属晶体:结构和组成相似的物质,相对分子质量越大,熔、沸 点越高(注意氢键影响),如:HF>HI>HBr>HCl在同分异构体中,一般地说,支链越多(越对称), 熔、沸点越低, 如:正戊烷>异戊烷>新戊烷在同分异构体的芳香烃及其衍生物中,其熔、沸点高 低顺序一般是:邻>间>对位化合物金属晶体中金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点越高。 Al>Mg>Na Li>Na>K>Rb>Cs 合金<各成分 相对分子量接近的物质,极性越强,熔、沸点越高, 如:CO>N2练习:
1.下列晶体中不属于原子晶体的是 ( ) A.干冰 B.金刚砂 C.金刚石 D.水晶
2、下列叙述正确的是 ( )
A.离子晶体都是化合物
B.原子晶体都是单质
C.分子晶体内部都存在共价键
D.金属单质形成的晶体都是金属晶体AAD 3.在金刚石的网状结构中,含有共价键形成的碳原子 环,其中最小的环上,碳原子数是 ( ) A.2个 B.3个 C.4个 D.6个 4,下列各物质中,按熔点由低到高排列正确的是( ) A.O2、I2、Hg B.CO2、KCl、SiO2 C.Na、K、Rb D.SiC、NaCl、SiO2 DB 5.在x mol石英晶体中,含有Si-O键数是 ( ) A.x mol B.2x moI
C.3 x mol D.4x mol 6.固体熔化时,必须破坏非极性共价键的是 ( ) A.冰 B.晶体硅
C.溴 D.二氧化硅 DB
7. 共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )
A. 干冰 B. 氯化钠
C. 氢氧化钠 D. 碘B
相邻原子间以共价键相结合而形成的具有空间立体网状结构的晶体.
一.原子晶体金刚石2.结构特点:
(1)由于共价键的方向性和饱和性,每个中心原子周围排列的原子数目是有限的。(2)由于所有原子间均以共价键相结合,所以晶体中不存在单个分子。
在原子晶体中,由于原子间以强的共价键相结合,形成空间立体网状结构,所以原子晶体的:
(1)熔、沸点高 (2)硬度大(用途?)
(3)一般不导电 (4)难溶于常见的溶剂 3.原子晶体的物理性质4.常见的原子晶体
某些非金属单质:
金刚石(C)、晶体硅(Si)、晶体硼(B)等
某些非金属化合物:
碳化硅(SiC)晶体、氮化硼(BN)晶体
氮化硅(Si3N4)晶体
某些氧化物:
二氧化硅( SiO2)晶体(1)金刚石
①每个碳以 键与相邻 个碳结合,
成为 构型。
②晶体中碳碳键夹角为 ,碳原子
采取了 杂化。
③最小环有 个碳原子。 5.几种典型的原子晶体 109.5o共价键共价6sp3109.5°正四面体4晶体硅、碳化硅结构与金刚石类似(2)二氧化硅
①每个硅原子与 个氧原子相连;
每个氧原子与 个硅原子相连。
②最小环上有 个硅原子, 个氧原子。
③晶体中是否存在分子?
④1mol二氧化硅中有
mol共价键。2446否6结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高,硬度越大。1、为何金刚石、碳化硅和晶体硅的熔点和硬度依次下降?2、“存在共价键的晶体叫做原子晶体”。这种说法对吗?为什么?思考:不对,因为在大多数分子晶体和某些离子晶体中也存在共价键。二、分子晶体 1、概念
分子间通过分子间作用力结合而形成的晶体。
2、结构特点
一般来说,由于分子间作用力不具有方向性和饱和性,故分子晶体在堆积排列时尽可能利用空间,采取紧密堆积的方式。C60晶胞 由于分子间作用力很弱,所以分子晶体一般具有:① 较低的熔点、沸点 ② 较小的硬度
③ 一般都是绝缘体,熔融状态不导电。3.分子晶体的物理性质(1)所有非金属氢化物: H2O, H2S, NH3, CH4, HX
(2) 部分非金属单质: X2, N2, O2, H2, S8, P4, C60
(3) 部分非金属氧化物: CO2, SO2, N2O4, P4O10
(4) 几乎所有的酸: H2SO4, HNO3, H3PO4
(5) 大多数有机物: 乙醇,冰醋酸,蔗糖4.常见的分子晶体5.典型的分子晶体
(1)单质碘
晶胞为长方体,每个顶点
和面心各有一个分子。
①平均每个晶胞中有 个
碘分子,
②微粒间的作用力是 。
4范德华力(2)干冰
晶胞为正方体,每个顶点
和面心各有一个分子。
①平均每个晶胞中有 个
CO2分子,
②微粒间的作用力是 ,
③配位数为 。
4范德华力范德华力共价键12(3)冰
冰晶体主要是水分子依靠氢键形成的(亦有范德华力)。由于氢键的方向性和饱和性,分子间距比较大,有很多空隙,结构比较松散。每个水分子周周有4个水分子,故配位数为4。
氢键具有方向性和饱和性(4)其他分子晶体①硫黄:硫的同素异形体最稳定的是S8,不溶于水,微溶于酒精和乙醚,易溶于CS2。
试管壁上的硫如何洗涤?②磷:白磷白色蜡状固体,剧毒,着火点很低;
红磷红色粉末固体,无毒,着火点较高。白磷为何不能制造安全火柴?三、石墨范德华力,层间距0.335nm石墨中C-C键角为120。, C-C键长为0.142nm
1.结构特点:①石墨晶体是层状结构,每一层碳原子排列成六边形,则碳原子采用 杂化。未成对电子形成 键。
②石墨晶体中C原子数与C-C键数之比是 。其中每个正六边形占有的 C原子数平均为 个。
22︰3大πsp22.晶体类型:
每一层上以共价键结合,层与层之间为范德华力,未成对电子能在整个平面上运动,具有金属键的性质。
这种晶体称为混合键型晶体(过渡型晶体)3.性质:
熔点高(σ键和大π键共同作用,键能大)
质软(层间范德华力作用弱)
易导电(大π键有金属键的性质)4.用途:制造电极,润滑剂,铅笔芯,中子减速剂等四种晶体的比较:阴、阳离子原子分子金属原子离子键共价键分子间作用力金属键一般较高,少部分低较高很高较低较大很大一般较小一般较大,少部分小一般易溶水难溶相似相溶难溶,钠等除外晶体不导电,溶于水能电离其水溶液可导电,熔化不导电晶体不导电, 溶于水或熔化导电有的能导电,如硅晶体导电,熔化导电四、物质熔沸点高低比较规律:(金榜P47)(1)不同晶体类型的物质的熔沸点高低顺序一般是:(2)原子晶体要比较共价键的强弱(3)离子晶体要比较离子键的强弱 原子晶体>离子晶体>分子晶体同一晶体类型的物质,则晶体内部粒子间的作用越强,熔、沸点越高。一般地说,原子半径越小,形成的共价键的键长越短,键能越大,其晶体熔、沸点越高。如:金刚石>碳化硅>晶体硅一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔、沸点就越高。如:NaCl>KCl>RbCl>CsCl(4)分子晶体:(5)金属晶体:结构和组成相似的物质,相对分子质量越大,熔、沸 点越高(注意氢键影响),如:HF>HI>HBr>HCl在同分异构体中,一般地说,支链越多(越对称), 熔、沸点越低, 如:正戊烷>异戊烷>新戊烷在同分异构体的芳香烃及其衍生物中,其熔、沸点高 低顺序一般是:邻>间>对位化合物金属晶体中金属离子半径越小,离子电荷数越多,其金属键越强,金属熔、沸点越高。 Al>Mg>Na Li>Na>K>Rb>Cs 合金<各成分 相对分子量接近的物质,极性越强,熔、沸点越高, 如:CO>N2练习:
1.下列晶体中不属于原子晶体的是 ( ) A.干冰 B.金刚砂 C.金刚石 D.水晶
2、下列叙述正确的是 ( )
A.离子晶体都是化合物
B.原子晶体都是单质
C.分子晶体内部都存在共价键
D.金属单质形成的晶体都是金属晶体AAD 3.在金刚石的网状结构中,含有共价键形成的碳原子 环,其中最小的环上,碳原子数是 ( ) A.2个 B.3个 C.4个 D.6个 4,下列各物质中,按熔点由低到高排列正确的是( ) A.O2、I2、Hg B.CO2、KCl、SiO2 C.Na、K、Rb D.SiC、NaCl、SiO2 DB 5.在x mol石英晶体中,含有Si-O键数是 ( ) A.x mol B.2x moI
C.3 x mol D.4x mol 6.固体熔化时,必须破坏非极性共价键的是 ( ) A.冰 B.晶体硅
C.溴 D.二氧化硅 DB
7. 共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是 ( )
A. 干冰 B. 氯化钠
C. 氢氧化钠 D. 碘B
