选修3 3.4 几类其他聚集状态的物质 课件
文档属性
| 名称 | 选修3 3.4 几类其他聚集状态的物质 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 355.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-09 22:45:30 | ||
图片预览









文档简介
课件40张PPT。第4节 分子间作用力与物质性质学习目标
1.了解分子间作用力的广泛存在及对物质性质的影响。
2.了解氢键的形成条件、类型和特点。
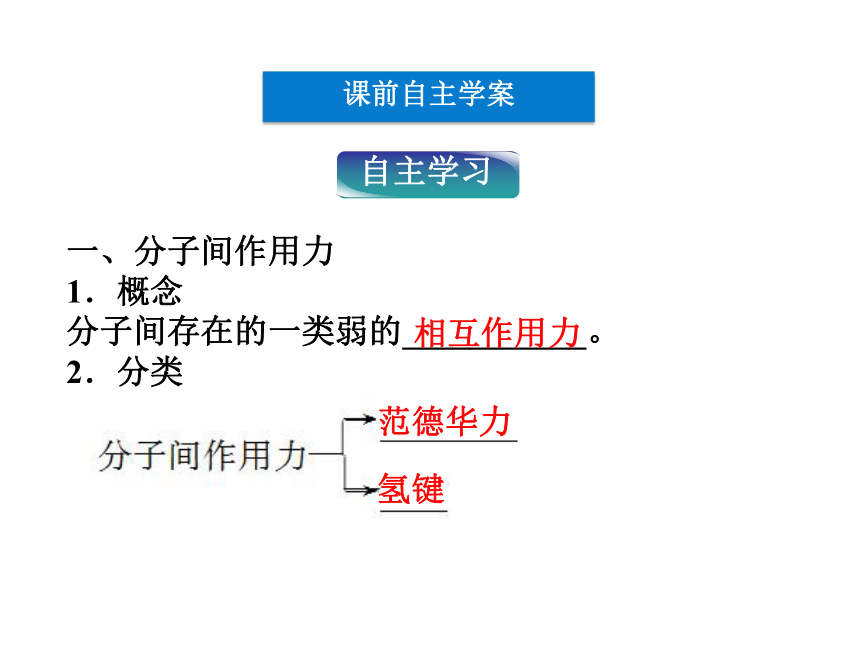
3.列举含有氢键的物质,知道氢键对物质性质的影响。课前自主学案一、分子间作用力
1.概念
分子间存在的一类弱的___________。
2.分类相互作用力范德华力氢键思考感悟
1.水分解和水在三态转变时改变的作用力相同吗?
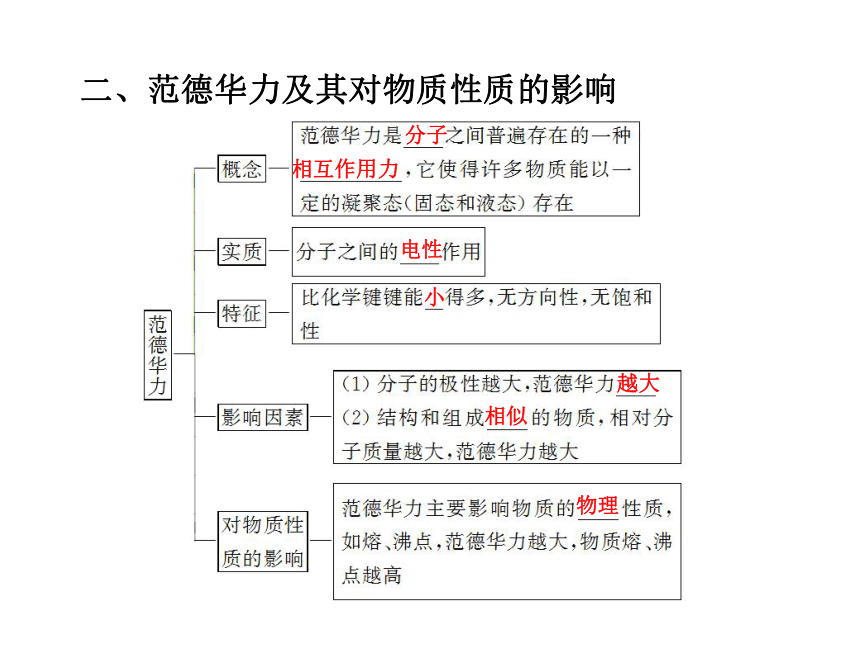
【提示】 水分解时改变分子间作用力和分子内的化学键,三态转变时只改变分子间作用力。二、范德华力及其对物质性质的影响分子相互作用力电性小越大相似物理思考感悟
2.Cl2、Br2、I2三者的组成和化学性质均相似,但状态却为气、液、固的原因是什么?
【提示】 Cl2、Br2、I2的组成和结构相似,由于相对分子质量逐渐增大,所以范德华力逐渐增大,故熔、沸点升高,状态由气体变为液体、固体。三、氢键与物质性质
1.氢键的概念
当氢原子与电负性大的原子X以共价键结合时,H原子与另一个电负性大的原子Y之间的_________________。
2.氢键的表示形式
(1)通常用____________表示氢键,其中X—H表示氢原子和X原子以_________相结合。静电相互作用X—H…Y共价键(2)氢键的键长是指________间的距离,键能是指X—H…Y分解为X—H和Y所需要的能量。
3.氢键的形成条件
(1)氢原子位于X原子和Y原子之间。
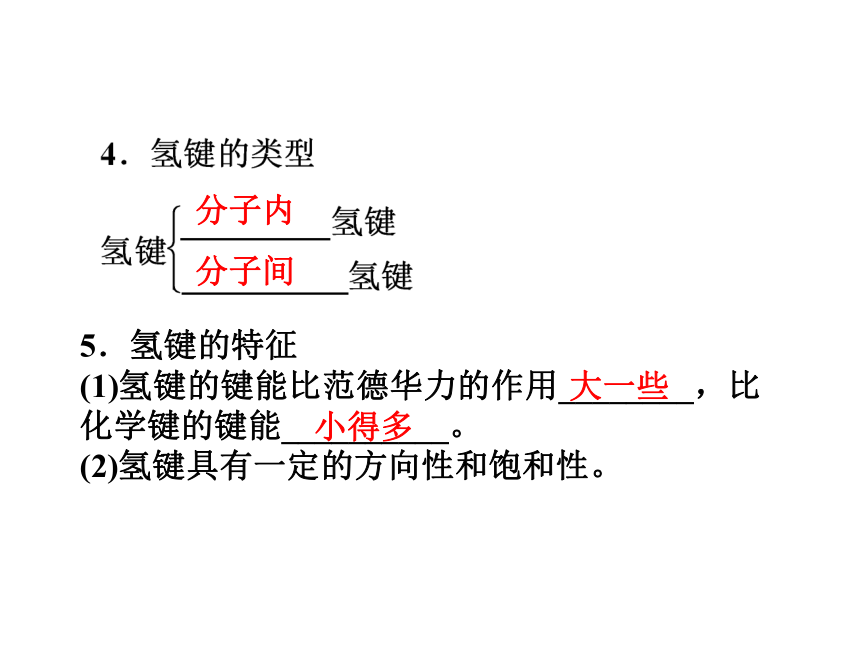
(2)X、Y原子所属元素具有很强的_________和很小的____________。X、Y原子主要是_____________原子。X和Y电负性原子半径N、O、F5.氢键的特征
(1)氢键的键能比范德华力的作用________,比化学键的键能__________。
(2)氢键具有一定的方向性和饱和性。分子内分子间大一些小得多6.氢键对物质性质的影响
(1)当形成分子间氢键时,物质的熔、沸点将_______。
(2)当形成分子内氢键时,物质的熔、沸点将_______。
(3)氢键也影响物质的_____、______等过程。升高降低电离溶解思考感悟
3.(1)能形成氢键的物质中一定存在氢键吗?
(2)液态水中分子间的作用力只有氢键吗?水分子的稳定性是氢键的影响吗?
【提示】 (1)不一定。氢键的存在也与物质的状态有关,如液态和固态水中存在氢键,但气态水分子之间由于距离太远无法形成氢键。
(2)液态水分子之间的作用力主要是氢键,但也存在范德华力。在水分子内部存在共价键(O—H键),由于H—O键键能较大,因此水分子稳定。所以水分子的稳定性与氢键无关。1.下列关于范德华力影响物质性质的叙述中,正确的是( )
A.范德华力是决定由分子构成的物质熔、沸点高低的唯一因素
B.范德华力与物质的物理性质没有必然的联系
C.范德华力能够影响物质的化学性质和物理性质
D.范德华力是仅影响物质部分物理性质的一种因素解析:选D。范德华力不能影响物质的化学性质,仅能影响由分子构成的物质的部分物理性质,如熔点、沸点及溶解性等,并且不是唯一的影响因素。2.下列变化中,不需要破坏化学键的是( )
A.干冰汽化
B.氯化氢溶于水
C.水通电分解成氢气和氧气
D.加热使氯化钠熔化
解析:选A。干冰汽化破坏的是范德华力,氯化氢溶于水破坏的是共价键,水通电分解生成氢气和氧气破坏的是共价键,加热使氯化钠熔化破坏的是离子键。3.关于氢键的下列说法正确的是( )
A.由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为HF>H2O>NH3
B.氢键只能存在于分子间,不能存在于分子内
C.没有氢键,就没有生命
D.相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多解析:选C。A项“反常”是指它们在本族氢化物沸点排序中的现象。它们的沸点顺序可由存在状态看出,常温下只有水是液体,应该水的沸点最高。B项分子内可以存在氢键。C项正确,因为氢键造就了常温常压下的水是液态,而液态的水是生物体营养传递的基础。D项水在气态时,分子间距离大,一般认为分子之间没有氢键。课堂互动讲练特别提醒:(1)有氢键的分子间也有范德华力,但有范德华力的分子间不一定有氢键。
(2)氢键与范德华力主要影响物质的物理性质。如熔点、沸点等。化学键主要影响物质的化学性质。 下列说法不正确的是( )
A.分子间作用力是分子间相互作用力的总称
B.分子间氢键的形成对物质的溶解度有影响
C.范德华力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛地存在于自然界中【解析】 分子间作用力是分子间相互作用力的总称,A正确;范德华力是分子与分子间的相互作用力,而氢键是分子间比范德华力稍强的作用力,它们可以同时存在于分子之间,C正确;分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解度等也有影响,B正确;氢键不是化学键,化学键是原子与原子间强烈的相互作用,D错误。【答案】 D
【误区警示】 (1)分子间作用力不等价于范德华力,对某些分子来说分子间作用力包括范德华力和氢键。
(2)氢键不是化学键。1.范德华力对物质性质的影响
(1)对物质熔、沸点的影响
一般说来,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点通常越高。如熔、沸点:I2>Br2>Cl2>F2,Rn>Xe>Kr>Ar>Ne>He。
(2)对物质溶解性的影响
如:在273 K、101 kPa时,氧气在水中的溶解度
(0.049 cm3·L-1)比氮气在水中的溶解度(0.024 cm3·L-1)大,就是因为O2与水分子之间的作用力比N2与水分子之间的作用力大所导致的。(3)相似相溶原理
极性分子易溶于极性溶剂中(如HCl易溶于水中),非极性分子易溶于非极性溶剂中(如I2易溶于CCl4中,白磷易溶于CS2中)。
2.氢键对物质性质的影响
(1)对物质熔、沸点的影响
①某些氢化物分子存在氢键,如H2O、NH3、HF等,会比同族氢化物沸点反常,如H2O>H2Te>H2Se>H2S。②当氢键存在于分子内时,它对物质性质的影响与分子间氢键对物质性质产生的影响是不同的。邻羟基苯甲醛的氢键存在于分子内部,对羟基苯甲醛存在分子间氢键,因此对羟基苯甲醛的熔点、沸点分别比邻羟基苯甲醛的熔点、沸点高。
(2)对物质密度的影响
氢键的存在,会使物质的密度出现反常,如液态水变为冰,密度会变小。(3)对物质溶解度的影响
溶剂和溶质之间存在氢键,溶解性好,溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的原因。
(4)氢键对物质结构的影响
氢键的存在使一些物质具有一些特殊结构,如冰晶体的孔穴结构;DNA的双螺旋结构等。特别提醒:判断物质的性质受何种作用力影响,首先要弄清该性质是物理性质还是化学性质,然后找出其影响因素。同时也要能根据作用力的强弱分析物质性质的变化规律。如键能越大,键长越短,键能越强,化学性质越稳定;相对分子质量越大,分子间作用力越强,熔、沸点越高。 如图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物沸点的是曲线________,表示ⅣA族元素气态氢化物沸点的是曲线________;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是_____________________________________。
曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是________________________________________。【解析】 H2O与H2O分子之间可形成四个氢键,故沸点最高,故A为ⅥA族氢化物沸点曲线,ⅣA族的氢化物都为非极性分子,沸点较低,第2周期元素的氢化物间不存在氢键,故选D。由于同一主族中第3、4、5周期元素的气态氢化物间不存在氢键,且结构相似,所以它们沸点与范德华力有关,而范德华力与相对分子质量有关,故随着相对分子质量的增大,沸点随之升高。曲线中第2周期元素的气态氢化物沸点显著高于第3周期元素气态氢化物,原因是第2周期元素氢化物分子间存在氢键。【答案】 A D 结构相似,相对分子质量增大,范德华力增大,沸点升高 分子间存在氢键
【规律方法】 影响物质性质因素的判断
在分子内部和分子间存在着不同的作用力,这些作用力对分子的物理性质和化学性质都有不同程度的影响。因此在分析某些性质时容易造成混淆。
(1)共价键是原子间通过共用电子对形成的化学键,它存在于分子内部,影响物质的化学性质,如稳定性、活泼性等。(2)分子间作用力是分子间微弱的相互作用,包括范德华力和氢键。分子间作用力只影响物质的物理性质,如熔点、沸点、硬度等。
(3)氢键是一种介于化学键和范德华力之间的相互作用,它只存在于分子间或分子内活动性较强的非金属元素N、O、F和与之相邻的H之间。氢键的存在对物质的熔点、沸点、溶解性等物理性质有很大影响,如H2O的沸点比H2S的高许多,NH3极易溶于水等。
(4)由于稀有气体是单原子分子,因此在形成晶体时,只存在分子间作用力,而不存在共价键。变式训练2 若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间主要的相互作用依次是( )
A.氢键;分子间作用力;非极性键
B.氢键;氢键;极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键解析:选B。固态的水与液态的水分子间的作用力种类相同,均为氢键和范德华力,区别在于氢键的数目,故由固态水→液态水破坏氢键,同样,由液态水变为水蒸气时,破坏的也是氢键,而由H2O(气)→H2(气)+O2(气)时破坏了化学键,故选B。探究整合应用水分子间存在“氢键”从而彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过氢键相互连接成庞大的冰晶体,其结构示意图如图所示:(1)1 mol冰中有________mol“氢键”。
(2)在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是________kJ·mol-1。
(3)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是________,其判断依据是___________________________________(3)氢键对物质熔、沸点的影响:某些氢化物分子间存在氢键,如H2O、NH3、HF等,会使同族氢化物沸点反常,如H2O>H2Te>H2Se>H2S。
【答案】 (1)2 (2)20
(3)x>z>y 水分子间存在氢键,故沸点最高,硒化氢比硫化氢相对分子质量大,分子间作用力大,故硒化氢沸点高
1.了解分子间作用力的广泛存在及对物质性质的影响。
2.了解氢键的形成条件、类型和特点。
3.列举含有氢键的物质,知道氢键对物质性质的影响。课前自主学案一、分子间作用力
1.概念
分子间存在的一类弱的___________。
2.分类相互作用力范德华力氢键思考感悟
1.水分解和水在三态转变时改变的作用力相同吗?
【提示】 水分解时改变分子间作用力和分子内的化学键,三态转变时只改变分子间作用力。二、范德华力及其对物质性质的影响分子相互作用力电性小越大相似物理思考感悟
2.Cl2、Br2、I2三者的组成和化学性质均相似,但状态却为气、液、固的原因是什么?
【提示】 Cl2、Br2、I2的组成和结构相似,由于相对分子质量逐渐增大,所以范德华力逐渐增大,故熔、沸点升高,状态由气体变为液体、固体。三、氢键与物质性质
1.氢键的概念
当氢原子与电负性大的原子X以共价键结合时,H原子与另一个电负性大的原子Y之间的_________________。
2.氢键的表示形式
(1)通常用____________表示氢键,其中X—H表示氢原子和X原子以_________相结合。静电相互作用X—H…Y共价键(2)氢键的键长是指________间的距离,键能是指X—H…Y分解为X—H和Y所需要的能量。
3.氢键的形成条件
(1)氢原子位于X原子和Y原子之间。
(2)X、Y原子所属元素具有很强的_________和很小的____________。X、Y原子主要是_____________原子。X和Y电负性原子半径N、O、F5.氢键的特征
(1)氢键的键能比范德华力的作用________,比化学键的键能__________。
(2)氢键具有一定的方向性和饱和性。分子内分子间大一些小得多6.氢键对物质性质的影响
(1)当形成分子间氢键时,物质的熔、沸点将_______。
(2)当形成分子内氢键时,物质的熔、沸点将_______。
(3)氢键也影响物质的_____、______等过程。升高降低电离溶解思考感悟
3.(1)能形成氢键的物质中一定存在氢键吗?
(2)液态水中分子间的作用力只有氢键吗?水分子的稳定性是氢键的影响吗?
【提示】 (1)不一定。氢键的存在也与物质的状态有关,如液态和固态水中存在氢键,但气态水分子之间由于距离太远无法形成氢键。
(2)液态水分子之间的作用力主要是氢键,但也存在范德华力。在水分子内部存在共价键(O—H键),由于H—O键键能较大,因此水分子稳定。所以水分子的稳定性与氢键无关。1.下列关于范德华力影响物质性质的叙述中,正确的是( )
A.范德华力是决定由分子构成的物质熔、沸点高低的唯一因素
B.范德华力与物质的物理性质没有必然的联系
C.范德华力能够影响物质的化学性质和物理性质
D.范德华力是仅影响物质部分物理性质的一种因素解析:选D。范德华力不能影响物质的化学性质,仅能影响由分子构成的物质的部分物理性质,如熔点、沸点及溶解性等,并且不是唯一的影响因素。2.下列变化中,不需要破坏化学键的是( )
A.干冰汽化
B.氯化氢溶于水
C.水通电分解成氢气和氧气
D.加热使氯化钠熔化
解析:选A。干冰汽化破坏的是范德华力,氯化氢溶于水破坏的是共价键,水通电分解生成氢气和氧气破坏的是共价键,加热使氯化钠熔化破坏的是离子键。3.关于氢键的下列说法正确的是( )
A.由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为HF>H2O>NH3
B.氢键只能存在于分子间,不能存在于分子内
C.没有氢键,就没有生命
D.相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多解析:选C。A项“反常”是指它们在本族氢化物沸点排序中的现象。它们的沸点顺序可由存在状态看出,常温下只有水是液体,应该水的沸点最高。B项分子内可以存在氢键。C项正确,因为氢键造就了常温常压下的水是液态,而液态的水是生物体营养传递的基础。D项水在气态时,分子间距离大,一般认为分子之间没有氢键。课堂互动讲练特别提醒:(1)有氢键的分子间也有范德华力,但有范德华力的分子间不一定有氢键。
(2)氢键与范德华力主要影响物质的物理性质。如熔点、沸点等。化学键主要影响物质的化学性质。 下列说法不正确的是( )
A.分子间作用力是分子间相互作用力的总称
B.分子间氢键的形成对物质的溶解度有影响
C.范德华力与氢键可同时存在于分子之间
D.氢键是一种特殊的化学键,它广泛地存在于自然界中【解析】 分子间作用力是分子间相互作用力的总称,A正确;范德华力是分子与分子间的相互作用力,而氢键是分子间比范德华力稍强的作用力,它们可以同时存在于分子之间,C正确;分子间氢键的形成除使物质的熔、沸点升高外,对物质的溶解度等也有影响,B正确;氢键不是化学键,化学键是原子与原子间强烈的相互作用,D错误。【答案】 D
【误区警示】 (1)分子间作用力不等价于范德华力,对某些分子来说分子间作用力包括范德华力和氢键。
(2)氢键不是化学键。1.范德华力对物质性质的影响
(1)对物质熔、沸点的影响
一般说来,组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点通常越高。如熔、沸点:I2>Br2>Cl2>F2,Rn>Xe>Kr>Ar>Ne>He。
(2)对物质溶解性的影响
如:在273 K、101 kPa时,氧气在水中的溶解度
(0.049 cm3·L-1)比氮气在水中的溶解度(0.024 cm3·L-1)大,就是因为O2与水分子之间的作用力比N2与水分子之间的作用力大所导致的。(3)相似相溶原理
极性分子易溶于极性溶剂中(如HCl易溶于水中),非极性分子易溶于非极性溶剂中(如I2易溶于CCl4中,白磷易溶于CS2中)。
2.氢键对物质性质的影响
(1)对物质熔、沸点的影响
①某些氢化物分子存在氢键,如H2O、NH3、HF等,会比同族氢化物沸点反常,如H2O>H2Te>H2Se>H2S。②当氢键存在于分子内时,它对物质性质的影响与分子间氢键对物质性质产生的影响是不同的。邻羟基苯甲醛的氢键存在于分子内部,对羟基苯甲醛存在分子间氢键,因此对羟基苯甲醛的熔点、沸点分别比邻羟基苯甲醛的熔点、沸点高。
(2)对物质密度的影响
氢键的存在,会使物质的密度出现反常,如液态水变为冰,密度会变小。(3)对物质溶解度的影响
溶剂和溶质之间存在氢键,溶解性好,溶质分子不能与水分子形成氢键,在水中溶解度就比较小。如NH3极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的原因。
(4)氢键对物质结构的影响
氢键的存在使一些物质具有一些特殊结构,如冰晶体的孔穴结构;DNA的双螺旋结构等。特别提醒:判断物质的性质受何种作用力影响,首先要弄清该性质是物理性质还是化学性质,然后找出其影响因素。同时也要能根据作用力的强弱分析物质性质的变化规律。如键能越大,键长越短,键能越强,化学性质越稳定;相对分子质量越大,分子间作用力越强,熔、沸点越高。 如图中A、B、C、D四条曲线分别表示ⅣA、ⅤA、ⅥA、ⅦA族元素的气态氢化物的沸点,其中表示ⅥA族元素气态氢化物沸点的是曲线________,表示ⅣA族元素气态氢化物沸点的是曲线________;同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因是_____________________________________。
曲线中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因是________________________________________。【解析】 H2O与H2O分子之间可形成四个氢键,故沸点最高,故A为ⅥA族氢化物沸点曲线,ⅣA族的氢化物都为非极性分子,沸点较低,第2周期元素的氢化物间不存在氢键,故选D。由于同一主族中第3、4、5周期元素的气态氢化物间不存在氢键,且结构相似,所以它们沸点与范德华力有关,而范德华力与相对分子质量有关,故随着相对分子质量的增大,沸点随之升高。曲线中第2周期元素的气态氢化物沸点显著高于第3周期元素气态氢化物,原因是第2周期元素氢化物分子间存在氢键。【答案】 A D 结构相似,相对分子质量增大,范德华力增大,沸点升高 分子间存在氢键
【规律方法】 影响物质性质因素的判断
在分子内部和分子间存在着不同的作用力,这些作用力对分子的物理性质和化学性质都有不同程度的影响。因此在分析某些性质时容易造成混淆。
(1)共价键是原子间通过共用电子对形成的化学键,它存在于分子内部,影响物质的化学性质,如稳定性、活泼性等。(2)分子间作用力是分子间微弱的相互作用,包括范德华力和氢键。分子间作用力只影响物质的物理性质,如熔点、沸点、硬度等。
(3)氢键是一种介于化学键和范德华力之间的相互作用,它只存在于分子间或分子内活动性较强的非金属元素N、O、F和与之相邻的H之间。氢键的存在对物质的熔点、沸点、溶解性等物理性质有很大影响,如H2O的沸点比H2S的高许多,NH3极易溶于水等。
(4)由于稀有气体是单原子分子,因此在形成晶体时,只存在分子间作用力,而不存在共价键。变式训练2 若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间主要的相互作用依次是( )
A.氢键;分子间作用力;非极性键
B.氢键;氢键;极性键
C.氢键;极性键;分子间作用力
D.分子间作用力;氢键;非极性键解析:选B。固态的水与液态的水分子间的作用力种类相同,均为氢键和范德华力,区别在于氢键的数目,故由固态水→液态水破坏氢键,同样,由液态水变为水蒸气时,破坏的也是氢键,而由H2O(气)→H2(气)+O2(气)时破坏了化学键,故选B。探究整合应用水分子间存在“氢键”从而彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过氢键相互连接成庞大的冰晶体,其结构示意图如图所示:(1)1 mol冰中有________mol“氢键”。
(2)在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德华力(11 kJ·mol-1)。已知冰的升华热是51 kJ·mol-1,则冰晶体中氢键的能量是________kJ·mol-1。
(3)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是________,其判断依据是___________________________________(3)氢键对物质熔、沸点的影响:某些氢化物分子间存在氢键,如H2O、NH3、HF等,会使同族氢化物沸点反常,如H2O>H2Te>H2Se>H2S。
【答案】 (1)2 (2)20
(3)x>z>y 水分子间存在氢键,故沸点最高,硒化氢比硫化氢相对分子质量大,分子间作用力大,故硒化氢沸点高
