选修4 1.1 化学反应的热效应 课件
文档属性
| 名称 | 选修4 1.1 化学反应的热效应 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 776.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-09 22:48:33 | ||
图片预览










文档简介
课件38张PPT。(鲁科版)化学反应原理(选修)第一章 化学反应与能量转化第1节 化学反应的热效应联想·质疑1、化学反应中为什么有能量变化?2、哪些反应是放热反应?哪些反应是吸热反应?化学反应包括两个过程:旧化学键的断裂和新化学键的形成,前者吸收能量,后者放出能量,这两个过程的能量不同,所以有能量变化,整个反应放热还是吸热取决于两个过程能量的相对大小。
所有的化学反应都有能量的变化,其中大部分都是热量的变化常见的放热反应和吸热反应⑴常见的放热反应①活泼金属与水或酸的反应。
如:2Al+6HCl=2AlCl3+3H2↑
②酸碱中和反应。如:2KOH+H2SO4=K2SO4+2H2O
③燃烧反应。如:C、CO、C2H5OH等的燃烧
④多数化合反应。
如:Na2O+H2O =2NaOH,SO3+H2O=H2SO4⑵常见的吸热反应① 多数分解反应,如CaCO3 CaO+CO2↑
② 2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
③ C(s)+H2O(g) CO+H2
④ CO2+C 2CO总之:吸热反应和放热反应是用来定性描述化学反应的能量变化。
那化学上又是如何定量描述化学反应的能量变化呢?1、什么是反应热?
2、反应热的符号是什么?怎样表示反应吸、放热?
3、反应热的单位是什么
4、如何获得一个反应的反应热呢?1、化学上规定,当化学反应在一定的温度下进行时,反应所释放或吸收的热量为该反应在此温度下的热效应。
2、符号:用Q表示
Q<0,表示放热;Q>0,表示吸热;
3、单位:J·mol-1或KJ·mol-1(二)反应热的测定(一)反应热的涵义1.测量仪器:量热计C—热容,当物质吸收热量温度升高时,温度每 升高1K所吸收的热量,称为该物质的热容;
单位:J·K-1
C0—比热容,单位质量物质的热容;
单位:kJ·K-1·kg-1;
液态水的比热为4.18kJ·K-1·kg-1
T—热力学温度,也叫开尔文温度,
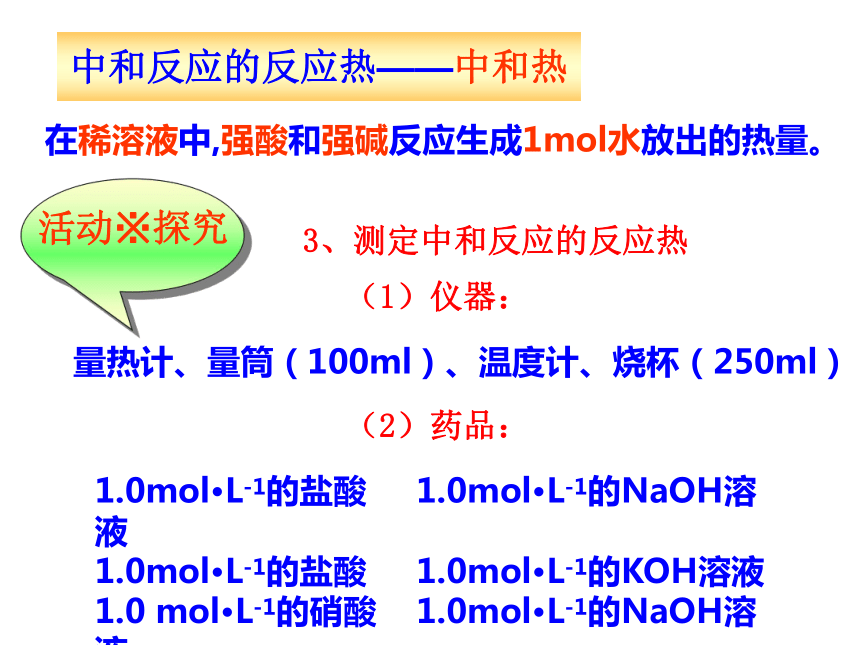
单位为k,T(k)=t(0c)+273.152.反应热的计算计算公式: Q= - C(T2 -T1)=- C0m(T2-T1)中和反应的反应热——中和热在稀溶液中,强酸和强碱反应生成1mol水放出的热量。3、测定中和反应的反应热(1)仪器:量热计、量筒(100ml)、温度计、烧杯(250ml)(2)药品:1.0mol·L-1的盐酸 1.0mol·L-1的NaOH溶液
1.0mol·L-1的盐酸 1.0mol·L-1的KOH溶液
1.0 mol·L-1的硝酸 1.0mol·L-1的NaOH溶液实验内容① 向量热计内筒中加入1.0mol·L-1的盐酸100mL,盖上杯盖,插入温度计,匀速搅拌后记录初始温度T1。
② 向250mL烧杯中加入1.0mol·L-1的NaOH溶液100mL,调节其温度,使与量热计中盐酸的温度相同。
③ 快速将烧杯中的碱液倒入量热计中,盖好杯盖,匀速搅拌,记录体系达到的最高温度T2。
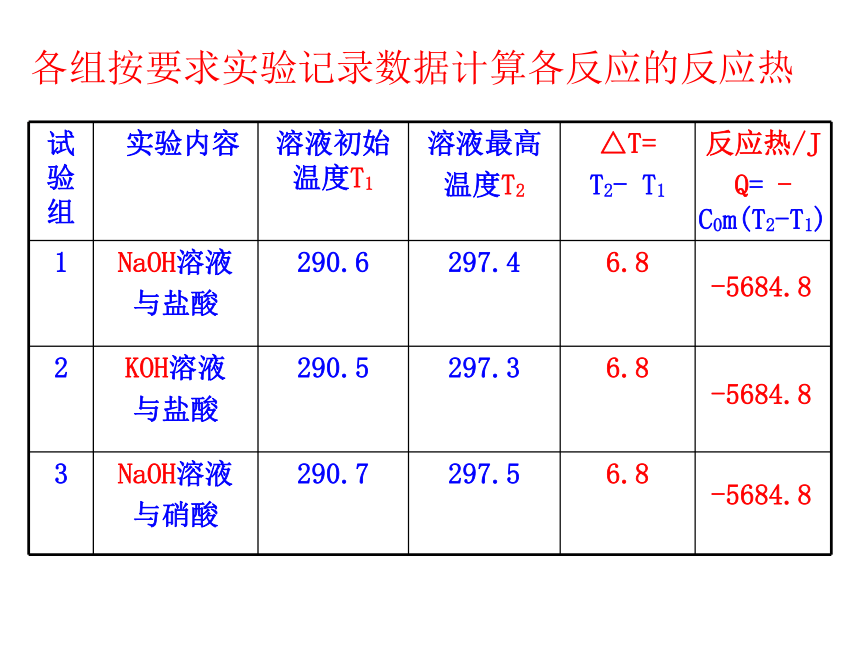
④ 假设溶液的比热等于水的比热并忽略量热计的热容,根据溶液温度升高的数值,计算此中和反应的反应热。各组按要求实验记录数据计算各反应的反应热-5684.8-5684.8-5684.8在测定过程中应注意什么问题?(1)用保温性能好的仪器测量。
(2)混合好后,迅速盖好装置盖子,减少热量的损失。
(3)所用药品浓度的配制须准确,用强酸和强碱溶液,而且要是稀溶液。
(4)宜用有0.1分刻度的温度计,读数尽可能准确,且估读至小数点后二位。同时应注意水银球部位要完全浸没在溶液中,而且要稳定一段时间后再读数,以提高所测的精度。
(5)记录最高温度。 [议一议]你所测得的数据是否为57.3 kJ/mol,若不是,分析产生误差的原因。可能的原因有:
1.量取溶液的体积有误差(测量结果是按100 mL的酸、碱进行计算,若实际量取时,多于100mL或小于100mL都会造成误差)
2.温度计的读数有误。
3.实验过程中有液体洒在外面。
4.混合酸、碱溶液时,动作缓慢,导致实验误差。
5.隔热操作不到位,致使实验过程中热量损失而导致误差。
6.测了酸后的温度计未用水清洗而便立即去测碱的温度,致使热量损失而引起误差。 反应热测定的误差分析问题与研讨1.本实验中若把100mL1.0 mol·L-1的盐酸改为100 mL 1.0mol·L-1醋酸,所测结果是否会有所变化?为什么?
2.若改用200mL 1.0mol·L-1的盐酸和200mL 1.05 mol·L-1的NaOH溶液,所测中和热的数值是否约为本实验结果的二倍(假定各步操作没有失误)?答案:1.会有所变化。因为醋酸为弱电解质,其电离时要吸热,故将使测得结果偏小。
2.否。因中和热是指酸与碱发生中和反应生成1mol H2O时放出的热量,其数值与反应物的量的多少无关,故所测结果应基本和本次实验结果相同(若所有操作都准确无误,且无热量损失,则二者结果相同)。50 mL0.50 mol·L-1盐酸与50mL0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
(1)从实验装置上看,图中尚缺少
的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热
数值 (填“偏大”“偏小”“无影响”)。环形玻璃搅拌棒减少实验过程中的热量损失偏小[练习](4)实验中改用60 mL 0.50mol·L-1盐酸跟50mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热
(填“相等”“不相等”),简述理由:
。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)不相等相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关偏小偏小 为保证测定结果的准确性,在测定过程中应注意什么? (1)为了使中和反应进行完全,可以让酸或碱略 稍过量。
(2)为了使测得的中和热更准确,所用酸和碱的浓度宜小不宜大。
(3)宜使用有0.1℃刻度的温度计。
(4)记录最高温度。
(5)进行反应热的计算式进行了以下处理:
a、忽略量热计的热容;
b、认为稀溶液与水的比热相同
c、认为热容不随温度的变化而变化。课堂小结}热化学下列说法正确的是 ( )
A、物质发生反应时放出的热量来源于对反应的加热
B、化学反应除了生成新物质外,还发生能量变化。
C、化学反应中放出的热才是反应热
D、需要加热方能发生的反应一定是吸热反应B练习:1.焓(H):是与体系的内能、压强、体积有关的一个物理量
2.焓变(△H):△H=H生成物- H反应物
在等温等压条件下的化学反应,如果不做非体积功(即没有转化为电能、光能等其他形式的能),则该反应的反应热等于反应前后物质的焓变。即:Qp= △H
∵ Qp>0为吸热反应,Qp<0为放热反应
∴ 当ΔH >0时,为吸热反应。
当ΔH <0时,为放热反应。当?H为“-”( ?H<0)时,为放热反应当?H为“+”( ?H>0)时,为吸热反应与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?交流研讨 下列方程式属于热化学方程式: H2与I2 反应的化学方程式为:意义:热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。问题:二者在书写形式上有哪些异同点?1.定义:把一个化学反应物质的变化和反应的焓变同时表示出来的方程式,叫做热化学方程式。
2.写法:
1)热化学方程式要注明反应的温度、压强(298 K,
101 kPa时不写)一般不写其他反应条件;不标明生成沉淀或气体符号。
2)要注明反应物和生成物的聚集状态,常用s、l、g、aq表示固体、液体、气体和溶液。3) ΔH后要注明反应温度,ΔH的单位为J·mol-1或KJ·mol-1
4)ΔH的值必须与方程式的化学计量数对应。计量数加倍时,ΔH也要加倍。当反应逆向进行时, 其ΔH与正反应的数值相等,符号相反。
5)方程式中的化学计量数以“mol”为单位,不表示分子数,因此可以是整数,也可以是分数。
6) 可逆反应的ΔH表明的是完全反应时的数据。例 题1、当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。H2(g)+ Cl2(g)=2HCl(g) ?H = -184.6KJ·mol-11.写出下列反应的热化学方程式课堂练习(1)1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
(2)2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量; N2(g)+O2(g)==2NO (g); ?H = +68KJ·mol-12Cu(s)+ O2(g)==2CuO(s),?H = -314KJ·mol-1Cu(s)+ 1/2O2(g)== CuO(s),?H = -157KJ·mol-1A2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 3、已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是( )
A、C8H18(l)+25/2O2(g)=8CO2(g)+ 9H2O(g)
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2(g)+ 9H2O(l)
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g)+ 9H2O(l)
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2(g)+ 9H2O(l)
△H= - 48.40kJ·mol -1B(一)盖斯定律无论化学反应是一步完成还是分几步完成,其反应焓变是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。C(s)+ ? O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案计算该反应的ΔH。提示:(1) C(s) + O2(g) = CO2(g)
△H1=-393.5 kJ·mol-1
(2) CO(g) + ?O2(g) = CO2(g)
△H3=-283.0 kJ·mol-1△H1 = △H2+ △H3
△H2 = △H1- △H3
= -393.5 kJ·mol-1 -(-283.0 kJ·mol-1)
= -110.5 kJ·mol-1
C(s)+?O2(g)=CO(g) △H=-110.5 kJ·mol-1 (二)反应热的计算1.应用热化学方程式的计算
【例1】25℃、101kPa时,使1.0 g钠与足量的氯气反应,生成氯钠晶体并放出17.87 kJ的热量,求生成1 mol氯化钠的反应热。
【解】 Na(g) + ? Cl2(g) == NaCl(s)
Q=17.87kJ/1g×23g·mol-1
= 411kJ·mol-1
答:生成1molNaCl时放出热量411kJ。2.应用盖斯定律计算
【例2】已知下列反应的反应热为
⑴ CH3COOH(l)+ 2O2(g)== 2CO2(g)+ 2H2O(l)
△H1= -870.3 kJ·mol-1
⑵ C(s)+ O2(g)== CO2(g)
△H2= -393.5 kJ·mol-1
⑶ H2(g)+ ? O2(g)== H2O(l)
△H3= -285.8 kJ·mol-1
试计算下述反应的反应热:
2C(s)+ 2H2(g) + O2(g) == CH3COOH(l) 【解】 分析各方程式的关系,知将方程式按
2[⑵+⑶]-⑴组合得上述反应方程式
即:△H=2[△H2 +△H3]-△H1
△H =2[(-393.5kJ·mol-1)+(-285.8kJ·mol-1)]
-(-870.3kJ·mol-1)
= -488.3kJ·mol-1
答:反应2C(s)+2H2(g)+ O2(g)== CH3COOH(l)
反应热为-488.3kJ·mol-1
3.根据键能计算
△H=反应物键能总和-生成物键能总和已知:N2(g)+ 2O2(g) = 2NO2(g)
△H = +68kJ·mol-1
N2H4(l)+ O2(g) = N2(g)+ 2H2O(l)
△H = -622kJ·mol-1
火箭发射时用肼N2H4(l)作燃料,NO2作氧化剂,反应生成N2和H2O(l),写出该反应的热化学方程式。练习1 N2H4(l) + NO2(g)= 3/2 N2(g)+2H2O(l)
△H =-622kJ·mol-1 –(68kJ·mol-1)/2
=-656kJ·mol-1将焦炭转化为水煤气的主要反应为:
C (s) + H2O(g) = CO(g) + H2(g)
已知:
C (s) + O2(g) = CO2(g) △H1=-393.5kJ·mol-1
H2(g) + ? O2(g) = H2O(g) △H2=-242.0kJ·mol-1
CO(g) + ? O2(g) = CO2(g) △H3=-283.0kJ·mol-1
写出制取水煤气的热化学方程式.练习2 C(s)+H2O(g)=CO(g)+H2(g) △H=131.5kJ·mol-1同学们,再见!
所有的化学反应都有能量的变化,其中大部分都是热量的变化常见的放热反应和吸热反应⑴常见的放热反应①活泼金属与水或酸的反应。
如:2Al+6HCl=2AlCl3+3H2↑
②酸碱中和反应。如:2KOH+H2SO4=K2SO4+2H2O
③燃烧反应。如:C、CO、C2H5OH等的燃烧
④多数化合反应。
如:Na2O+H2O =2NaOH,SO3+H2O=H2SO4⑵常见的吸热反应① 多数分解反应,如CaCO3 CaO+CO2↑
② 2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
③ C(s)+H2O(g) CO+H2
④ CO2+C 2CO总之:吸热反应和放热反应是用来定性描述化学反应的能量变化。
那化学上又是如何定量描述化学反应的能量变化呢?1、什么是反应热?
2、反应热的符号是什么?怎样表示反应吸、放热?
3、反应热的单位是什么
4、如何获得一个反应的反应热呢?1、化学上规定,当化学反应在一定的温度下进行时,反应所释放或吸收的热量为该反应在此温度下的热效应。
2、符号:用Q表示
Q<0,表示放热;Q>0,表示吸热;
3、单位:J·mol-1或KJ·mol-1(二)反应热的测定(一)反应热的涵义1.测量仪器:量热计C—热容,当物质吸收热量温度升高时,温度每 升高1K所吸收的热量,称为该物质的热容;
单位:J·K-1
C0—比热容,单位质量物质的热容;
单位:kJ·K-1·kg-1;
液态水的比热为4.18kJ·K-1·kg-1
T—热力学温度,也叫开尔文温度,
单位为k,T(k)=t(0c)+273.152.反应热的计算计算公式: Q= - C(T2 -T1)=- C0m(T2-T1)中和反应的反应热——中和热在稀溶液中,强酸和强碱反应生成1mol水放出的热量。3、测定中和反应的反应热(1)仪器:量热计、量筒(100ml)、温度计、烧杯(250ml)(2)药品:1.0mol·L-1的盐酸 1.0mol·L-1的NaOH溶液
1.0mol·L-1的盐酸 1.0mol·L-1的KOH溶液
1.0 mol·L-1的硝酸 1.0mol·L-1的NaOH溶液实验内容① 向量热计内筒中加入1.0mol·L-1的盐酸100mL,盖上杯盖,插入温度计,匀速搅拌后记录初始温度T1。
② 向250mL烧杯中加入1.0mol·L-1的NaOH溶液100mL,调节其温度,使与量热计中盐酸的温度相同。
③ 快速将烧杯中的碱液倒入量热计中,盖好杯盖,匀速搅拌,记录体系达到的最高温度T2。
④ 假设溶液的比热等于水的比热并忽略量热计的热容,根据溶液温度升高的数值,计算此中和反应的反应热。各组按要求实验记录数据计算各反应的反应热-5684.8-5684.8-5684.8在测定过程中应注意什么问题?(1)用保温性能好的仪器测量。
(2)混合好后,迅速盖好装置盖子,减少热量的损失。
(3)所用药品浓度的配制须准确,用强酸和强碱溶液,而且要是稀溶液。
(4)宜用有0.1分刻度的温度计,读数尽可能准确,且估读至小数点后二位。同时应注意水银球部位要完全浸没在溶液中,而且要稳定一段时间后再读数,以提高所测的精度。
(5)记录最高温度。 [议一议]你所测得的数据是否为57.3 kJ/mol,若不是,分析产生误差的原因。可能的原因有:
1.量取溶液的体积有误差(测量结果是按100 mL的酸、碱进行计算,若实际量取时,多于100mL或小于100mL都会造成误差)
2.温度计的读数有误。
3.实验过程中有液体洒在外面。
4.混合酸、碱溶液时,动作缓慢,导致实验误差。
5.隔热操作不到位,致使实验过程中热量损失而导致误差。
6.测了酸后的温度计未用水清洗而便立即去测碱的温度,致使热量损失而引起误差。 反应热测定的误差分析问题与研讨1.本实验中若把100mL1.0 mol·L-1的盐酸改为100 mL 1.0mol·L-1醋酸,所测结果是否会有所变化?为什么?
2.若改用200mL 1.0mol·L-1的盐酸和200mL 1.05 mol·L-1的NaOH溶液,所测中和热的数值是否约为本实验结果的二倍(假定各步操作没有失误)?答案:1.会有所变化。因为醋酸为弱电解质,其电离时要吸热,故将使测得结果偏小。
2.否。因中和热是指酸与碱发生中和反应生成1mol H2O时放出的热量,其数值与反应物的量的多少无关,故所测结果应基本和本次实验结果相同(若所有操作都准确无误,且无热量损失,则二者结果相同)。50 mL0.50 mol·L-1盐酸与50mL0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:
(1)从实验装置上看,图中尚缺少
的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热
数值 (填“偏大”“偏小”“无影响”)。环形玻璃搅拌棒减少实验过程中的热量损失偏小[练习](4)实验中改用60 mL 0.50mol·L-1盐酸跟50mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热
(填“相等”“不相等”),简述理由:
。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会 ;用50 mL 0.50mol·L-1 NaOH溶液进行上述实验,测得的中和热的数值会 。(均填“偏大”“偏小”“无影响”)不相等相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关偏小偏小 为保证测定结果的准确性,在测定过程中应注意什么? (1)为了使中和反应进行完全,可以让酸或碱略 稍过量。
(2)为了使测得的中和热更准确,所用酸和碱的浓度宜小不宜大。
(3)宜使用有0.1℃刻度的温度计。
(4)记录最高温度。
(5)进行反应热的计算式进行了以下处理:
a、忽略量热计的热容;
b、认为稀溶液与水的比热相同
c、认为热容不随温度的变化而变化。课堂小结}热化学下列说法正确的是 ( )
A、物质发生反应时放出的热量来源于对反应的加热
B、化学反应除了生成新物质外,还发生能量变化。
C、化学反应中放出的热才是反应热
D、需要加热方能发生的反应一定是吸热反应B练习:1.焓(H):是与体系的内能、压强、体积有关的一个物理量
2.焓变(△H):△H=H生成物- H反应物
在等温等压条件下的化学反应,如果不做非体积功(即没有转化为电能、光能等其他形式的能),则该反应的反应热等于反应前后物质的焓变。即:Qp= △H
∵ Qp>0为吸热反应,Qp<0为放热反应
∴ 当ΔH >0时,为吸热反应。
当ΔH <0时,为放热反应。当?H为“-”( ?H<0)时,为放热反应当?H为“+”( ?H>0)时,为吸热反应与化学方程式相比,热化学方程式有哪些不同?
正确书写热化学方程式应注意哪几点?交流研讨 下列方程式属于热化学方程式: H2与I2 反应的化学方程式为:意义:热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。问题:二者在书写形式上有哪些异同点?1.定义:把一个化学反应物质的变化和反应的焓变同时表示出来的方程式,叫做热化学方程式。
2.写法:
1)热化学方程式要注明反应的温度、压强(298 K,
101 kPa时不写)一般不写其他反应条件;不标明生成沉淀或气体符号。
2)要注明反应物和生成物的聚集状态,常用s、l、g、aq表示固体、液体、气体和溶液。3) ΔH后要注明反应温度,ΔH的单位为J·mol-1或KJ·mol-1
4)ΔH的值必须与方程式的化学计量数对应。计量数加倍时,ΔH也要加倍。当反应逆向进行时, 其ΔH与正反应的数值相等,符号相反。
5)方程式中的化学计量数以“mol”为单位,不表示分子数,因此可以是整数,也可以是分数。
6) 可逆反应的ΔH表明的是完全反应时的数据。例 题1、当1mol气态H2与1mol气态Cl2反应生成2mol气态HCl,放出184.6KJ的热量,请写出该反应的热化学方程式。H2(g)+ Cl2(g)=2HCl(g) ?H = -184.6KJ·mol-11.写出下列反应的热化学方程式课堂练习(1)1molN2(g)与适量O2(g)反应生成NO (g),需吸收68kJ的热量;
(2)2molCu(s)与适量O2(g)反应生成CuO(s),放出314kJ热量; N2(g)+O2(g)==2NO (g); ?H = +68KJ·mol-12Cu(s)+ O2(g)==2CuO(s),?H = -314KJ·mol-1Cu(s)+ 1/2O2(g)== CuO(s),?H = -157KJ·mol-1A2、已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )A. H2O(g)=H2(g)+1/2O2(g);ΔH=+242kJ·mol-1
B. 2H2(g)+O2(g)=2H2O(l);ΔH=-484kJ·mol-1
C. H2(g)+1/2O2(g)=H2O(g);ΔH=+242kJ·mol-1
D. 2H2(g)+O2(g)=2H2O(g);ΔH=+484kJ·mol-1 3、已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量。表示上述反应的热化学方程式正确的是( )
A、C8H18(l)+25/2O2(g)=8CO2(g)+ 9H2O(g)
△H= - 48.40kJ·mol -1
B、C8H18(l)+25/2O2(g)=8CO2(g)+ 9H2O(l)
△H= - 5518kJ·mol -1
C、C8H18(l)+25/2O2(g)=8CO2(g)+ 9H2O(l)
△H= + 5518kJ·mol -1
D、C8H18(l)+25/2O2(g)=8CO2(g)+ 9H2O(l)
△H= - 48.40kJ·mol -1B(一)盖斯定律无论化学反应是一步完成还是分几步完成,其反应焓变是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。C(s)+ ? O2(g)=CO(g)因为C燃烧时不可能完全生成CO,总有一部分CO2生成,因此这个反应的ΔH无法直接测得,请同学们自己根据盖斯定律设计一个方案计算该反应的ΔH。提示:(1) C(s) + O2(g) = CO2(g)
△H1=-393.5 kJ·mol-1
(2) CO(g) + ?O2(g) = CO2(g)
△H3=-283.0 kJ·mol-1△H1 = △H2+ △H3
△H2 = △H1- △H3
= -393.5 kJ·mol-1 -(-283.0 kJ·mol-1)
= -110.5 kJ·mol-1
C(s)+?O2(g)=CO(g) △H=-110.5 kJ·mol-1 (二)反应热的计算1.应用热化学方程式的计算
【例1】25℃、101kPa时,使1.0 g钠与足量的氯气反应,生成氯钠晶体并放出17.87 kJ的热量,求生成1 mol氯化钠的反应热。
【解】 Na(g) + ? Cl2(g) == NaCl(s)
Q=17.87kJ/1g×23g·mol-1
= 411kJ·mol-1
答:生成1molNaCl时放出热量411kJ。2.应用盖斯定律计算
【例2】已知下列反应的反应热为
⑴ CH3COOH(l)+ 2O2(g)== 2CO2(g)+ 2H2O(l)
△H1= -870.3 kJ·mol-1
⑵ C(s)+ O2(g)== CO2(g)
△H2= -393.5 kJ·mol-1
⑶ H2(g)+ ? O2(g)== H2O(l)
△H3= -285.8 kJ·mol-1
试计算下述反应的反应热:
2C(s)+ 2H2(g) + O2(g) == CH3COOH(l) 【解】 分析各方程式的关系,知将方程式按
2[⑵+⑶]-⑴组合得上述反应方程式
即:△H=2[△H2 +△H3]-△H1
△H =2[(-393.5kJ·mol-1)+(-285.8kJ·mol-1)]
-(-870.3kJ·mol-1)
= -488.3kJ·mol-1
答:反应2C(s)+2H2(g)+ O2(g)== CH3COOH(l)
反应热为-488.3kJ·mol-1
3.根据键能计算
△H=反应物键能总和-生成物键能总和已知:N2(g)+ 2O2(g) = 2NO2(g)
△H = +68kJ·mol-1
N2H4(l)+ O2(g) = N2(g)+ 2H2O(l)
△H = -622kJ·mol-1
火箭发射时用肼N2H4(l)作燃料,NO2作氧化剂,反应生成N2和H2O(l),写出该反应的热化学方程式。练习1 N2H4(l) + NO2(g)= 3/2 N2(g)+2H2O(l)
△H =-622kJ·mol-1 –(68kJ·mol-1)/2
=-656kJ·mol-1将焦炭转化为水煤气的主要反应为:
C (s) + H2O(g) = CO(g) + H2(g)
已知:
C (s) + O2(g) = CO2(g) △H1=-393.5kJ·mol-1
H2(g) + ? O2(g) = H2O(g) △H2=-242.0kJ·mol-1
CO(g) + ? O2(g) = CO2(g) △H3=-283.0kJ·mol-1
写出制取水煤气的热化学方程式.练习2 C(s)+H2O(g)=CO(g)+H2(g) △H=131.5kJ·mol-1同学们,再见!
