选修4 1.2 电能转化为化学能—电解 课件 (2)
文档属性
| 名称 | 选修4 1.2 电能转化为化学能—电解 课件 (2) |

|
|
| 格式 | zip | ||
| 文件大小 | 106.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-09 22:49:04 | ||
图片预览





文档简介
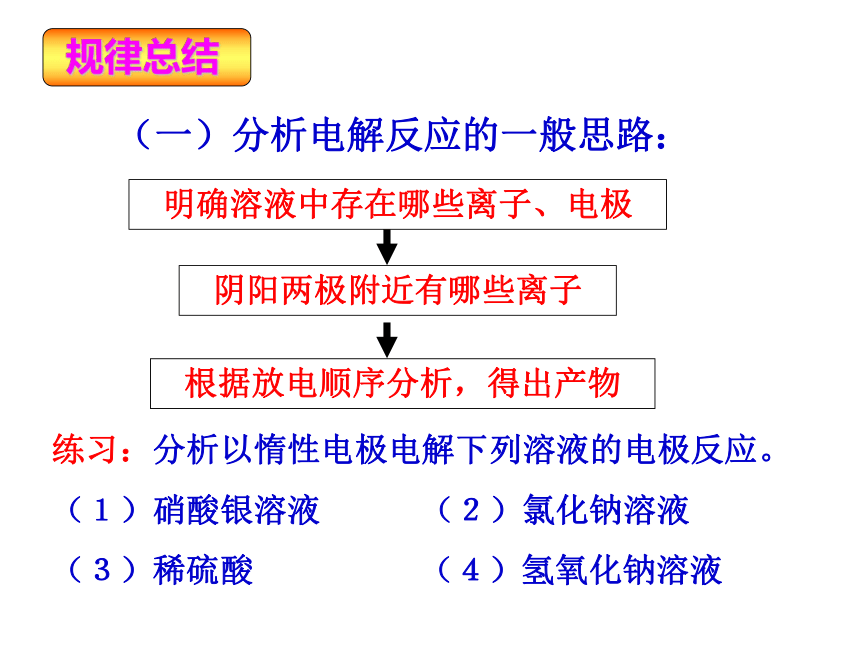
课件18张PPT。(鲁科版)化学反应原理(选修)第一章 化学反应与能量转化电能转化为化学能—电解第二、三课时第二节(一)分析电解反应的一般思路:明确溶液中存在哪些离子、电极阴阳两极附近有哪些离子根据放电顺序分析,得出产物练习:分析以惰性电极电解下列溶液的电极反应。
(1)硝酸银溶液 (2)氯化钠溶液
(3)稀硫酸 (4)氢氧化钠溶液电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,实质上是电解水。如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为:电解液复原:电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。(二)、惰性电极电解电解质溶液的规律1、本质是电解水型:电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液时,实质上是电解质本身被电解。如电解盐酸、CuCl2溶液等时电解液复原:电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)电解盐酸2、本质是电解电解质本身(二)、惰性电极电解电解质溶液的规律电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶等。电解液复原:电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。电解CuSO4溶液3、放氧生酸型(二)、惰性电极电解电解质溶液的规律电解活泼金属的无氧酸盐溶液时,电解质和水
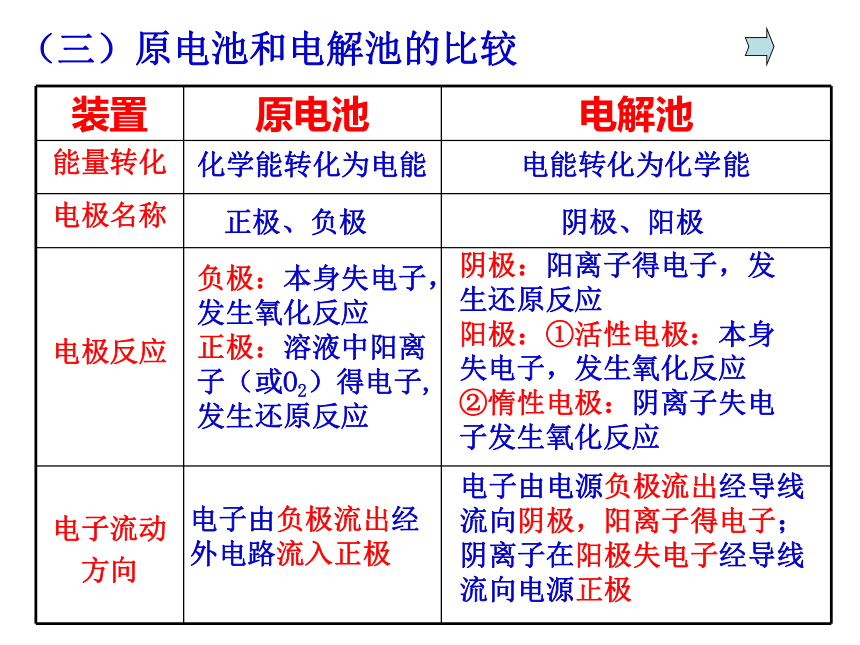
都有一部分被电解,如电解NaCl溶液等。电解液复原:电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl。4、放氢生碱型(二)、惰性电极电解电解质溶液的规律电解NaCl溶液(三)原电池和电解池的比较化学能转化为电能电能转化为化学能正极、负极阴极、阳极负极:本身失电子,发生氧化反应
正极:溶液中阳离子(或O2)得电子,发生还原反应阴极:阳离子得电子,发生还原反应
阳极:①活性电极:本身失电子,发生氧化反应
②惰性电极:阴离子失电子发生氧化反应电子由负极流出经外电路流入正极电子由电源负极流出经导线流向阴极,阳离子得电子;阴离子在阳极失电子经导线流向电源正极1、以石墨作电极分别电解下列溶液,在阴极不能得到氢气的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH2、以石墨作电极分别电解下列溶液,电解质和水的量都发生变化的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH3、以石墨作电极电解水时,溶液pH值变大的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH练习BB CC D4、串联电解熔融KCl、MgCl2、Al2O3一段时间后,析出K、Mg、Al的物质的量之是 。5、c作为笔在左边纸上写字,
字迹变蓝,则b是——极,
c上发生的反应为:
——————————,
d的总化学反应方程式为:
————————————。6:3:2正2I--2e- →I2作业:P18 第一题(不一定列表格)二、电解原理的重要应用阳极:放出有刺激性气味的气体阴极:放出无色无味的气体1、电解饱和食盐水电极反应方程式 阴极:2H+ + 2e-→ H2↑阳极:2Cl-- 2e-→ Cl2↑注意:阴极区pH值升高,酚酞变红(阴极与负极相连)+-纯铜粗铜 电解液
(CuSO4溶液)阴极:Cu2+ + 2e-→ Cu
(还原反应)
阳极:Cu - 2e-→ Cu2+
(氧化反应)特征纯铜作阴极,粗铜作阳极
阳极主要金属与电解质中的阳离子相同
电解液CuSO4的浓度略变小,有杂质离子
Zn2+、Fe2+、Ni2+
杂质Zn、Fe、Ni、Ag、Au如何除去?2、铜的电解精炼阳极还包含Zn、Fe、Ni失电子,且比Cu先失电子+-铁片铜片 电镀液
(CuSO4溶液)阴极:Cu2+ + 2e- → Cu (还原反应)
阳极:Cu - 2e- → Cu2+ (氧化反应)特征镀件作阴极,镀层金属作阳极
阳极金属与电解质溶液中的阳离子相同
电镀液CuSO4的浓度基本不变3、电镀电镀的定义:P16电镀的意义:P16(1)电镀铜+-铁片锌片 电镀液
(ZnCl2溶液)说明:因Zn2+离子浓度远大于H+离子浓度
[Zn2+]?[H+],则Zn2+放电(2)电镀锌阴极:Zn2+ + 2e- → Zn (还原反应)
阳极:Zn -2e-→ Zn2+ (氧化反应)原电池、电解池、电镀池判定规律若无外接电源, 可能是原电池,然后依据原电池的形成条件分析判定,主要思路是“三看”
先看电极:两极为导体且活泼性不同
再看溶液:两极插入电解质溶液中
后看回路:形成闭合回路或两极接触
若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同,则为电镀池,其余情况为电解池。练习1:在50mL 0.2mol/L的硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发),则:
⑴若两极均为铜片,试说明电解过程中溶液溶质浓度将怎样变化?
⑵若阳极为纯锌,阴极为铜片,阳极反应式是
。
⑶如果两极均为铜片且不考虑H+在阴极上放电当电路中有0.01mol电子通过时,阴极增重 g,阴极上的电极反应式是 。不变0.32Zn → Zn2+ +2e-Cu2+ +2e-→Cu练习2:下列叙述不正确的是( )
A.电解饱和食盐水时,用铁作阳极,Cl-发生
氧化反应 B.电解法精炼铜时,纯铜作阴极,Cu2+发生
还原反应 C.电镀铜时,金属铜作阳极,电镀液可用硫酸
铜溶液 D.铜锌原电池中,锌作负极,电子从锌极流向
铜极 A练习3:某同学按右图所示的装置进行电解实验。下列说法正确的是( ) A、电解过程中,铜电极上有H2产生 B、电解初期,主反应方程式为:
Cu+H2SO4 ????CuSO4+H2↑ C、电解一定时间后,石墨电极上有铜析出 D、整个电解过程中,H+的浓度不断增大
??????????????????????? B C作业:P18 第2、3题
(1)硝酸银溶液 (2)氯化钠溶液
(3)稀硫酸 (4)氢氧化钠溶液电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,实质上是电解水。如电解H2SO4、HNO3、NaOH、Na2SO4等溶液时其电极反应式为:电解液复原:电解后溶液中溶质的质量分数增大,若要恢复原来的浓度,只需加入一定量的水即可。(二)、惰性电极电解电解质溶液的规律1、本质是电解水型:电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液时,实质上是电解质本身被电解。如电解盐酸、CuCl2溶液等时电解液复原:电解后溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量的溶质(通入一定量的HCl气体)电解盐酸2、本质是电解电解质本身(二)、惰性电极电解电解质溶液的规律电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶等。电解液复原:电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。电解CuSO4溶液3、放氧生酸型(二)、惰性电极电解电解质溶液的规律电解活泼金属的无氧酸盐溶液时,电解质和水
都有一部分被电解,如电解NaCl溶液等。电解液复原:电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl。4、放氢生碱型(二)、惰性电极电解电解质溶液的规律电解NaCl溶液(三)原电池和电解池的比较化学能转化为电能电能转化为化学能正极、负极阴极、阳极负极:本身失电子,发生氧化反应
正极:溶液中阳离子(或O2)得电子,发生还原反应阴极:阳离子得电子,发生还原反应
阳极:①活性电极:本身失电子,发生氧化反应
②惰性电极:阴离子失电子发生氧化反应电子由负极流出经外电路流入正极电子由电源负极流出经导线流向阴极,阳离子得电子;阴离子在阳极失电子经导线流向电源正极1、以石墨作电极分别电解下列溶液,在阴极不能得到氢气的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH2、以石墨作电极分别电解下列溶液,电解质和水的量都发生变化的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH3、以石墨作电极电解水时,溶液pH值变大的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOH练习BB CC D4、串联电解熔融KCl、MgCl2、Al2O3一段时间后,析出K、Mg、Al的物质的量之是 。5、c作为笔在左边纸上写字,
字迹变蓝,则b是——极,
c上发生的反应为:
——————————,
d的总化学反应方程式为:
————————————。6:3:2正2I--2e- →I2作业:P18 第一题(不一定列表格)二、电解原理的重要应用阳极:放出有刺激性气味的气体阴极:放出无色无味的气体1、电解饱和食盐水电极反应方程式 阴极:2H+ + 2e-→ H2↑阳极:2Cl-- 2e-→ Cl2↑注意:阴极区pH值升高,酚酞变红(阴极与负极相连)+-纯铜粗铜 电解液
(CuSO4溶液)阴极:Cu2+ + 2e-→ Cu
(还原反应)
阳极:Cu - 2e-→ Cu2+
(氧化反应)特征纯铜作阴极,粗铜作阳极
阳极主要金属与电解质中的阳离子相同
电解液CuSO4的浓度略变小,有杂质离子
Zn2+、Fe2+、Ni2+
杂质Zn、Fe、Ni、Ag、Au如何除去?2、铜的电解精炼阳极还包含Zn、Fe、Ni失电子,且比Cu先失电子+-铁片铜片 电镀液
(CuSO4溶液)阴极:Cu2+ + 2e- → Cu (还原反应)
阳极:Cu - 2e- → Cu2+ (氧化反应)特征镀件作阴极,镀层金属作阳极
阳极金属与电解质溶液中的阳离子相同
电镀液CuSO4的浓度基本不变3、电镀电镀的定义:P16电镀的意义:P16(1)电镀铜+-铁片锌片 电镀液
(ZnCl2溶液)说明:因Zn2+离子浓度远大于H+离子浓度
[Zn2+]?[H+],则Zn2+放电(2)电镀锌阴极:Zn2+ + 2e- → Zn (还原反应)
阳极:Zn -2e-→ Zn2+ (氧化反应)原电池、电解池、电镀池判定规律若无外接电源, 可能是原电池,然后依据原电池的形成条件分析判定,主要思路是“三看”
先看电极:两极为导体且活泼性不同
再看溶液:两极插入电解质溶液中
后看回路:形成闭合回路或两极接触
若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同,则为电镀池,其余情况为电解池。练习1:在50mL 0.2mol/L的硫酸铜溶液中插入两个电极,通电电解(不考虑水分蒸发),则:
⑴若两极均为铜片,试说明电解过程中溶液溶质浓度将怎样变化?
⑵若阳极为纯锌,阴极为铜片,阳极反应式是
。
⑶如果两极均为铜片且不考虑H+在阴极上放电当电路中有0.01mol电子通过时,阴极增重 g,阴极上的电极反应式是 。不变0.32Zn → Zn2+ +2e-Cu2+ +2e-→Cu练习2:下列叙述不正确的是( )
A.电解饱和食盐水时,用铁作阳极,Cl-发生
氧化反应 B.电解法精炼铜时,纯铜作阴极,Cu2+发生
还原反应 C.电镀铜时,金属铜作阳极,电镀液可用硫酸
铜溶液 D.铜锌原电池中,锌作负极,电子从锌极流向
铜极 A练习3:某同学按右图所示的装置进行电解实验。下列说法正确的是( ) A、电解过程中,铜电极上有H2产生 B、电解初期,主反应方程式为:
Cu+H2SO4 ????CuSO4+H2↑ C、电解一定时间后,石墨电极上有铜析出 D、整个电解过程中,H+的浓度不断增大
??????????????????????? B C作业:P18 第2、3题
