选修4 1.2 电能转化为化学能—电解 课件
文档属性
| 名称 | 选修4 1.2 电能转化为化学能—电解 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 168.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-09 22:49:33 | ||
图片预览




文档简介
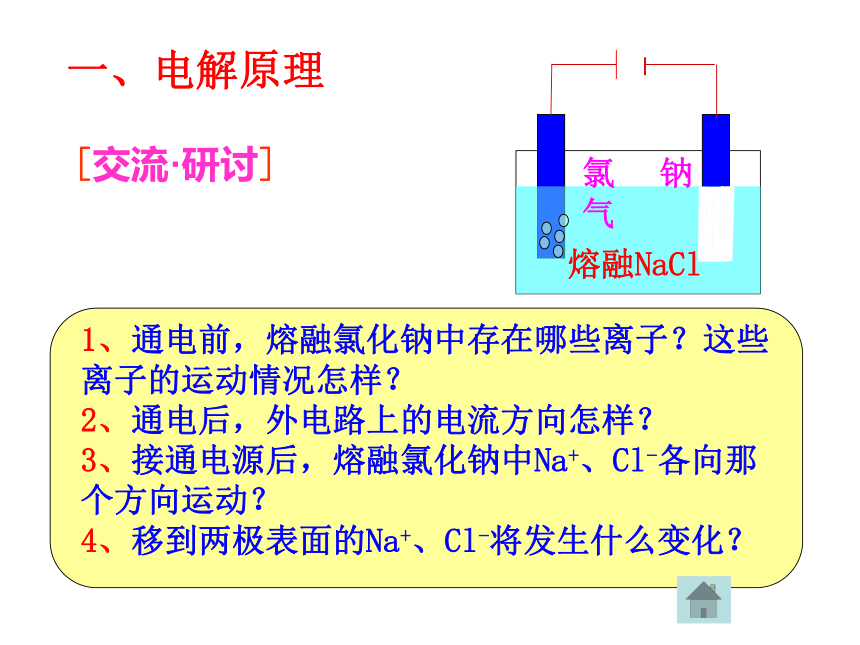
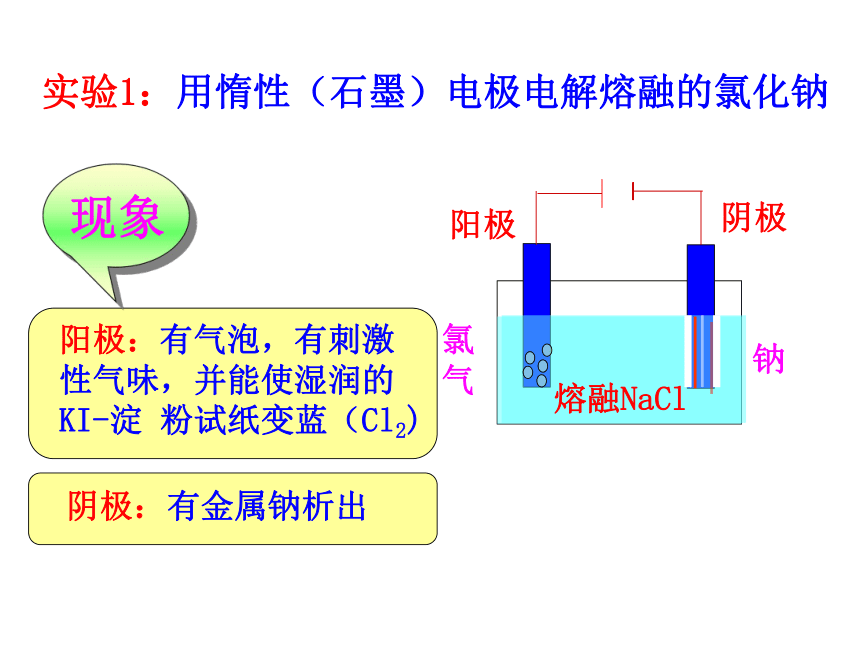
课件19张PPT。(鲁科版)化学反应原理(选修)第一章 化学反应与能量转化电能转化为化学能—电解第一课时第二节一、电解原理[交流·研讨]熔融NaCl 实验1:用惰性(石墨)电极电解熔融的氯化钠阴极阳极氯
气钠熔融NaCl 【实验分析】通电前:分析熔融电解质中的离子情况通电后:(必须直流电)Na+移向与电源负极相连的电极,得到电子变成Na,发生还原反应。
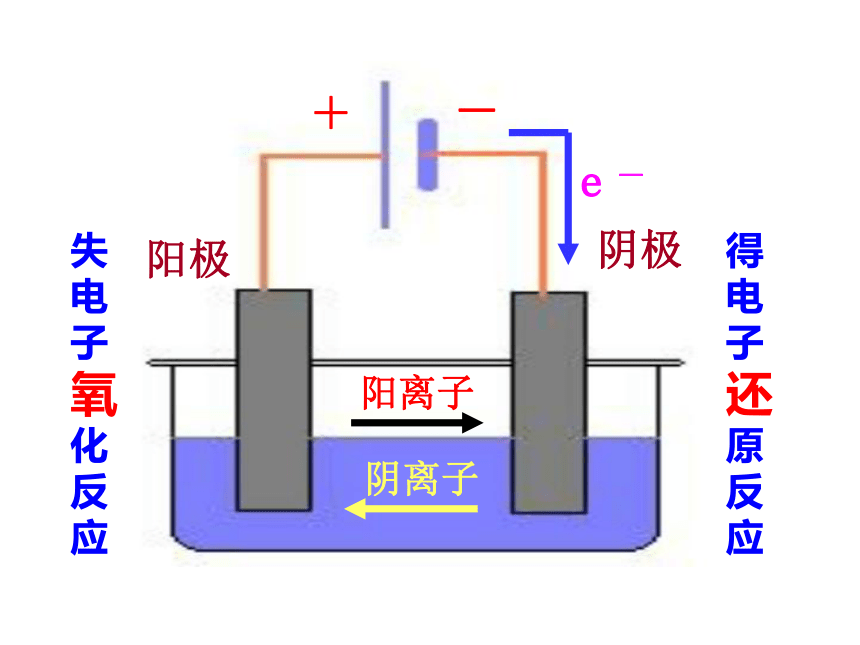
Cl-移向与电源正极相连的电极,失去电子变成Cl,发生氧化反应。电解: 使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程。电解池:借助氧化还原反应,把电能转化为化学能的装置.一、电解1、定义阳极:与电源正极相连,阴离子移向此极,失去
电子,发生氧化反应阴极:与电源负极相连,阳离子移向此极,得到
电子,发生还原反应说明:1、惰性电极:用石墨、金、铂等材料做的电极,
一般通电条件下不发生反应;
2、活性电极:用铁、锌、铜等还原性较强金属做的
电极,活性电极作阳极时,优先发生氧化反应。+-阴极 阳极得电子还原反应失电子氧化反应2、构成条件(1)外加直流电源(2)与电源相连的两个电极(3)电解质溶液或熔化的电解质(4)用导线连接形成闭合回路 分析下图,属于电解池的有③⑥【巩固练习】(2)电极产物的判断,电极反应的书写阳极:2Cl- - 2e-→Cl2↑ 氧化反应
阴极:2Na+ + 2e-→2Na 还原反应电极反应:电极上进行的半反应。注意:书写电极反应式一定要遵守电子守恒实验2:用惰性(石墨)电极电解氯化铜溶液阴极阳极氯
气铜CuCl2溶液实验:用惰性(石墨)电极电解氯化铜溶液【实验分析】通电前:分析氯化铜溶液中的离子情况 通电后:(必须直流电)Cu2+ 、H+移向阴极, Cu2+得到电子变成Cu,发生还原反应。
Cl- 、OH-移向阳极, Cl-失去电子变成Cl2,发生氧化反应。电极反应式:阳极:2Cl- -2e-→Cl2↑ 氧化反应
阴极:Cu2+ +2e-→Cu 还原反应 CuCl2 Cu+Cl2↑总反应式:思考:如何才能正确判断出阴阳两极的电极产物?了解阴、阳离子得、失电子能力的相对强弱3、离子的放电顺序得e能力依次增强失e 能力依次减弱阳极阴极NaCl溶液[趁热打铁]自我小结:1、学习了电解原理、电解池、阴极、阳极、电极反应等基本概念。
2、学习了电极反应的书写方法和离子的放电顺序以及电极产物的判断方法。
1.下列说法正确的是( )
①电解是把电能转变成化学能;
②电解是化学能转变成电能;
③电解质溶液导电是化学变化;
④任何电解过程,必将导致氧化还原反应的发生. 【随堂练习】2.以石墨作电极分别电解下列溶液,在阴极不能得到氢气的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOHB3.电解熔融的氧化铝可制得金属铝.试写出
电极反应和总的反应方程式。提示:氧化铝在熔融状态下以O2-和Al3+的形式存在同学们,再见!
气钠熔融NaCl 【实验分析】通电前:分析熔融电解质中的离子情况通电后:(必须直流电)Na+移向与电源负极相连的电极,得到电子变成Na,发生还原反应。
Cl-移向与电源正极相连的电极,失去电子变成Cl,发生氧化反应。电解: 使电流通过电解质溶液而在阴阳两极引起氧化还原反应的过程。电解池:借助氧化还原反应,把电能转化为化学能的装置.一、电解1、定义阳极:与电源正极相连,阴离子移向此极,失去
电子,发生氧化反应阴极:与电源负极相连,阳离子移向此极,得到
电子,发生还原反应说明:1、惰性电极:用石墨、金、铂等材料做的电极,
一般通电条件下不发生反应;
2、活性电极:用铁、锌、铜等还原性较强金属做的
电极,活性电极作阳极时,优先发生氧化反应。+-阴极 阳极得电子还原反应失电子氧化反应2、构成条件(1)外加直流电源(2)与电源相连的两个电极(3)电解质溶液或熔化的电解质(4)用导线连接形成闭合回路 分析下图,属于电解池的有③⑥【巩固练习】(2)电极产物的判断,电极反应的书写阳极:2Cl- - 2e-→Cl2↑ 氧化反应
阴极:2Na+ + 2e-→2Na 还原反应电极反应:电极上进行的半反应。注意:书写电极反应式一定要遵守电子守恒实验2:用惰性(石墨)电极电解氯化铜溶液阴极阳极氯
气铜CuCl2溶液实验:用惰性(石墨)电极电解氯化铜溶液【实验分析】通电前:分析氯化铜溶液中的离子情况 通电后:(必须直流电)Cu2+ 、H+移向阴极, Cu2+得到电子变成Cu,发生还原反应。
Cl- 、OH-移向阳极, Cl-失去电子变成Cl2,发生氧化反应。电极反应式:阳极:2Cl- -2e-→Cl2↑ 氧化反应
阴极:Cu2+ +2e-→Cu 还原反应 CuCl2 Cu+Cl2↑总反应式:思考:如何才能正确判断出阴阳两极的电极产物?了解阴、阳离子得、失电子能力的相对强弱3、离子的放电顺序得e能力依次增强失e 能力依次减弱阳极阴极NaCl溶液[趁热打铁]自我小结:1、学习了电解原理、电解池、阴极、阳极、电极反应等基本概念。
2、学习了电极反应的书写方法和离子的放电顺序以及电极产物的判断方法。
1.下列说法正确的是( )
①电解是把电能转变成化学能;
②电解是化学能转变成电能;
③电解质溶液导电是化学变化;
④任何电解过程,必将导致氧化还原反应的发生. 【随堂练习】2.以石墨作电极分别电解下列溶液,在阴极不能得到氢气的是( )
A. Na2SO4 B. AgNO3 C. NaCl D. NaOHB3.电解熔融的氧化铝可制得金属铝.试写出
电极反应和总的反应方程式。提示:氧化铝在熔融状态下以O2-和Al3+的形式存在同学们,再见!
