选修4 1.3 化学能转化为电能—电池 课件
文档属性
| 名称 | 选修4 1.3 化学能转化为电能—电池 课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-09 22:50:20 | ||
图片预览




文档简介
课件43张PPT。(鲁科版)化学反应原理(选修)第一章 化学反应与能量转化化学能转化为电能—原电池第三节1、了解原电池的工作原理,能判断原电池的正负极,能写出电极反应式。
2、通过实验与分析,初步掌握形成原电池的基本条件。
3、学习实验研究的方法,能设计并完成一些基本的化学实验。1、原电池 的装置。 原电池反应的本质是发生 反应。 2、原电池的构成条件: 3、原电池正、负极规律 ①负极——电子 的极。通常是活泼性 的金属,发生 反应 ②正极——电子 的极。通常是活泼性 的金属或非金属导体,发生 反应流出较强氧化流入较弱还原①有两种活泼性不同的金属(或其中一种为非金属导体)
②电解质溶液
③构成闭合回路
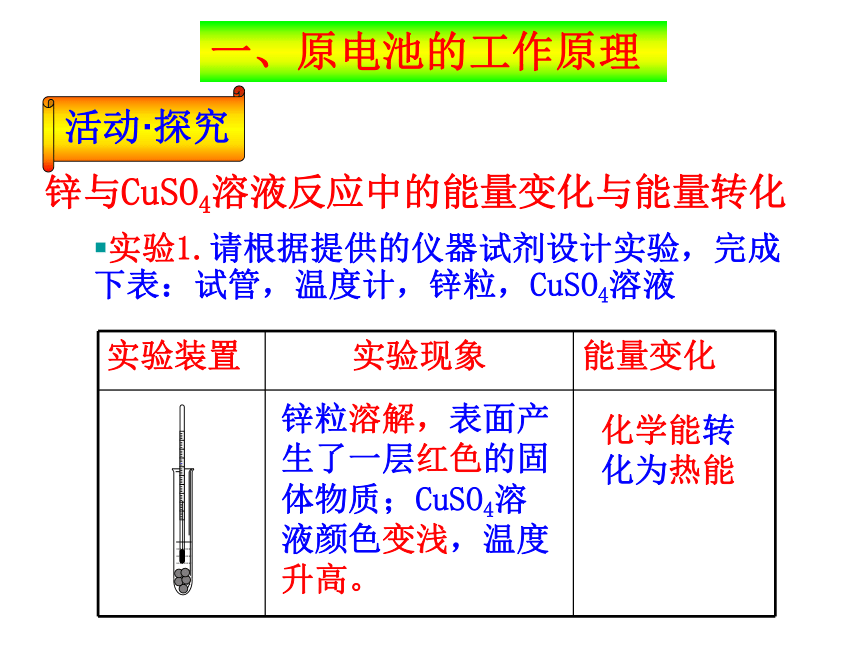
④能自发地发生氧化还原反应将化学能转变为电能氧化还原回顾旧知锌与CuSO4溶液反应中的能量变化与能量转化锌粒溶解,表面产生了一层红色的固体物质;CuSO4溶液颜色变浅,温度升高。化学能转化为热能实验1.请根据提供的仪器试剂设计实验,完成下表:试管,温度计,锌粒,CuSO4溶液一、原电池的工作原理实验2.如果锌与溶液的反应是放热反应,请设计实验将该反应所释放的能量转化为电能并实施你所设计的实验。
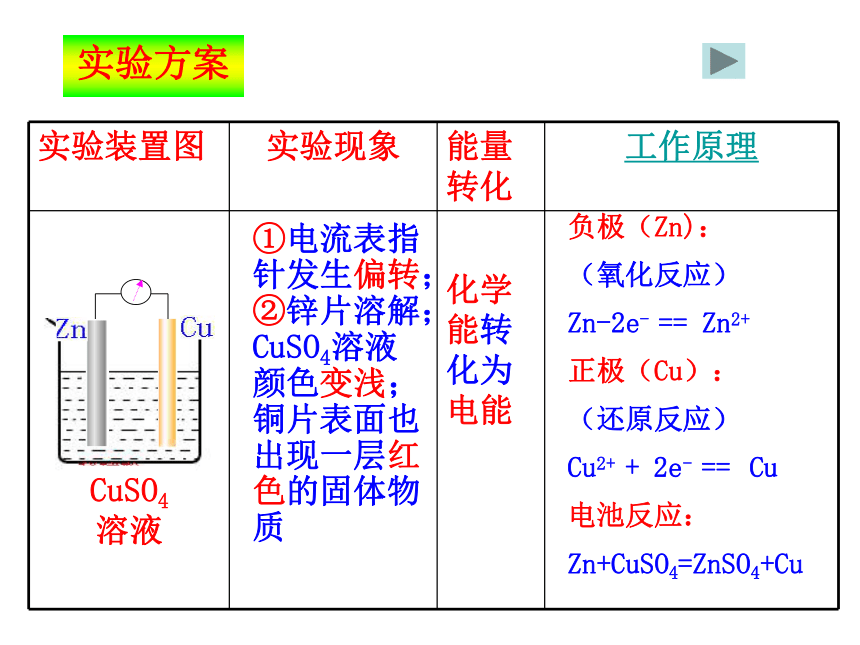
试剂和仪器:CuSO4溶液,锌片,铜片,检流计,导线,大烧杯。锌与CuSO4溶液反应中的能量变化与能量转化实验方案①电流表指针发生偏转;②锌片溶解;CuSO4溶液颜色变浅;铜片表面也出现一层红色的固体物质化学能转化为电能负极(Zn):
(氧化反应)
Zn-2e- == Zn2+
正极(Cu):
(还原反应)
Cu2+ + 2e- == Cu
电池反应:
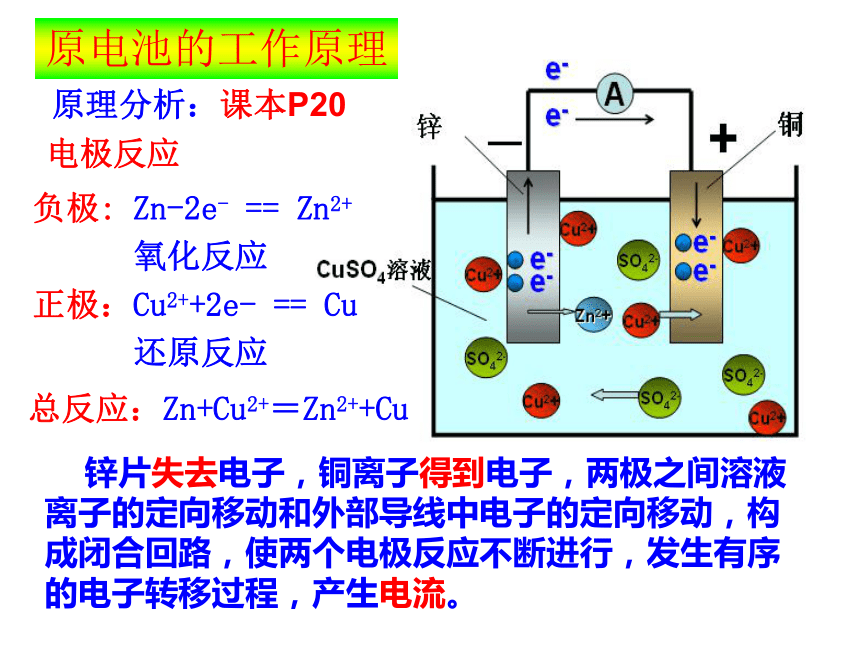
Zn+CuSO4=ZnSO4+Cu返回原电池的工作原理原理分析:课本P20负极: Zn-2e- == Zn2+
氧化反应
正极:Cu2++2e- == Cu
还原反应电极反应 锌片失去电子,铜离子得到电子,两极之间溶液离子的定向移动和外部导线中电子的定向移动,构成闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流。总反应:Zn+Cu2+=Zn2++Cu
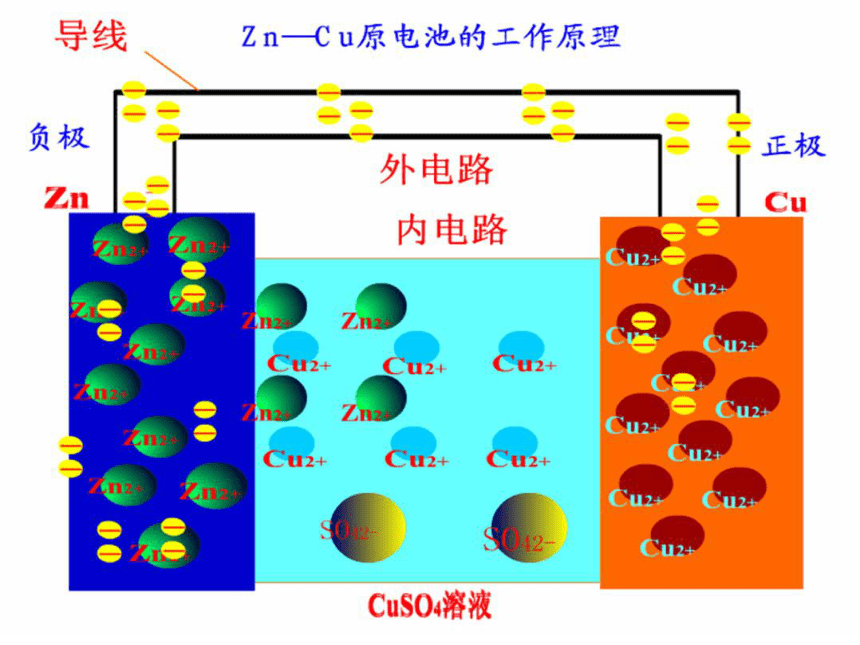
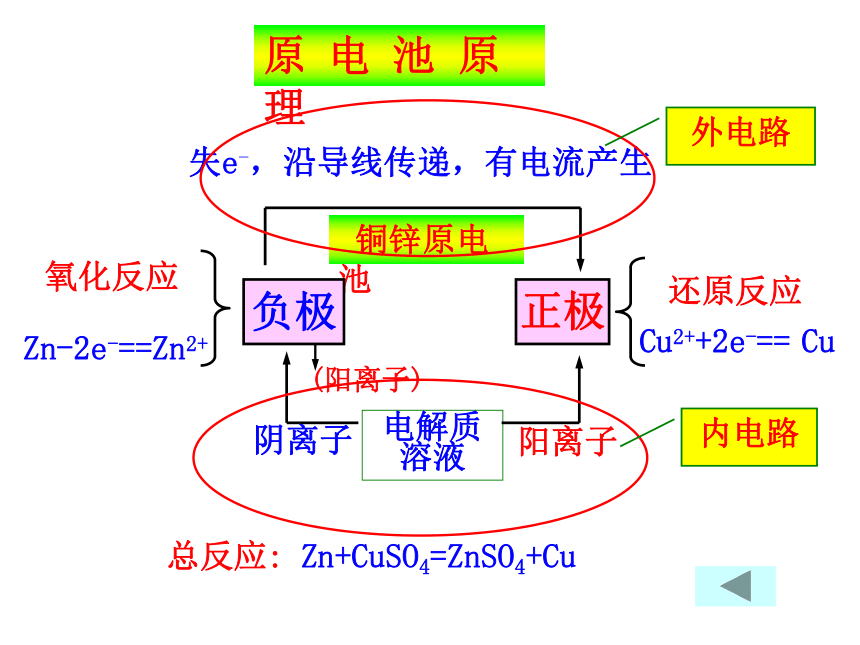
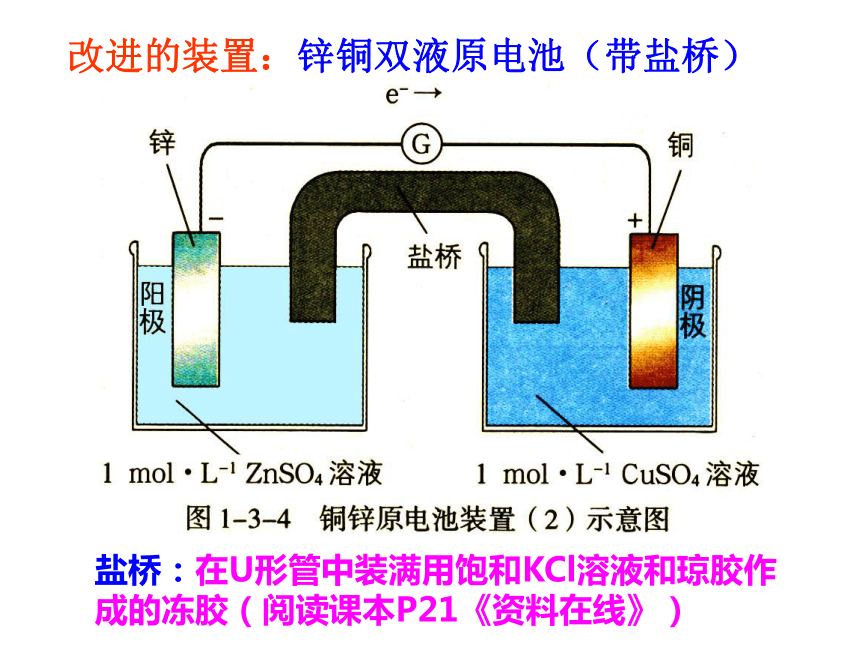
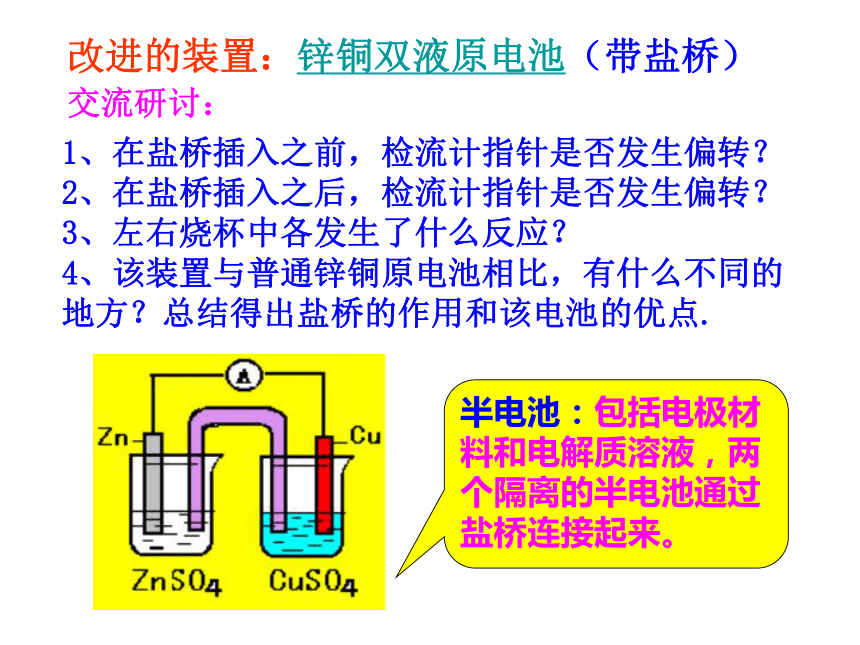
氧化反应Zn-2e-==Zn2+ 铜锌原电池电解质溶液失e-,沿导线传递,有电流产生还原反应Cu2++2e-== Cu阴离子阳离子负极正极 (阳离子)原 电 池 原 理外电路内电路总反应: Zn+CuSO4=ZnSO4+Cu盐桥:在U形管中装满用饱和KCl溶液和琼胶作成的冻胶(阅读课本P21《资料在线》)改进的装置:锌铜双液原电池(带盐桥)交流研讨:1、在盐桥插入之前,检流计指针是否发生偏转?
2、在盐桥插入之后,检流计指针是否发生偏转?
3、左右烧杯中各发生了什么反应?
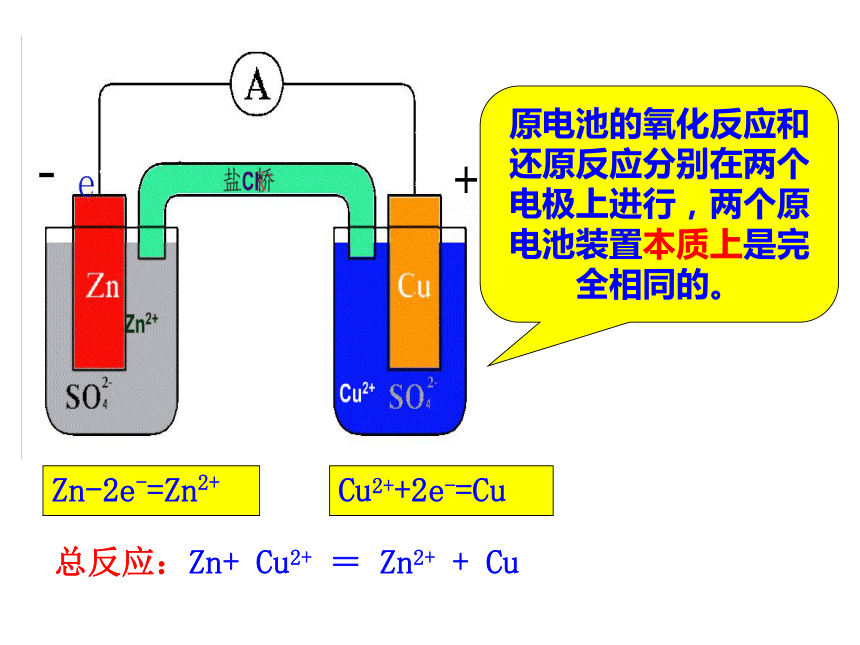
4、该装置与普通锌铜原电池相比,有什么不同的地方?总结得出盐桥的作用和该电池的优点.改进的装置:锌铜双液原电池(带盐桥)Zn-2e-=Zn2+Cu2++2e-=Cu总反应:Zn+ Cu2+ = Zn2+ + Cu原电池的氧化反应和还原反应分别在两个电极上进行,两个原电池装置本质上是完全相同的。此电池的优点:
1.能产生持续、稳定的电流。
2.电极分离,避免其他反应的发生;能量更多的转化为电能.盐桥的作用:
使Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极,使电流持续传导。阅读:课本P22第一段1.电池反应:原电池的两个电极反应组成电池的总反应,这个总反应叫做电池反应2.原电池的表示式(课本P22资料在线)要点强调(《导学》P16-17)要点强调(《导学》P16-17)要点强调(《导学》P16-17)要点强调(《导学》P16-17)要点强调(《导学》P16-17)要点强调(《导学》P16-17)练习1 为获得较长时间的稳定电流,如何将由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装? 请将氧化还原反应 Zn + Cu2+ = Cu + Zn2+设计成一个原电池。Zn比Zn不活泼的金属或石墨 CuSO4 、CuCl2等负极:
正极:
电解质溶液:练习2先拆分成两个半反应
负极:氧化反应 Zn – 2e- = Zn2+
正极:还原反应 Cu2+ + 2e- = Cu请将右式所表示的氧化还原反应设计成一个原电池:Fe +Cu2+ ==Cu +Fe2+
画出装置图,标出电极材料,指出正负极,
注明外电路中电子的流向,写出两个电极上的电极反应。练习3写出下列原电池装置中的电极反应和电池反应。FeCAg练习4太阳能电池手机电池二、化学电源(3)燃料电池 一般以天然燃料或其它可燃物质如氢气、甲醇、天然气、煤气等作为负极的反应物质,以氧气作为正极反应物质组成燃料电池。化学电源分类(2)二次电池 二次电池在放电后经充电可使电池中的活性物质恢复工作能力。铅蓄电池和可充电电池都是二次电池。(1)一次电池 电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用,如干电池。1. 锌锰干电池电极反应方程式:负极:正极:Zn – 2e- = Zn2+2MnO2+2NH4++2e-
= Mn2O3+2NH3↑+H2O反应总的方程式2MnO2+2NH4++ Zn= Mn2O3+2NH3↑+H2O+Zn2+(1)酸性锌锰干电池1. 锌锰干电池电极反应方程式:负极:正极:Zn+2OH-–2e-= ZnO+H2OMnO2+2H2O +2e-
= Mn(OH)2+2OH-反应总的方程式Zn + MnO2+ H2O= ZnO + Mn(OH)2(2)碱性锌锰干电池2、铅蓄电池正极材料上涂有棕褐色的PbO2,
负极材料是海绵状的金属铅,
电解质溶液为30%的
H2SO4溶液。电极反应式铅蓄电池是二次电池,能放电又能充电。
放电是原电池原理; 充电是电解原理充电时是电解池,铅蓄电池的正极连接外接电源的正极作为电解池的阳极,铅蓄电池的负极连接外接电源的负极作为电解池的阴极,其电极反应式为:
阳极:PbSO4+2H2O-2e-==PbO2+4H++SO42-
阴极:PbSO4+2e-==Pb+SO42-3.氢氧燃料电池【交流·研讨】图1-3-10为一种氢氧燃料电池结构示意图,电解质溶液为KOH溶液,电极材料为多孔石墨,氢气和氧气(或空气)源源不断地通到电极上。请你写出该电池的电极反应和电池反应。原理:工作时发生的仍然是氧化还原反应
特点:工作时氧化剂和还原剂是从外界不断输入的,同时将电极产物不断排出电池。
燃料电池是名副其实的把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”。能量转换率很高。负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-电池反应为:2H2+O2=2H2O 燃料电池优点:能量利用效率高、可连续使用和污染轻等优点碱性氢氧燃料电池的电极反应酸性氢氧燃料电池的电极反应负极:2H2-4e-=4H+
正极:O2+4H++4e-=2H2O阅读:课本P25倒数第二段和《导学》P17三、金属的腐蚀与防护金属腐蚀:金属表面与周围的物质发生化学反应或因电化学作用而遭到破坏,称为金属腐蚀。金属腐蚀的类型:金属腐蚀的本质:M - ne- = Mn+1.金属电化学腐蚀的原理联想.质疑 铁生锈的现象随处可见。你有没有想过,为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?为什么当一块铜板上有铁铆钉时,铁铆钉特别容易生锈?负极:(Fe)正极:(Cu)Fe-2e=Fe2+O2+2H2O+4e-=4OH-电解质溶液:空气中的SO2 ,CO2溶于水膜中电池总反应:2Fe+2H2O+O2= 2 Fe(OH)2CuCu后续反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3(Fe2O3 · nH2O)1.金属电化学腐蚀的原理钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图思考:你能写出它们的电极反应式吗?1.金属电化学腐蚀的原理钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O1.金属电化学腐蚀的原理思考:根据金属腐蚀的原理,你能想出什么防止金属腐蚀的方法?(1)覆盖保护层衣架和电线的外面包上一层塑料层某些工具的“机械转动部位”选用油脂来防锈。自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr2.金属的防护思考:针对金属的电化学腐蚀,你能想出什么防止其腐蚀的办法?(2)牺牲阳极的阴极保护法原理:形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应充当阳极,受到腐蚀。航海船只的船底四周镶嵌锌块,就是利用牺牲阳极保护法来保护船体的。航海的船只的船底四周镶嵌锌块(白色),就是利用牺牲阳极的阴极保护法。2.金属的防护原理:将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。(3)阴极电保护法2.金属的防护1、如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生 腐蚀,电极反应式为:负极: ,
正极: 。 (2)若液面下降,则溶液呈 性,发生 腐蚀,电极反应式为:
负极: ,
正极: 。中性或弱酸 吸氧Fe–2e- = Fe2+O2+2H2O+4e- = 4OH-酸析氢Fe–2e- = Fe2+2H++2e- = H2↑ 练习2.下列各情况,在其中Fe片腐蚀由快到慢的顺序是:
。小结:防腐措施由好到坏的顺序是外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀(5) (2) (1) (3) (4)练习同学们,再见!
2、通过实验与分析,初步掌握形成原电池的基本条件。
3、学习实验研究的方法,能设计并完成一些基本的化学实验。1、原电池 的装置。 原电池反应的本质是发生 反应。 2、原电池的构成条件: 3、原电池正、负极规律 ①负极——电子 的极。通常是活泼性 的金属,发生 反应 ②正极——电子 的极。通常是活泼性 的金属或非金属导体,发生 反应流出较强氧化流入较弱还原①有两种活泼性不同的金属(或其中一种为非金属导体)
②电解质溶液
③构成闭合回路
④能自发地发生氧化还原反应将化学能转变为电能氧化还原回顾旧知锌与CuSO4溶液反应中的能量变化与能量转化锌粒溶解,表面产生了一层红色的固体物质;CuSO4溶液颜色变浅,温度升高。化学能转化为热能实验1.请根据提供的仪器试剂设计实验,完成下表:试管,温度计,锌粒,CuSO4溶液一、原电池的工作原理实验2.如果锌与溶液的反应是放热反应,请设计实验将该反应所释放的能量转化为电能并实施你所设计的实验。
试剂和仪器:CuSO4溶液,锌片,铜片,检流计,导线,大烧杯。锌与CuSO4溶液反应中的能量变化与能量转化实验方案①电流表指针发生偏转;②锌片溶解;CuSO4溶液颜色变浅;铜片表面也出现一层红色的固体物质化学能转化为电能负极(Zn):
(氧化反应)
Zn-2e- == Zn2+
正极(Cu):
(还原反应)
Cu2+ + 2e- == Cu
电池反应:
Zn+CuSO4=ZnSO4+Cu返回原电池的工作原理原理分析:课本P20负极: Zn-2e- == Zn2+
氧化反应
正极:Cu2++2e- == Cu
还原反应电极反应 锌片失去电子,铜离子得到电子,两极之间溶液离子的定向移动和外部导线中电子的定向移动,构成闭合回路,使两个电极反应不断进行,发生有序的电子转移过程,产生电流。总反应:Zn+Cu2+=Zn2++Cu
氧化反应Zn-2e-==Zn2+ 铜锌原电池电解质溶液失e-,沿导线传递,有电流产生还原反应Cu2++2e-== Cu阴离子阳离子负极正极 (阳离子)原 电 池 原 理外电路内电路总反应: Zn+CuSO4=ZnSO4+Cu盐桥:在U形管中装满用饱和KCl溶液和琼胶作成的冻胶(阅读课本P21《资料在线》)改进的装置:锌铜双液原电池(带盐桥)交流研讨:1、在盐桥插入之前,检流计指针是否发生偏转?
2、在盐桥插入之后,检流计指针是否发生偏转?
3、左右烧杯中各发生了什么反应?
4、该装置与普通锌铜原电池相比,有什么不同的地方?总结得出盐桥的作用和该电池的优点.改进的装置:锌铜双液原电池(带盐桥)Zn-2e-=Zn2+Cu2++2e-=Cu总反应:Zn+ Cu2+ = Zn2+ + Cu原电池的氧化反应和还原反应分别在两个电极上进行,两个原电池装置本质上是完全相同的。此电池的优点:
1.能产生持续、稳定的电流。
2.电极分离,避免其他反应的发生;能量更多的转化为电能.盐桥的作用:
使Cl-向锌盐方向移动,K+向铜盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极,使电流持续传导。阅读:课本P22第一段1.电池反应:原电池的两个电极反应组成电池的总反应,这个总反应叫做电池反应2.原电池的表示式(课本P22资料在线)要点强调(《导学》P16-17)要点强调(《导学》P16-17)要点强调(《导学》P16-17)要点强调(《导学》P16-17)要点强调(《导学》P16-17)要点强调(《导学》P16-17)练习1 为获得较长时间的稳定电流,如何将由“Zn-稀H2SO4-Cu”组成的原电池(如左下图)进行简单改装? 请将氧化还原反应 Zn + Cu2+ = Cu + Zn2+设计成一个原电池。Zn比Zn不活泼的金属或石墨 CuSO4 、CuCl2等负极:
正极:
电解质溶液:练习2先拆分成两个半反应
负极:氧化反应 Zn – 2e- = Zn2+
正极:还原反应 Cu2+ + 2e- = Cu请将右式所表示的氧化还原反应设计成一个原电池:Fe +Cu2+ ==Cu +Fe2+
画出装置图,标出电极材料,指出正负极,
注明外电路中电子的流向,写出两个电极上的电极反应。练习3写出下列原电池装置中的电极反应和电池反应。FeCAg练习4太阳能电池手机电池二、化学电源(3)燃料电池 一般以天然燃料或其它可燃物质如氢气、甲醇、天然气、煤气等作为负极的反应物质,以氧气作为正极反应物质组成燃料电池。化学电源分类(2)二次电池 二次电池在放电后经充电可使电池中的活性物质恢复工作能力。铅蓄电池和可充电电池都是二次电池。(1)一次电池 电池中的反应物质进行一次氧化还原反应并放电之后,就不能再次利用,如干电池。1. 锌锰干电池电极反应方程式:负极:正极:Zn – 2e- = Zn2+2MnO2+2NH4++2e-
= Mn2O3+2NH3↑+H2O反应总的方程式2MnO2+2NH4++ Zn= Mn2O3+2NH3↑+H2O+Zn2+(1)酸性锌锰干电池1. 锌锰干电池电极反应方程式:负极:正极:Zn+2OH-–2e-= ZnO+H2OMnO2+2H2O +2e-
= Mn(OH)2+2OH-反应总的方程式Zn + MnO2+ H2O= ZnO + Mn(OH)2(2)碱性锌锰干电池2、铅蓄电池正极材料上涂有棕褐色的PbO2,
负极材料是海绵状的金属铅,
电解质溶液为30%的
H2SO4溶液。电极反应式铅蓄电池是二次电池,能放电又能充电。
放电是原电池原理; 充电是电解原理充电时是电解池,铅蓄电池的正极连接外接电源的正极作为电解池的阳极,铅蓄电池的负极连接外接电源的负极作为电解池的阴极,其电极反应式为:
阳极:PbSO4+2H2O-2e-==PbO2+4H++SO42-
阴极:PbSO4+2e-==Pb+SO42-3.氢氧燃料电池【交流·研讨】图1-3-10为一种氢氧燃料电池结构示意图,电解质溶液为KOH溶液,电极材料为多孔石墨,氢气和氧气(或空气)源源不断地通到电极上。请你写出该电池的电极反应和电池反应。原理:工作时发生的仍然是氧化还原反应
特点:工作时氧化剂和还原剂是从外界不断输入的,同时将电极产物不断排出电池。
燃料电池是名副其实的把能源中燃料燃烧反应的化学能直接转化为电能的“能量转换器”。能量转换率很高。负极:2H2+4OH--4e-=4H2O
正极:O2+2H2O+4e-=4OH-电池反应为:2H2+O2=2H2O 燃料电池优点:能量利用效率高、可连续使用和污染轻等优点碱性氢氧燃料电池的电极反应酸性氢氧燃料电池的电极反应负极:2H2-4e-=4H+
正极:O2+4H++4e-=2H2O阅读:课本P25倒数第二段和《导学》P17三、金属的腐蚀与防护金属腐蚀:金属表面与周围的物质发生化学反应或因电化学作用而遭到破坏,称为金属腐蚀。金属腐蚀的类型:金属腐蚀的本质:M - ne- = Mn+1.金属电化学腐蚀的原理联想.质疑 铁生锈的现象随处可见。你有没有想过,为什么铁在潮湿的环境中比在干燥的环境中更容易生锈?为什么当一块铜板上有铁铆钉时,铁铆钉特别容易生锈?负极:(Fe)正极:(Cu)Fe-2e=Fe2+O2+2H2O+4e-=4OH-电解质溶液:空气中的SO2 ,CO2溶于水膜中电池总反应:2Fe+2H2O+O2= 2 Fe(OH)2CuCu后续反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3(Fe2O3 · nH2O)1.金属电化学腐蚀的原理钢铁的析氢腐蚀示意图钢铁的吸氧腐蚀示意图思考:你能写出它们的电极反应式吗?1.金属电化学腐蚀的原理钢铁的析氢腐蚀和吸氧腐蚀比较Fe2O3 · nH2O1.金属电化学腐蚀的原理思考:根据金属腐蚀的原理,你能想出什么防止金属腐蚀的方法?(1)覆盖保护层衣架和电线的外面包上一层塑料层某些工具的“机械转动部位”选用油脂来防锈。自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr2.金属的防护思考:针对金属的电化学腐蚀,你能想出什么防止其腐蚀的办法?(2)牺牲阳极的阴极保护法原理:形成原电池反应时,让被保护金属做正极,不反应,起到保护作用;而活泼金属反应充当阳极,受到腐蚀。航海船只的船底四周镶嵌锌块,就是利用牺牲阳极保护法来保护船体的。航海的船只的船底四周镶嵌锌块(白色),就是利用牺牲阳极的阴极保护法。2.金属的防护原理:将被保护金属与另一附加电极作为电解池的两个极,使被保护的金属作为阴极,在外加直流电的作用下使阴极得到保护。此法主要用于防止土壤、海水及水中金属设备的腐蚀。(3)阴极电保护法2.金属的防护1、如图, 水槽中试管内有一枚铁钉,放置数天观察:(1)若液面上升,则溶液呈 性,发生 腐蚀,电极反应式为:负极: ,
正极: 。 (2)若液面下降,则溶液呈 性,发生 腐蚀,电极反应式为:
负极: ,
正极: 。中性或弱酸 吸氧Fe–2e- = Fe2+O2+2H2O+4e- = 4OH-酸析氢Fe–2e- = Fe2+2H++2e- = H2↑ 练习2.下列各情况,在其中Fe片腐蚀由快到慢的顺序是:
。小结:防腐措施由好到坏的顺序是外接电源的阴极保护法>牺牲阳极的阴极保护法>有一般防腐条件的腐蚀>无防腐条件的腐蚀(5) (2) (1) (3) (4)练习同学们,再见!
