人教版高中化学选修一第三章第二节金属的腐蚀和防护 (共23张PPT)
文档属性
| 名称 | 人教版高中化学选修一第三章第二节金属的腐蚀和防护 (共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 818.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-11 00:00:00 | ||
图片预览








文档简介
课件23张PPT。金属的腐蚀和防护金属腐蚀的现象锈蚀的大桥锈蚀的闸门锈蚀的轮船锈蚀的楼梯思考:铁锈和铜绿的主要成份是什么?金属或合金与周围接触到的气体或液体
进行化学反应而腐蚀损耗的过程。金属腐蚀化学腐蚀电化学腐蚀一、金属的腐蚀(1)定义:(2)本质:金属失去电子被氧化。接触的介质不同,发生腐蚀的化学原理不同(3)分 类: 金属跟接触到的物质(如O2、CI2、SO2等)
直接发生化学反应而引起的腐蚀。1、化学腐蚀一、金属的腐蚀(2)原理:(1)定义:(3)影响因素:金属跟氧化剂直接发生氧化还原反应。金属的活泼性(内因)
环境温度
氧化剂浓度。家用燃气灶放在南极已差不多
90年食品罐头 一般情况下,温度的升高会加快化学反应速率。因此,温度对化学腐蚀的影响较明显。2、电化学腐蚀 不纯的金属(或合金)跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。一、原电池:把化学能转化为电能的装置二、原电池原理三、判断原电池正、负极的方法 氧化还原反应1、由组成原电池的两极材料判断;2、根据电流方向或电子流动方向判断;3、根据两极的变化来判断,负极—氧化反应;复习回忆四、构成原电池的条件:
1、自发进行的氧化还原反应
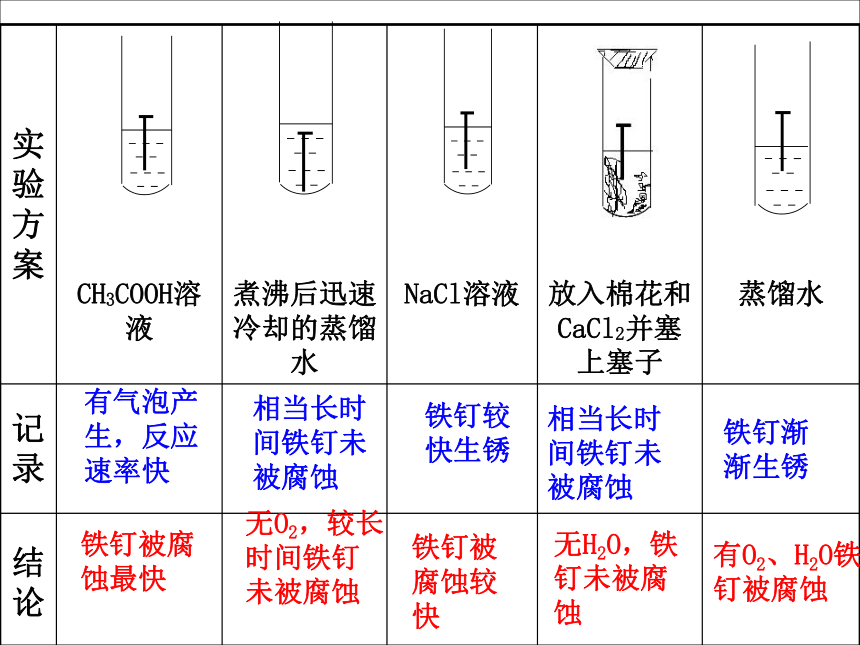
2、有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。(一般负极与电解质发生氧化还原反应)3、有电解质溶液。 4、两极相连形成闭合回路。科学探究P51不同条件下铁钉的腐蚀有气泡产生,反应速率快相当长时间铁钉未被腐蚀铁钉被腐蚀最快无O2,较长时间铁钉未被腐蚀铁钉较快生锈铁钉被腐蚀较快无H2O,铁钉未被腐蚀有O2、H2O铁钉被腐蚀铁钉渐渐生锈相当长时间铁钉未被腐蚀结论:
铁钉遇到电解质溶液或有O2、H2O存在的情况下,铁均可被腐蚀,遇到电解质时,一般腐蚀速率更快。不会,因为月球上缺少水分和氧气。 1、 请你预测一下,铁在月球上会不会生锈?为什么? 2、在新疆吐鲁番和海南省两地,哪个地区铁生锈相对慢一些?为什么? 新疆吐鲁番,因为该地区相对干燥,水分稀少,而海南地区潮湿多雨,温度高,易发生电化学腐蚀。吸氧腐蚀与析氢腐蚀(以钢铁为例)水膜呈弱酸性或中性O2+2H2O+4e-=4OH-Fe-2e-=Fe2+水膜呈酸性2H++2e-=H2↑Fe-2e-=Fe2+Fe2++2OH-=Fe(OH)2↓4Fe(OH)2 +2H2O+ O2= 4Fe(OH)34Fe(OH)3失去部分水转化为铁锈 1、 烧过菜的铁锅如果未及时洗净(残液中含 NaCl),第二天便出现红棕色锈斑(主要成分为Fe 2 O 3?nH2O)。请问这种腐蚀是化学腐蚀还是电化学腐蚀?为什么?2、化学腐蚀和电化腐蚀有何异同?同:本质相同:M — ne— =M n+ 一般两者同时发生异:1)条件不同
2)化学腐蚀中电子直接转移给氧化剂,电化腐蚀中电子间接转移
3)一般电化腐蚀的速率>化学腐蚀
思考与交流 讨论自行车的不同构件如链条、钢圈、支架和齿轮等分别采取了什么防锈措施?二、金属的防护思考与交流 请根据生活常识以及下图总结金属防护常用的方法,并解释这些方法为什么可以达到防止金属腐蚀的目的。健身器材刷油漆以防锈衣架和电线的外面包上一层塑料层某些工具的“机械转动部位”选用油脂来防锈,为什么不能用油漆自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr你还知道哪些防止金属腐蚀的方法?请举例说明。用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块必须定期更换 制成不锈钢,在金属表面镀一层比要保护的金属更活泼的金属。金属的防护方法1、在金属表面覆盖保护层2、改变金属的内部组织结构 如 制合金3、电化学保护刷油漆、涂机油、加塑料层……不锈钢、马口铁、白口铁……牺牲负极的保护法……课堂练习 钢铁发生吸氧腐蚀时,发生还原反应的电极反应式是( )
A、 Fe – 2e-=Fe 2+
B、 2H + + 2e- =H2 ↑
C、 4OH - - 4e-= 2H2O + O2 ↑
D、 2H2O + O2 + 4e- = 4OH - D学海导航练习
进行化学反应而腐蚀损耗的过程。金属腐蚀化学腐蚀电化学腐蚀一、金属的腐蚀(1)定义:(2)本质:金属失去电子被氧化。接触的介质不同,发生腐蚀的化学原理不同(3)分 类: 金属跟接触到的物质(如O2、CI2、SO2等)
直接发生化学反应而引起的腐蚀。1、化学腐蚀一、金属的腐蚀(2)原理:(1)定义:(3)影响因素:金属跟氧化剂直接发生氧化还原反应。金属的活泼性(内因)
环境温度
氧化剂浓度。家用燃气灶放在南极已差不多
90年食品罐头 一般情况下,温度的升高会加快化学反应速率。因此,温度对化学腐蚀的影响较明显。2、电化学腐蚀 不纯的金属(或合金)跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。一、原电池:把化学能转化为电能的装置二、原电池原理三、判断原电池正、负极的方法 氧化还原反应1、由组成原电池的两极材料判断;2、根据电流方向或电子流动方向判断;3、根据两极的变化来判断,负极—氧化反应;复习回忆四、构成原电池的条件:
1、自发进行的氧化还原反应
2、有两种活动性不同的金属(或一种是非金属导体如碳棒)做电极。(一般负极与电解质发生氧化还原反应)3、有电解质溶液。 4、两极相连形成闭合回路。科学探究P51不同条件下铁钉的腐蚀有气泡产生,反应速率快相当长时间铁钉未被腐蚀铁钉被腐蚀最快无O2,较长时间铁钉未被腐蚀铁钉较快生锈铁钉被腐蚀较快无H2O,铁钉未被腐蚀有O2、H2O铁钉被腐蚀铁钉渐渐生锈相当长时间铁钉未被腐蚀结论:
铁钉遇到电解质溶液或有O2、H2O存在的情况下,铁均可被腐蚀,遇到电解质时,一般腐蚀速率更快。不会,因为月球上缺少水分和氧气。 1、 请你预测一下,铁在月球上会不会生锈?为什么? 2、在新疆吐鲁番和海南省两地,哪个地区铁生锈相对慢一些?为什么? 新疆吐鲁番,因为该地区相对干燥,水分稀少,而海南地区潮湿多雨,温度高,易发生电化学腐蚀。吸氧腐蚀与析氢腐蚀(以钢铁为例)水膜呈弱酸性或中性O2+2H2O+4e-=4OH-Fe-2e-=Fe2+水膜呈酸性2H++2e-=H2↑Fe-2e-=Fe2+Fe2++2OH-=Fe(OH)2↓4Fe(OH)2 +2H2O+ O2= 4Fe(OH)34Fe(OH)3失去部分水转化为铁锈 1、 烧过菜的铁锅如果未及时洗净(残液中含 NaCl),第二天便出现红棕色锈斑(主要成分为Fe 2 O 3?nH2O)。请问这种腐蚀是化学腐蚀还是电化学腐蚀?为什么?2、化学腐蚀和电化腐蚀有何异同?同:本质相同:M — ne— =M n+ 一般两者同时发生异:1)条件不同
2)化学腐蚀中电子直接转移给氧化剂,电化腐蚀中电子间接转移
3)一般电化腐蚀的速率>化学腐蚀
思考与交流 讨论自行车的不同构件如链条、钢圈、支架和齿轮等分别采取了什么防锈措施?二、金属的防护思考与交流 请根据生活常识以及下图总结金属防护常用的方法,并解释这些方法为什么可以达到防止金属腐蚀的目的。健身器材刷油漆以防锈衣架和电线的外面包上一层塑料层某些工具的“机械转动部位”选用油脂来防锈,为什么不能用油漆自行车的钢圈和车铃是在钢上镀上一层既耐腐蚀又耐磨的Cr你还知道哪些防止金属腐蚀的方法?请举例说明。用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块必须定期更换 制成不锈钢,在金属表面镀一层比要保护的金属更活泼的金属。金属的防护方法1、在金属表面覆盖保护层2、改变金属的内部组织结构 如 制合金3、电化学保护刷油漆、涂机油、加塑料层……不锈钢、马口铁、白口铁……牺牲负极的保护法……课堂练习 钢铁发生吸氧腐蚀时,发生还原反应的电极反应式是( )
A、 Fe – 2e-=Fe 2+
B、 2H + + 2e- =H2 ↑
C、 4OH - - 4e-= 2H2O + O2 ↑
D、 2H2O + O2 + 4e- = 4OH - D学海导航练习
