人教版九年级化学上册教学课件:第六单元课题3《二氧化碳和一氧化碳》 (共25张PPT)
文档属性
| 名称 | 人教版九年级化学上册教学课件:第六单元课题3《二氧化碳和一氧化碳》 (共25张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 564.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-11 21:25:56 | ||
图片预览





文档简介
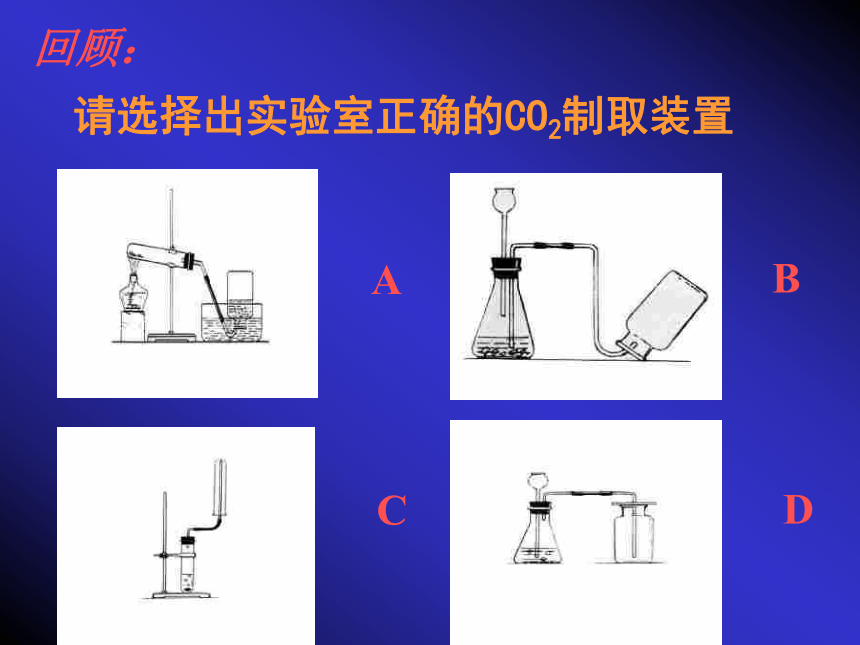
课件25张PPT。课题3、 二氧化碳和一氧化碳CO2请选择出实验室正确的CO2制取装置
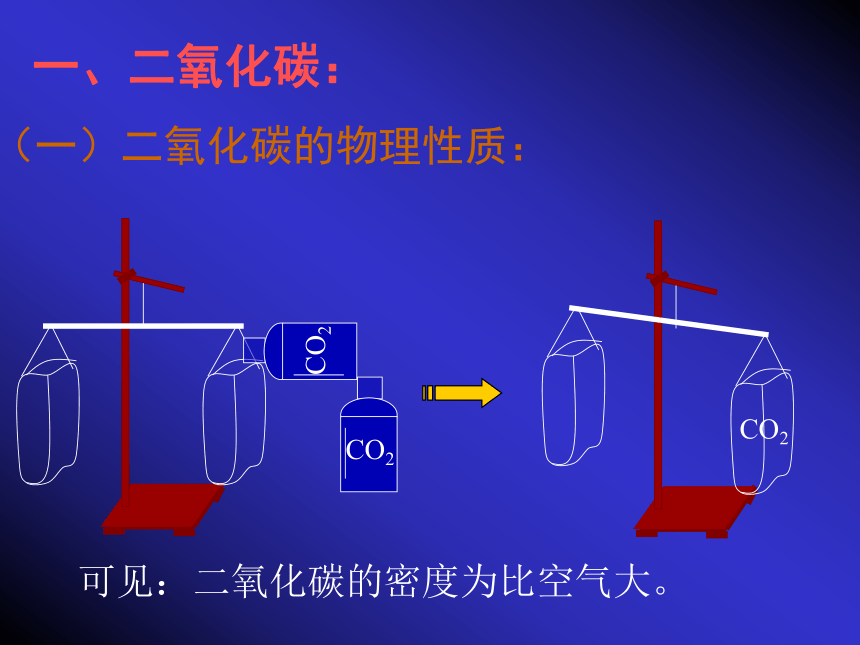
回顾:ABCD可见:二氧化碳的密度为比空气大。
一、二氧化碳:(一)二氧化碳的物理性质:
在通常情况下,二氧化碳是无色无味气体;在
标况下,二氧化碳的密度为1.977g/L,比空气大;
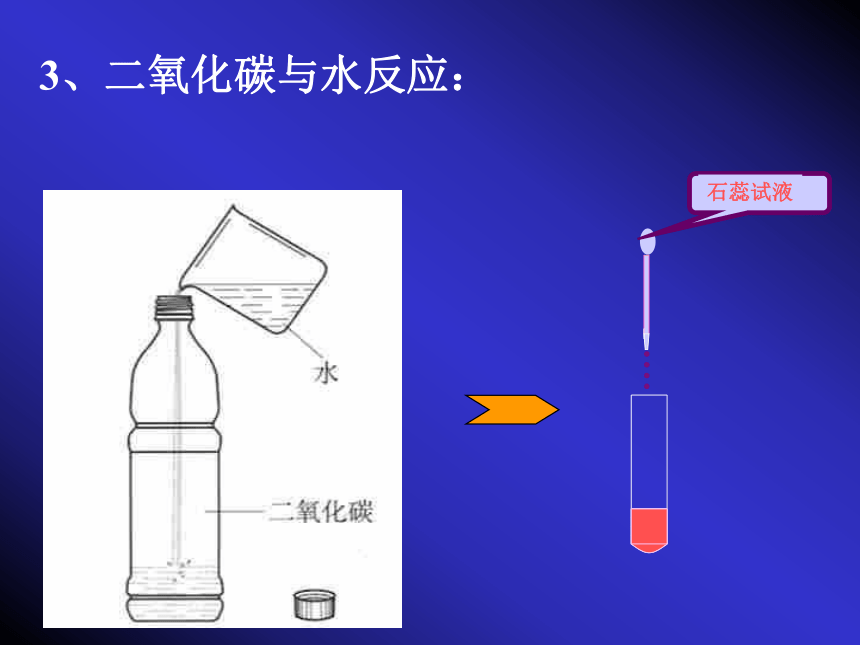
能溶于水。二氧化碳的固体俗称干冰。结论:(二)二氧化碳的化学性质:1、不能供给呼吸;2、既不能燃烧,也不能支持燃烧;(通常情况下)3、二氧化碳与水反应:A 石蕊和某些酸的反应B 直接放入CO2中C 喷 水D 喷水后放入CO2中探究什么物质使紫色石蕊试液变红色:二氧化碳与水反应原理:CO2+H2O === H2CO3H2CO3 === CO2↑ +H2O 现象:通入二氧化碳时,紫色石蕊试液变红色。 碳酸不稳定,加热易分解。当加热上述变红色的溶液,
二氧化碳气体逸出,红色又变成紫色。4、与石灰水反应:现象:澄清的石灰水变浑浊。
原理:CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
碳酸钙
此反应原理是用来检验
或鉴定二氧化碳气体。5、二氧化碳与还原性金属或非金属单质反应:(1)二氧化碳与镁带的反应:现象:将燃着的镁带伸进盛有二氧化碳的集气瓶
中,镁带继续燃烧,瓶壁上有黑色物质生
成,瓶底有白色固体物质出现。原理: CO2 + 2Mg == 2MgO + C点燃(2)二氧化碳与碳的反应:原理: CO2 + C == 2CO高温注:(1)燃烧不一定需要氧气参加;(3)上述两反应中二氧化碳是氧化剂,镁、碳是还原剂。(2)二氧化碳在特殊条件下也能支持燃烧。(三) 二氧化碳的用途:1、灭火;灭火的原因是:二氧化碳既不能燃,也不支持燃,
且密度比空气大,所以,二氧化碳
能覆盖在可燃物的表面,使可燃物
隔绝氧气而熄灭。2、干冰作致冷剂;3、植物光合作用作气肥;4、工业原料.人工降雨灭火工业原料致冷剂气体肥料小结二氧化碳的用途人、动植物的呼吸,
煤等燃料的燃烧光合作用二氧化碳的循环利用(四)二氧化碳对生活环境的影响:温 室 效 应二、一氧化碳: 一氧化碳与二氧化碳在化学式上仅相差一个氧
原子,可它们的性质显然不同。(一)一氧化碳的物理性质: 在通常情况下,一氧化碳是无色无味气体;在
标况下,密度为1.250g/L,比空气略轻;难溶于水。当碳燃烧不充分时,
就会生成一氧化碳。(二)一氧化碳的化学性质:1、可燃性:现象:产生蓝色火焰,放出大量的热,生成无色
无味气体能使澄清的石灰水变浑浊。原理: 2CO + O2 ==== 2CO2点燃2、还原性:一氧化碳还原氧化铜现象:(1)黑色氧化铜逐渐成为红色;
(2)澄清的石灰水变浑浊。原理: CO + CuO === Cu + CO2
?装置图:本实验操作步骤是:1、检查装置的气密性;2、将一氧化碳气体验纯;3、点燃装置最后边的酒精灯;
4、通入一氧化碳气体;5、点燃酒精灯进行加热;6、反应完毕,先撤灯,后撤气,再熄灭后边的酒
精灯。
注意:在点燃或加热任何可燃性气体之前,都必须
先验纯。 下图是演示了一氧化碳还原氧化铜的微观过
程,从微观上揭示了一氧化碳还原性的机理。
CO + CuO === Cu + CO2? 未反应完的尾气一氧化碳最简单的处理方法
是用酒精灯点燃处理,避免散逸到大气中,而污
染环境。也可循环利用作燃料,也可收集起来。 一氧化碳也能还原氧化铁3CO + Fe2O3 === 2Fe + 3CO2高温(这是高炉炼铁的主要原理)以上两反应中,一氧化碳都是还原剂,具有还原性。3、一氧化碳的毒性: 其原因是一氧化碳吸进肺里很容易跟血液中
的血红蛋白结合(大约是氧气的200多倍),使血
红蛋白不能很好地与氧气结合,就会造成人体的组
织和细胞缺少氧气。严重者甚至使人死亡。 一氧化碳是煤气的主要成分,俗称煤气。一氧
化碳有毒,而且有剧毒。防止一氧化碳中毒的简单方法是: 就是注意室内通风,如果发生一氧化碳中毒,
轻度的应呼吸大量新鲜空气,严重的要立即到医院
进行治疗。下图是一氧化碳和氧气进入血液的对比实验学完本课题你应该知道1、二氧化碳不燃烧,也不支持燃烧,并能与水
反应;2、二氧化碳能使澄清的石灰水变浑浊,这个反
应可以用来检验二氧化碳;3、一氧化碳能够燃烧,具有还原性和毒性;4、温室效应及防止温室效应增强应采取的措施。谢 谢 合 作
回顾:ABCD可见:二氧化碳的密度为比空气大。
一、二氧化碳:(一)二氧化碳的物理性质:
在通常情况下,二氧化碳是无色无味气体;在
标况下,二氧化碳的密度为1.977g/L,比空气大;
能溶于水。二氧化碳的固体俗称干冰。结论:(二)二氧化碳的化学性质:1、不能供给呼吸;2、既不能燃烧,也不能支持燃烧;(通常情况下)3、二氧化碳与水反应:A 石蕊和某些酸的反应B 直接放入CO2中C 喷 水D 喷水后放入CO2中探究什么物质使紫色石蕊试液变红色:二氧化碳与水反应原理:CO2+H2O === H2CO3H2CO3 === CO2↑ +H2O 现象:通入二氧化碳时,紫色石蕊试液变红色。 碳酸不稳定,加热易分解。当加热上述变红色的溶液,
二氧化碳气体逸出,红色又变成紫色。4、与石灰水反应:现象:澄清的石灰水变浑浊。
原理:CO2 + Ca(OH)2 = CaCO3 ↓+ H2O
碳酸钙
此反应原理是用来检验
或鉴定二氧化碳气体。5、二氧化碳与还原性金属或非金属单质反应:(1)二氧化碳与镁带的反应:现象:将燃着的镁带伸进盛有二氧化碳的集气瓶
中,镁带继续燃烧,瓶壁上有黑色物质生
成,瓶底有白色固体物质出现。原理: CO2 + 2Mg == 2MgO + C点燃(2)二氧化碳与碳的反应:原理: CO2 + C == 2CO高温注:(1)燃烧不一定需要氧气参加;(3)上述两反应中二氧化碳是氧化剂,镁、碳是还原剂。(2)二氧化碳在特殊条件下也能支持燃烧。(三) 二氧化碳的用途:1、灭火;灭火的原因是:二氧化碳既不能燃,也不支持燃,
且密度比空气大,所以,二氧化碳
能覆盖在可燃物的表面,使可燃物
隔绝氧气而熄灭。2、干冰作致冷剂;3、植物光合作用作气肥;4、工业原料.人工降雨灭火工业原料致冷剂气体肥料小结二氧化碳的用途人、动植物的呼吸,
煤等燃料的燃烧光合作用二氧化碳的循环利用(四)二氧化碳对生活环境的影响:温 室 效 应二、一氧化碳: 一氧化碳与二氧化碳在化学式上仅相差一个氧
原子,可它们的性质显然不同。(一)一氧化碳的物理性质: 在通常情况下,一氧化碳是无色无味气体;在
标况下,密度为1.250g/L,比空气略轻;难溶于水。当碳燃烧不充分时,
就会生成一氧化碳。(二)一氧化碳的化学性质:1、可燃性:现象:产生蓝色火焰,放出大量的热,生成无色
无味气体能使澄清的石灰水变浑浊。原理: 2CO + O2 ==== 2CO2点燃2、还原性:一氧化碳还原氧化铜现象:(1)黑色氧化铜逐渐成为红色;
(2)澄清的石灰水变浑浊。原理: CO + CuO === Cu + CO2
?装置图:本实验操作步骤是:1、检查装置的气密性;2、将一氧化碳气体验纯;3、点燃装置最后边的酒精灯;
4、通入一氧化碳气体;5、点燃酒精灯进行加热;6、反应完毕,先撤灯,后撤气,再熄灭后边的酒
精灯。
注意:在点燃或加热任何可燃性气体之前,都必须
先验纯。 下图是演示了一氧化碳还原氧化铜的微观过
程,从微观上揭示了一氧化碳还原性的机理。
CO + CuO === Cu + CO2? 未反应完的尾气一氧化碳最简单的处理方法
是用酒精灯点燃处理,避免散逸到大气中,而污
染环境。也可循环利用作燃料,也可收集起来。 一氧化碳也能还原氧化铁3CO + Fe2O3 === 2Fe + 3CO2高温(这是高炉炼铁的主要原理)以上两反应中,一氧化碳都是还原剂,具有还原性。3、一氧化碳的毒性: 其原因是一氧化碳吸进肺里很容易跟血液中
的血红蛋白结合(大约是氧气的200多倍),使血
红蛋白不能很好地与氧气结合,就会造成人体的组
织和细胞缺少氧气。严重者甚至使人死亡。 一氧化碳是煤气的主要成分,俗称煤气。一氧
化碳有毒,而且有剧毒。防止一氧化碳中毒的简单方法是: 就是注意室内通风,如果发生一氧化碳中毒,
轻度的应呼吸大量新鲜空气,严重的要立即到医院
进行治疗。下图是一氧化碳和氧气进入血液的对比实验学完本课题你应该知道1、二氧化碳不燃烧,也不支持燃烧,并能与水
反应;2、二氧化碳能使澄清的石灰水变浑浊,这个反
应可以用来检验二氧化碳;3、一氧化碳能够燃烧,具有还原性和毒性;4、温室效应及防止温室效应增强应采取的措施。谢 谢 合 作
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
