新高一化学辅导班内部讲义与过关提升训练-必修1-第1章-第3关
文档属性
| 名称 | 新高一化学辅导班内部讲义与过关提升训练-必修1-第1章-第3关 |  | |
| 格式 | zip | ||
| 文件大小 | 350.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-12 21:57:01 | ||
图片预览



文档简介
U-CAN
SECONDARY
SCHOOL
EDUCATION
物质的量与摩尔
★★★☆☆☆
level
3
★★★☆☆☆
Level
3
本关进步目标
★★★☆☆☆
能够进行物质的量浓度的基本计算;
★★★☆☆☆
能够进行溶液混合的计算。
学习重点:本关通过对物质的量浓度基本计算的学习,能够进行物质的量浓度的基本计算
物质的量浓度:____________________________________________________________。
表示符号:_____________________
单位:_______________________
计算公式:
_________________
变式1:
_______________________
变式2:物质的量浓度与质量分数的关系
__________________
1.VL
CaCl2溶液中含有a
g
Ca2+,则溶液中Cl-的物质的量浓度为(
)
A.
mol·L-1
B.
mol·L-1
C.
mol·L-1
D.
mol·L-1
2.物质的量浓度相同的NaNO3,Mg(NO3)2,Al(NO3)3三种溶液,当溶液的体积比为3:2:1时,三种溶液中NO3-的物质的量浓度之比为(
)
A.1:2:3
B.3:4:3
C.3:2:1
D.1:1:1
3.36.5%的盐酸,密度为1.19
g·cm-3,求其物质的量浓度?
4.将标准状况下的
a
L
HCl(气)溶于
1000g
水中,得到的盐酸密度为
b
g·cm-3,则该盐酸的物质的量浓度是(
)
A.
mol·L-1
B.
mol·L-1
C.
mol·L-1
D.
mol·L-1
0.5L
1
mol·L-1的FeCl3溶液与0.2L
1
mol·L-1的KCl溶液中,Cl-浓度比为(
)
A.15∶2
B.1∶1
C.3∶1
D.1∶3
NA为阿伏加德罗常数,下列关于0.2
mol·L-1
K2SO4溶液的正确说法是(
)
A.500mL溶液中所含K+、SO42-总数为0.3NA
B.500mL溶液中含有0.1NA个K+离子
C.1L溶液中K+离子浓度是0.2
mol·L-1
D.2L溶液中SO42-离子浓度是0.4
mol·L-1
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4
mol·L-1,SO42-的物质的量浓度为0.7
mol·L-1,则此溶液中K+的物质的量浓度为(
)
A.0.1
mol·L-1
B.0.15
mol·L-1
C.0.2
mol·L-1
D.0.25
mol·L-1
质量为8.02g的铁片,放进1.0L
0.90
mol·L-1的CuSO4溶液中,过一段时间取出洗净、干燥、称量,质量为8.66g。若认为溶液的体积没有变化,则Cu2+的浓度变为(
)
A.0.89
mol·L-1
B.0.82
mol·L-1
C.0.78
mol·L-1
D.0.6
mol·L-1
将0.1
mol·L-1的K2SO4溶液、0.2
mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合溶液中K+、Al3+、SO42-的浓度分别为0.1
mol·L-1、0.1
mol·L-1和0.2
mol·L-1,则所取K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比是(假定混合后体积不变)(
)
A.1:1:1
B.2:1:2
C.1:1:2
D.2:1:1
用密度为1.32
g·cm-3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止。已知所生成的溶液的质量等于原BaCl2溶液的质量,则H2SO4溶液的浓度为(
)
A.21.9%
B.42.1%
C.13.5
mol·L-1
D.5.67
mol·L-1
已知20g密度为ρg/mL的硝酸钙溶液中含有1g
Ca2+,则NO3-的物质的量浓度为(
)
A.ρ/400
mol·L-1
B.20/ρmol·L-1
C.2.5ρ
mol·L-1
D.1.25ρ
mol·L-1
体积为V、密度为ρ的某溶液中,含有摩尔质量为M的溶质m克。若此溶液中溶质的物质的量浓度为c,溶质的质量分数为w,则下列各表示式中不正确的是(
)
A.
B.
C.
D.
要配制30%的盐酸,在240ml水中应溶解多少L
HCl(标准状况)?若此盐酸的密度为1.15g/cm3,求此盐酸的物质的量浓度。
用98%浓H2SO4(d=1.84)配制1:5稀硫酸(d=1.19),求这种硫酸的质量分数和物质的量浓度。
学习重点:本关通过对溶液混合问题的学习,能够进行溶液稀释与浓缩问题的相关计算
1.溶液浓缩与稀释
稀释:_______________
浓缩:_______________
1.如果配制5000克22%的稀硫酸用以除锈,需98%的浓硫酸和水各多少毫升(98%浓硫酸的密度为1.84
g/cm3)?
2.在配制一定物质的量浓度溶液的实验中,小明配制了50
mL
0.5
mol·L-1的溶液,为了资源节约利用,另一实验室的老师需要0.25
mol·L-1的溶液,请问该老师需要准备多少毫升的容量瓶?(假设50
mL溶液全部能够转移到新容量瓶中)
含氨15
%的氨水2
Kg,稀释到含氨0.3
%时,需要加水
(
)
A.98
Kg
B.100
Kg
C.102
Kg
D.104
Kg
某Al2(SO4)3溶液V
mL中含a
g
Al3+,取出V/4
mL溶液稀释成4V
mL后,SO42-的物质的量浓度为(
)
A.125/54V
mol·L-1
B.125a/36V
mol·L-1
C.125a/18V
mol·L-1
D.125a/V
mol·L-1
实验室常用98%(ρ=1.84g/mL)的浓H2SO4配制1:4的稀H2SO4,此稀H2SO4的密度为1.23g/mL,其物质的量浓度为(
)
A.4.6
mol·L-1
B.5.7
mol·L-1
C.3.88
mol·L-1
D.18.4
mol·L-1
用6
mol·L-1
NaOH溶液100ml(ρ=1.21
g·cm-3)加水,稀释到0.6
mol·L-1
(ρ=1.03
g·cm-3)
,求:
(1)稀释后溶液的体积。
(2)需加水的体积。
学习重点:本关通过对溶液混合问题的学习,能够进行溶液混合问题的相关计算
1.溶液的混合
___________________________
1.小花在做实验的时候用物质的量浓度为0.35
mol·L-1和0.85
mol·L-1的溶液配制成了物质的量浓度为0.45
mol·L-1新溶液100mL,但她忘记去记录两种溶液分别所用的体积,请你帮助她解决一下这个问题吧。
取100mL
0.3
mol·L-1和300mL
0.25
mol·L-1的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是(
)
A.0.21
mol·L-1
B.0.42
mol·L-1
C.0.56mol·L-1
D.0.26mol·L-1
已知25%氨水的密度0.91g/cm3,5%氨水的密度为0.98g/cm3,若将上述两溶液等体积混合,所得氨水溶液的质量分数( )
A.等于15%
B.大于15%
C.小于15%
D.无法确定
浓度不等的两种硫酸溶液,等质量混合后,溶液中溶质的质量分数为a
%,而等体积混合后,溶液中溶质的质量分数为b
%;浓度不等的两种氨水,等质量混合后,溶液中溶质的质量分数为a
%,而等体积混合后,溶液中溶质的质量分数为c
%,则的关系是 ( )
A.a>b>c
B.b>a>c
C.c>b>a
D.c>a>b
50
mL稀硝酸稀盐酸的混合溶液,加入100
mL
2
mol·L-1的NaOH溶液正好中和;另取50
mL这种混合酸加入过量AgNO3溶液时,可产生0.7175
g白色沉淀。计算混合酸中硝酸和盐酸的物质的量浓度分别为多少?
将1mol/L 的氨水与水等质量混合后,所得氨水的物质的量浓度____________0.5mol/L, 等体积混合所得氨水的物质的量浓度____________0.5mol/L 。将1mol/L 的氨水与3mol/L的氨水等质量混合后,所得氨水的物质的量浓度____________2mol/L 等体积混合所得氨水的物质的量浓度____________2mol/L。 已知25%的氨水的密度为0.91
mol/cm3,5
%的氨水密度为0.98
g/cm3,若等体积混合,所得氨水的质量分数____________15%(填大于、小于、等于)。
SECONDARY
SCHOOL
EDUCATION
物质的量与摩尔
★★★☆☆☆
level
3
★★★☆☆☆
Level
3
本关进步目标
★★★☆☆☆
能够进行物质的量浓度的基本计算;
★★★☆☆☆
能够进行溶液混合的计算。
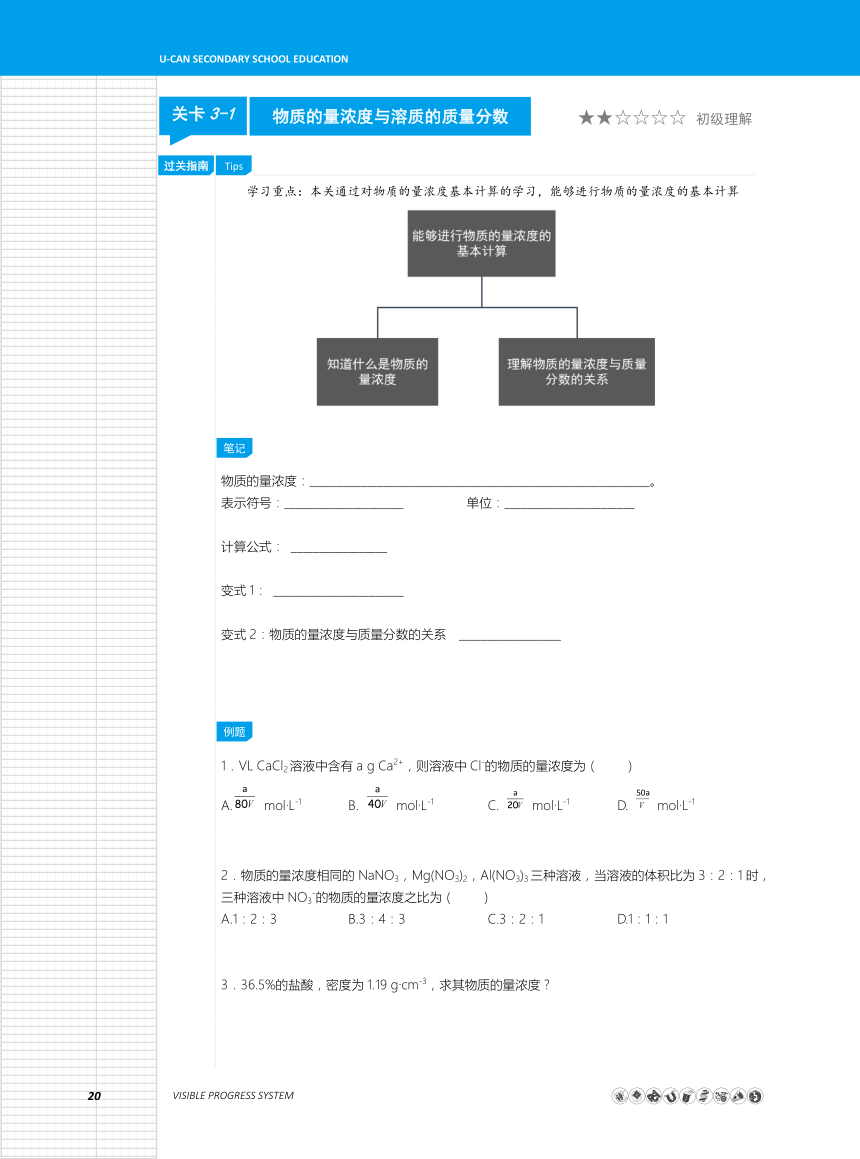
学习重点:本关通过对物质的量浓度基本计算的学习,能够进行物质的量浓度的基本计算
物质的量浓度:____________________________________________________________。
表示符号:_____________________
单位:_______________________
计算公式:
_________________
变式1:
_______________________
变式2:物质的量浓度与质量分数的关系
__________________
1.VL
CaCl2溶液中含有a
g
Ca2+,则溶液中Cl-的物质的量浓度为(
)
A.
mol·L-1
B.
mol·L-1
C.
mol·L-1
D.
mol·L-1
2.物质的量浓度相同的NaNO3,Mg(NO3)2,Al(NO3)3三种溶液,当溶液的体积比为3:2:1时,三种溶液中NO3-的物质的量浓度之比为(
)
A.1:2:3
B.3:4:3
C.3:2:1
D.1:1:1
3.36.5%的盐酸,密度为1.19
g·cm-3,求其物质的量浓度?
4.将标准状况下的
a
L
HCl(气)溶于
1000g
水中,得到的盐酸密度为
b
g·cm-3,则该盐酸的物质的量浓度是(
)
A.
mol·L-1
B.
mol·L-1
C.
mol·L-1
D.
mol·L-1
0.5L
1
mol·L-1的FeCl3溶液与0.2L
1
mol·L-1的KCl溶液中,Cl-浓度比为(
)
A.15∶2
B.1∶1
C.3∶1
D.1∶3
NA为阿伏加德罗常数,下列关于0.2
mol·L-1
K2SO4溶液的正确说法是(
)
A.500mL溶液中所含K+、SO42-总数为0.3NA
B.500mL溶液中含有0.1NA个K+离子
C.1L溶液中K+离子浓度是0.2
mol·L-1
D.2L溶液中SO42-离子浓度是0.4
mol·L-1
有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4
mol·L-1,SO42-的物质的量浓度为0.7
mol·L-1,则此溶液中K+的物质的量浓度为(
)
A.0.1
mol·L-1
B.0.15
mol·L-1
C.0.2
mol·L-1
D.0.25
mol·L-1
质量为8.02g的铁片,放进1.0L
0.90
mol·L-1的CuSO4溶液中,过一段时间取出洗净、干燥、称量,质量为8.66g。若认为溶液的体积没有变化,则Cu2+的浓度变为(
)
A.0.89
mol·L-1
B.0.82
mol·L-1
C.0.78
mol·L-1
D.0.6
mol·L-1
将0.1
mol·L-1的K2SO4溶液、0.2
mol·L-1的Al2(SO4)3溶液和纯水混合,要使混合溶液中K+、Al3+、SO42-的浓度分别为0.1
mol·L-1、0.1
mol·L-1和0.2
mol·L-1,则所取K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比是(假定混合后体积不变)(
)
A.1:1:1
B.2:1:2
C.1:1:2
D.2:1:1
用密度为1.32
g·cm-3的硫酸溶液逐滴滴入到BaCl2溶液中,直到沉淀恰好完全为止。已知所生成的溶液的质量等于原BaCl2溶液的质量,则H2SO4溶液的浓度为(
)
A.21.9%
B.42.1%
C.13.5
mol·L-1
D.5.67
mol·L-1
已知20g密度为ρg/mL的硝酸钙溶液中含有1g
Ca2+,则NO3-的物质的量浓度为(
)
A.ρ/400
mol·L-1
B.20/ρmol·L-1
C.2.5ρ
mol·L-1
D.1.25ρ
mol·L-1
体积为V、密度为ρ的某溶液中,含有摩尔质量为M的溶质m克。若此溶液中溶质的物质的量浓度为c,溶质的质量分数为w,则下列各表示式中不正确的是(
)
A.
B.
C.
D.
要配制30%的盐酸,在240ml水中应溶解多少L
HCl(标准状况)?若此盐酸的密度为1.15g/cm3,求此盐酸的物质的量浓度。
用98%浓H2SO4(d=1.84)配制1:5稀硫酸(d=1.19),求这种硫酸的质量分数和物质的量浓度。
学习重点:本关通过对溶液混合问题的学习,能够进行溶液稀释与浓缩问题的相关计算
1.溶液浓缩与稀释
稀释:_______________
浓缩:_______________
1.如果配制5000克22%的稀硫酸用以除锈,需98%的浓硫酸和水各多少毫升(98%浓硫酸的密度为1.84
g/cm3)?
2.在配制一定物质的量浓度溶液的实验中,小明配制了50
mL
0.5
mol·L-1的溶液,为了资源节约利用,另一实验室的老师需要0.25
mol·L-1的溶液,请问该老师需要准备多少毫升的容量瓶?(假设50
mL溶液全部能够转移到新容量瓶中)
含氨15
%的氨水2
Kg,稀释到含氨0.3
%时,需要加水
(
)
A.98
Kg
B.100
Kg
C.102
Kg
D.104
Kg
某Al2(SO4)3溶液V
mL中含a
g
Al3+,取出V/4
mL溶液稀释成4V
mL后,SO42-的物质的量浓度为(
)
A.125/54V
mol·L-1
B.125a/36V
mol·L-1
C.125a/18V
mol·L-1
D.125a/V
mol·L-1
实验室常用98%(ρ=1.84g/mL)的浓H2SO4配制1:4的稀H2SO4,此稀H2SO4的密度为1.23g/mL,其物质的量浓度为(
)
A.4.6
mol·L-1
B.5.7
mol·L-1
C.3.88
mol·L-1
D.18.4
mol·L-1
用6
mol·L-1
NaOH溶液100ml(ρ=1.21
g·cm-3)加水,稀释到0.6
mol·L-1
(ρ=1.03
g·cm-3)
,求:
(1)稀释后溶液的体积。
(2)需加水的体积。
学习重点:本关通过对溶液混合问题的学习,能够进行溶液混合问题的相关计算
1.溶液的混合
___________________________
1.小花在做实验的时候用物质的量浓度为0.35
mol·L-1和0.85
mol·L-1的溶液配制成了物质的量浓度为0.45
mol·L-1新溶液100mL,但她忘记去记录两种溶液分别所用的体积,请你帮助她解决一下这个问题吧。
取100mL
0.3
mol·L-1和300mL
0.25
mol·L-1的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是(
)
A.0.21
mol·L-1
B.0.42
mol·L-1
C.0.56mol·L-1
D.0.26mol·L-1
已知25%氨水的密度0.91g/cm3,5%氨水的密度为0.98g/cm3,若将上述两溶液等体积混合,所得氨水溶液的质量分数( )
A.等于15%
B.大于15%
C.小于15%
D.无法确定
浓度不等的两种硫酸溶液,等质量混合后,溶液中溶质的质量分数为a
%,而等体积混合后,溶液中溶质的质量分数为b
%;浓度不等的两种氨水,等质量混合后,溶液中溶质的质量分数为a
%,而等体积混合后,溶液中溶质的质量分数为c
%,则的关系是 ( )
A.a>b>c
B.b>a>c
C.c>b>a
D.c>a>b
50
mL稀硝酸稀盐酸的混合溶液,加入100
mL
2
mol·L-1的NaOH溶液正好中和;另取50
mL这种混合酸加入过量AgNO3溶液时,可产生0.7175
g白色沉淀。计算混合酸中硝酸和盐酸的物质的量浓度分别为多少?
将1mol/L 的氨水与水等质量混合后,所得氨水的物质的量浓度____________0.5mol/L, 等体积混合所得氨水的物质的量浓度____________0.5mol/L 。将1mol/L 的氨水与3mol/L的氨水等质量混合后,所得氨水的物质的量浓度____________2mol/L 等体积混合所得氨水的物质的量浓度____________2mol/L。 已知25%的氨水的密度为0.91
mol/cm3,5
%的氨水密度为0.98
g/cm3,若等体积混合,所得氨水的质量分数____________15%(填大于、小于、等于)。
