福建省泉州市台商区惠南中学2015-2016学年高二下学期期末考试化学试题
文档属性
| 名称 | 福建省泉州市台商区惠南中学2015-2016学年高二下学期期末考试化学试题 |  | |
| 格式 | zip | ||
| 文件大小 | 131.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-09-13 11:59:45 | ||
图片预览




文档简介
惠南中学2016年春季期末考试卷
高二化学
考试时间:90分钟
满分:100分
2016.7.5
☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆
温馨提示:信心、细心、
耐心!
☆
☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆
相对原子质量:
H:1
C:12
O:16
Na:23
Cl:35.5
Cu:64
第Ⅰ卷(选择题
共46分)
一、选择题(本题共23小题,每小题2分,共46分,每题只有一个正确选项)
1.某学生的实验报告所列出的下列数据中合理的是(
)
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g
NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL碱式滴定管做中和滴定实验时,测得用去的碱溶液21.70mL
2.25℃时,下列各物质的水溶液的pH小于7的是(
)
A.Na2CO3
B.Fe2(SO4)3
C.KOH
D.KHCO3
3.下列物质中,其主要成分不属于烃的是(
)
A.甘油
B.汽油
C.煤油
D.柴油
4.分子式为C4H8Cl2的有机物共有(不含立体异构)(
)
A.7种
B.8种
C.9种
D.10种
5.下列化学用语书写正确的是(
)
A.乙烯的结构简式:CH2CH2
B.丙烯的键线式:
C.甲烷的电子式:
D.乙醇的结构式:
6.下列各组物质中,一定互为同系物的是(
)
A.乙烷和己烷
B.CH3COOH、C3H6O2
C.和
D.HCHO、CH3COOH
7.下列反应中,属于取代反应的是(
)
①
CH3CH=CH2+Br2
CH3CHBrCH2Br
②
CH3CH2OH
CH2=CH2
↑
+
H2O
③
CH3COOH
+
CH3CH2OH
CH3COOCH2CH3
+
H2O
④
C6H6
+
HNO3
C6H5NO2
+
H2O
A.①②
B.②④
C.①③
D.③④
8.由2﹣氯丙烷制取少量的1,2﹣丙二醇时,
需要经过下列哪几步反应(
)
A.消去、加成、取代
B.加成、消去、取代
C.取代、消去、加成
D.消去、加成、消去
9.下列有关有机物的说法不正确的是(
)
A.酒精中是否含有水,可用金属钠检验
B.有机酸和醇脱水合成的某些酯,可用作糖果、化妆品中的香料
C.蛋白质在一定条件下能发生水解反应,生成氨基酸
D.乙烯通过聚合反应可合成聚乙烯,聚乙烯塑料可用来制造多种包装材料
10.
( http: / / www.21cnjy.com )的命名正确的是(
)
A.2-二甲基-3-乙基丁烷
B.2,3,3-三甲基戊烷
C.2,2-二甲基-3-乙基丁烷
D.3,4,4-三甲基戊烷
11.化学与生产、生活密切相关,下列说法不正确的是(
)
A.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B.氢氧化铝可作抗酸药
C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物
D.硅胶可用作食品干燥剂
12.下列离子方程式书写正确的是( )
A.Na2S溶液的水解:S2-+
2
H2OH2S
+
2
OH-
B.NaHCO3溶液里发生的电离:HCO3-+
H2O
H2
CO3
+
OH-
C.NH4Cl溶液的水解:NH4+
+
H2O
NH3·H2O
+
H+
D.把金属铁放入稀硫酸中:2Fe
+
6H+
=
2Fe3+
+
3H2↑
13.下列溶液一定呈中性的是(
)
A.c(H+)=c(OH一)=1×10一6
mol·L-1的溶液
B.等物质的量的强酸和强碱反应后所得到的混合溶液
C.将pH=5的盐酸稀释100倍所得到的溶液
D.非电解质溶于水得到的溶液
14.某有机物的结构如右图所示,这种有机物不可能具有的性质是(
)
①可以与氢气发生加成反应;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应;
⑥能发生水解反应
A.①④
B.④⑥
C.只有⑤
D.只有⑥
15.设NA为阿伏加德罗常数的数值,下列说法中正确的是(
)
A.在密闭容器中加入l.5mol
H2和0.5molN2,充分反应后可得到NH3分子数为NA
B.8.8g乙酸乙酯中含共用电子对数为1.4
NA
C.1
L
0.1
mol·L-1氯化铜溶液中铜离子数为0.1
NA
D.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA
16.下列叙述不正确的是(
)
A.漂白粉长时间露置空气中会结块变质
B.金属钠在空气中燃烧产生黄色火焰,生成淡黄色固体
C.为防船体被腐蚀,远洋货轮船底外壳镶嵌锌块,其中锌发生还原反应
D.两根分别蘸有浓盐酸、浓氨水的玻璃棒靠近有白烟产生
17.全轨电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:
VO2+(蓝色)+H2O+V3+(紫色)VO2+(黄色)+V2+(绿色)+2H+
下列说法错误的(
)
A.放电过程中,正极附近溶液的酸性减弱
B.放电时,正极反应为VO2++2H++e-=VO2++H2O
C.充电时,反应每生成2mol
H+
时电子转移数为2mol
D.充电时,阳极附近溶液由蓝色逐渐变为黄色
18.下列过程或现象与盐类水解无关的是(
)
A.用热的纯碱溶液去油污
B.pH=3的醋酸溶液,加水稀释10倍后pH<4
C.实验室配置FeCl3溶液时,加入少量稀盐酸,以防止溶液浑浊
D.草木灰与铵态氮肥不能混合施用
19.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是(
)
A.弱酸溶液和强碱溶液反应
B.生成了一种强酸弱碱盐
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和二元强碱溶液反应
20.下列措施或事实不能用勒夏特列原理解释的是(
)
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气,加压后颜色变深
C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
D.在合成氨的反应中,加压有利于氨的合成
21.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为2:1的有(
)
A.乙酸甲酯
B.2-甲基丙烷
C.对苯二酚
D.正戊烷
22.下列实验装置设计正确、且能达到目的的是(
)
HYPERLINK
"http://www.21cnjy.com"
A.实验Ⅰ:制取金属钠
B.实验II:制取Fe(OH)2
C.实验Ⅲ:制取少量的氢氧化铝
D.实验Ⅳ:比较两种物质的热稳定性
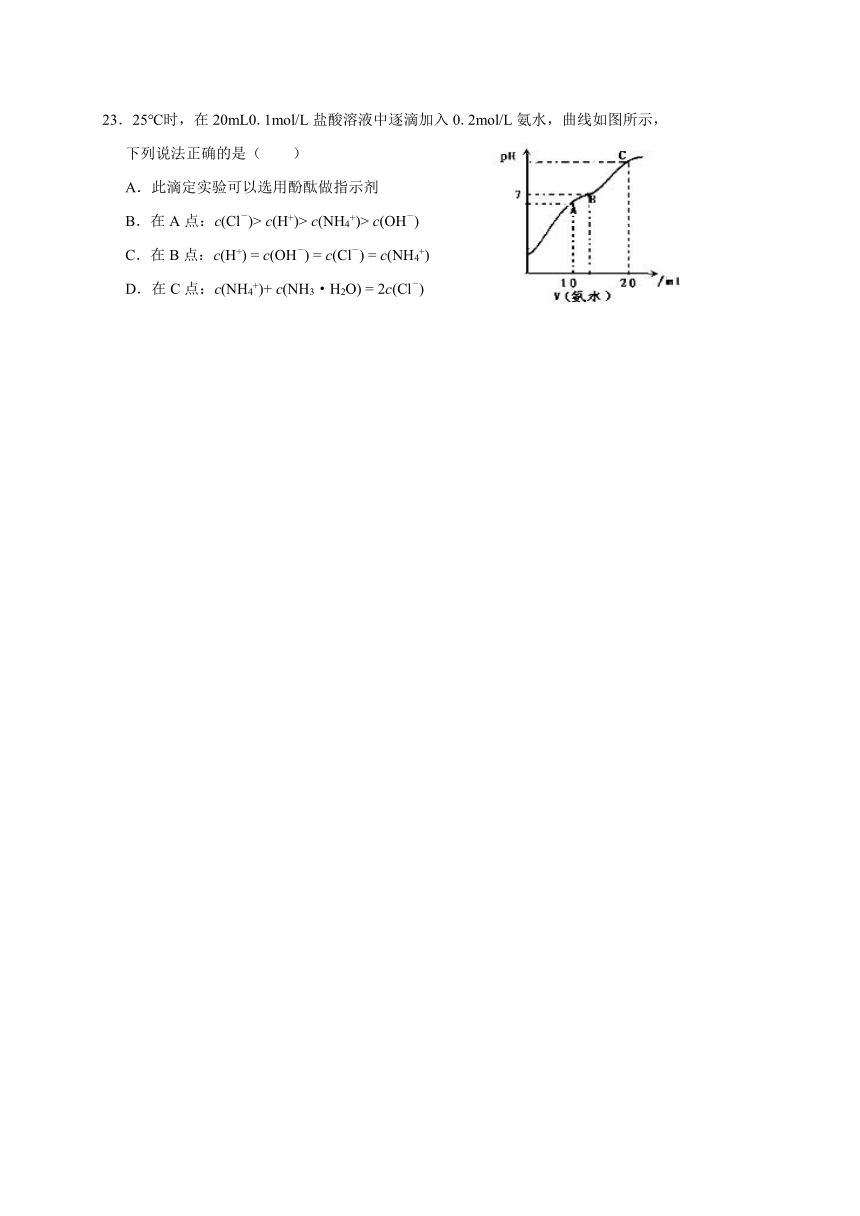
23.25℃时,在20mL0.1mol/L盐酸溶液中逐滴加入0.2mol/L氨水,曲线如图所示,
下列说法正确的是(
)
A.此滴定实验可以选用酚酞做指示剂
B.在A点:c(Cl-)>
c(H+)>
c(NH4+)>
c(OH-)
C.在B点:c(H+)
=
c(OH-)
=
c(Cl-)
=
c(NH4+)
D.在C点:c(NH4+)+
c(NH3·H2O)
=
2c(Cl-)
惠南中学2016年春季期末考试卷
高二化学
2016.7.5
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
题号
21
22
23
答案
一、选择题答案卡(选择题共46分)
第Ⅱ卷(非选择题
共54分)
二、(本题包括4小题,共39分)
24.(6分)从下列六种有机物中选择合适的答案,将其标号填在空格内。
A.苯 B.乙醇 C.乙酸
D.油脂 E.葡萄糖
F.蛋白质
(1)食醋可作为增加食品酸味的调味剂,是因为其中含有____________。
(2)属于天然有机高分子化合物的是__________。
(3)医疗消毒常用75%(体积分数)的溶液___________。
(4)花生油、茶籽油、牛油的主要成分是___________。
(5)家居装修材料会散发出甲醛、_________等挥发性的有害物质。
(6)在某病人的尿样中加人新制氢氧化铜悬浊液,加热后有红色沉淀生成,说明该尿样中含有__________。
25.(9分)
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436kJ·mol—1,N≡N键能为945kJ·mol—1,N﹣H键能为391kJ mol—1。写出合成氨反应的热化学方程式
。
(2)恒温下,往一个2L的密闭容器中充入2.6mol
H2和1mol
N2,
反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min
5
10
15
20
25
30
c(NH3)/mol·L—1
0.08
0.14
0.18
0.20
0.20
0.20
5
min内,消耗N2的平均反应速率为
,
此条件下该反应的化学平衡常数K=
;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向
__方向移动(填“正反应”或“逆反应”)。
26.(12分)乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料。
(1)已知常温常压下:
①
CH3CH2OH(l)+3O2(g)2CO2(g)+3H2O(g)
ΔH1= 1366.8
kJ·mol 1
②
2CO(g)+O2(g)2CO2(g)
ΔH2= 566
kJ·mol 1
③
H2O(g)H2O(l)
ΔH3= 44
kJ·mol 1
则CH3CH2OH(l)和O2生成CO和H2O(l)的热化学方程式为
。
(2)在容积为2L的密闭容器中,由CO和H2合成由乙醇的反应为
2CO(g)+
4H2(g)
CH3CH2OH(g)+
H2O(g),
在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
( http: / / www.21cnjy.com )
①
根据上图可推知T2_________T1(填“>”、“<”或“=”)。
②
该反应ΔH_________0(填“>”、“<”或“=”);升高温度,上述反应向_________(填“正”或“逆”)反应方向移动。
③该反应的平衡常数表达式为__________________________,降低温度平衡常数将
__________(填“变大”、“变小”或“不变”,下同),反应速率将____________。
27.(12分)已知:I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
物质
Cu(OH)2
Fe(OH)3
CuCl
CuI
Ksp
2.2×10-20
2.6×10-39
1.7×10-7
1.3×10-12
(1)某酸性CuCl2溶液中含有少量的Fe
( http: / / www.21cnjy.com )Cl3,为得到纯净的CuCl2 2H2O晶体,加入_______,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2 2H2O晶体。
(2)在空气中直接加热CuCl2 2H2O
( http: / / www.21cnjy.com )晶体得不到纯的无水CuCl2,由CuCl2 2H2O晶体得到纯的无水CuCl2的合理方法是_____________________________________________。
(3)某学习小组用“间接碘
( http: / / www.21cnjy.com )量法”测定含有CuCl2 2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取
0.36
g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000
mol/L
Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00
mL。
①可选用________________作滴定指示剂,滴定终点的现象是
________________________________________。
②CuCl2溶液与KI反应的离子方程式为______________________________________。
③该试样中CuCl2 2H2O的质量分数为
。
28.(15分)A、B、C、D四种芳香族化合物,它们的结构简式如下所示:
请填写下列空白:
(1)A的分子式为________________,C中官能团的名称是____________________。
(2)以上四种化合物中,互为同分异构体的是
(填字母符号)。
(3)可用于鉴别A、C的是__________(填序号)。
①酸性高锰酸钾溶液
②碳酸氢钠溶液
③氯化铁溶液
(4)D为原料合成某工程塑料的流程如下:
①
D→E的反应类型______________________;
②
F的结构简式_________________________;
③
G→H反应的化学方程式是
。
2016年春季期末考试卷高二化学评分标准
一、选择题(23小题,每题2分,共46分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
A
C
C
A
D
A
A
B
题号
11
12
13
14
15
16
17
18
19
20
答案
C
C
A
D
B
C
C
B
A
B
题号
21
22
23
答案
C
B
D
二、非选择题(共有5大题,共54分)
24.(6分)(1)C
(2)F
(3)B
(4)D
(5)A
(6)E
25.(9分)
(1)N2(g)
+
3H2(g)
2NH3
(g)
△H
=-93kJ mol-
(3分)
(2)0.008
mol·L—1·min—1
(2分)
0.1[或0.1(mol·L-1
)
-2]
(2分)
逆反应(2分)
26.(12分)(1)CH3CH2OH(l)+2O2(g)=2CO2(g)+3H2O(l)
△H=-932.8
kJ·mol 1
(2分)
(2)①>
(2分)
②<
(2分)
逆(2分)
③K=[c(CH3CH2OH)·c(H2O)]/[c2
(CO)·c4
(H2)](2分)
变大(1分)变小(1分)
27(12分)
(1)Cu(OH)2或CuO或CuCO3或Cu2(OH)2CO3
(1分);
2.6×10-9mol/L;(2分)
(2)在干燥的HCl气流中加热脱水;(2分)
(3)①淀粉溶液;(1分)
蓝色褪去,且半分钟内不恢复原色;(2分)
②2Cu2++4I―=2CuI↓+I2
(2分)
③95%。(2分)
28.(15分)
(1)C11H14O2
(2分)
酚羟基(或羟基)、碳碳双键
(2分)(写结构不得分)
(2)C、D
(2分)
(3)③
(2分)
(4)①取代反应
(2分)
②
(2分)
③(3分)(浓硫酸写催化剂也可)
Al2(SO4)3溶液
NaOH溶液
班级
座号
姓名
准考证号
流水号
16/7/5
密
封
线
内
不
得
答
题
高二化学
考试时间:90分钟
满分:100分
2016.7.5
☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆
温馨提示:信心、细心、
耐心!
☆
☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆☆
相对原子质量:
H:1
C:12
O:16
Na:23
Cl:35.5
Cu:64
第Ⅰ卷(选择题
共46分)
一、选择题(本题共23小题,每小题2分,共46分,每题只有一个正确选项)
1.某学生的实验报告所列出的下列数据中合理的是(
)
A.用10mL量筒量取7.13mL稀盐酸
B.用托盘天平称量25.20g
NaCl
C.用广泛pH试纸测得某溶液的pH为2.3
D.用25mL碱式滴定管做中和滴定实验时,测得用去的碱溶液21.70mL
2.25℃时,下列各物质的水溶液的pH小于7的是(
)
A.Na2CO3
B.Fe2(SO4)3
C.KOH
D.KHCO3
3.下列物质中,其主要成分不属于烃的是(
)
A.甘油
B.汽油
C.煤油
D.柴油
4.分子式为C4H8Cl2的有机物共有(不含立体异构)(
)
A.7种
B.8种
C.9种
D.10种
5.下列化学用语书写正确的是(
)
A.乙烯的结构简式:CH2CH2
B.丙烯的键线式:
C.甲烷的电子式:
D.乙醇的结构式:
6.下列各组物质中,一定互为同系物的是(
)
A.乙烷和己烷
B.CH3COOH、C3H6O2
C.和
D.HCHO、CH3COOH
7.下列反应中,属于取代反应的是(
)
①
CH3CH=CH2+Br2
CH3CHBrCH2Br
②
CH3CH2OH
CH2=CH2
↑
+
H2O
③
CH3COOH
+
CH3CH2OH
CH3COOCH2CH3
+
H2O
④
C6H6
+
HNO3
C6H5NO2
+
H2O
A.①②
B.②④
C.①③
D.③④
8.由2﹣氯丙烷制取少量的1,2﹣丙二醇时,
需要经过下列哪几步反应(
)
A.消去、加成、取代
B.加成、消去、取代
C.取代、消去、加成
D.消去、加成、消去
9.下列有关有机物的说法不正确的是(
)
A.酒精中是否含有水,可用金属钠检验
B.有机酸和醇脱水合成的某些酯,可用作糖果、化妆品中的香料
C.蛋白质在一定条件下能发生水解反应,生成氨基酸
D.乙烯通过聚合反应可合成聚乙烯,聚乙烯塑料可用来制造多种包装材料
10.
( http: / / www.21cnjy.com )的命名正确的是(
)
A.2-二甲基-3-乙基丁烷
B.2,3,3-三甲基戊烷
C.2,2-二甲基-3-乙基丁烷
D.3,4,4-三甲基戊烷
11.化学与生产、生活密切相关,下列说法不正确的是(
)
A.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B.氢氧化铝可作抗酸药
C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物
D.硅胶可用作食品干燥剂
12.下列离子方程式书写正确的是( )
A.Na2S溶液的水解:S2-+
2
H2OH2S
+
2
OH-
B.NaHCO3溶液里发生的电离:HCO3-+
H2O
H2
CO3
+
OH-
C.NH4Cl溶液的水解:NH4+
+
H2O
NH3·H2O
+
H+
D.把金属铁放入稀硫酸中:2Fe
+
6H+
=
2Fe3+
+
3H2↑
13.下列溶液一定呈中性的是(
)
A.c(H+)=c(OH一)=1×10一6
mol·L-1的溶液
B.等物质的量的强酸和强碱反应后所得到的混合溶液
C.将pH=5的盐酸稀释100倍所得到的溶液
D.非电解质溶于水得到的溶液
14.某有机物的结构如右图所示,这种有机物不可能具有的性质是(
)
①可以与氢气发生加成反应;
②能使酸性KMnO4溶液褪色;
③能跟NaOH溶液反应;
④能发生酯化反应;
⑤能发生加聚反应;
⑥能发生水解反应
A.①④
B.④⑥
C.只有⑤
D.只有⑥
15.设NA为阿伏加德罗常数的数值,下列说法中正确的是(
)
A.在密闭容器中加入l.5mol
H2和0.5molN2,充分反应后可得到NH3分子数为NA
B.8.8g乙酸乙酯中含共用电子对数为1.4
NA
C.1
L
0.1
mol·L-1氯化铜溶液中铜离子数为0.1
NA
D.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA
16.下列叙述不正确的是(
)
A.漂白粉长时间露置空气中会结块变质
B.金属钠在空气中燃烧产生黄色火焰,生成淡黄色固体
C.为防船体被腐蚀,远洋货轮船底外壳镶嵌锌块,其中锌发生还原反应
D.两根分别蘸有浓盐酸、浓氨水的玻璃棒靠近有白烟产生
17.全轨电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:
VO2+(蓝色)+H2O+V3+(紫色)VO2+(黄色)+V2+(绿色)+2H+
下列说法错误的(
)
A.放电过程中,正极附近溶液的酸性减弱
B.放电时,正极反应为VO2++2H++e-=VO2++H2O
C.充电时,反应每生成2mol
H+
时电子转移数为2mol
D.充电时,阳极附近溶液由蓝色逐渐变为黄色
18.下列过程或现象与盐类水解无关的是(
)
A.用热的纯碱溶液去油污
B.pH=3的醋酸溶液,加水稀释10倍后pH<4
C.实验室配置FeCl3溶液时,加入少量稀盐酸,以防止溶液浑浊
D.草木灰与铵态氮肥不能混合施用
19.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是(
)
A.弱酸溶液和强碱溶液反应
B.生成了一种强酸弱碱盐
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和二元强碱溶液反应
20.下列措施或事实不能用勒夏特列原理解释的是(
)
A.新制的氯水在光照下颜色变浅
B.H2、I2、HI平衡混合气,加压后颜色变深
C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
D.在合成氨的反应中,加压有利于氨的合成
21.下列化合物在核磁共振氢谱中能出现两组峰,且其峰面积之比为2:1的有(
)
A.乙酸甲酯
B.2-甲基丙烷
C.对苯二酚
D.正戊烷
22.下列实验装置设计正确、且能达到目的的是(
)
HYPERLINK
"http://www.21cnjy.com"
A.实验Ⅰ:制取金属钠
B.实验II:制取Fe(OH)2
C.实验Ⅲ:制取少量的氢氧化铝
D.实验Ⅳ:比较两种物质的热稳定性
23.25℃时,在20mL0.1mol/L盐酸溶液中逐滴加入0.2mol/L氨水,曲线如图所示,
下列说法正确的是(
)
A.此滴定实验可以选用酚酞做指示剂
B.在A点:c(Cl-)>
c(H+)>
c(NH4+)>
c(OH-)
C.在B点:c(H+)
=
c(OH-)
=
c(Cl-)
=
c(NH4+)
D.在C点:c(NH4+)+
c(NH3·H2O)
=
2c(Cl-)
惠南中学2016年春季期末考试卷
高二化学
2016.7.5
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
题号
21
22
23
答案
一、选择题答案卡(选择题共46分)
第Ⅱ卷(非选择题
共54分)
二、(本题包括4小题,共39分)
24.(6分)从下列六种有机物中选择合适的答案,将其标号填在空格内。
A.苯 B.乙醇 C.乙酸
D.油脂 E.葡萄糖
F.蛋白质
(1)食醋可作为增加食品酸味的调味剂,是因为其中含有____________。
(2)属于天然有机高分子化合物的是__________。
(3)医疗消毒常用75%(体积分数)的溶液___________。
(4)花生油、茶籽油、牛油的主要成分是___________。
(5)家居装修材料会散发出甲醛、_________等挥发性的有害物质。
(6)在某病人的尿样中加人新制氢氧化铜悬浊液,加热后有红色沉淀生成,说明该尿样中含有__________。
25.(9分)
氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436kJ·mol—1,N≡N键能为945kJ·mol—1,N﹣H键能为391kJ mol—1。写出合成氨反应的热化学方程式
。
(2)恒温下,往一个2L的密闭容器中充入2.6mol
H2和1mol
N2,
反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min
5
10
15
20
25
30
c(NH3)/mol·L—1
0.08
0.14
0.18
0.20
0.20
0.20
5
min内,消耗N2的平均反应速率为
,
此条件下该反应的化学平衡常数K=
;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向
__方向移动(填“正反应”或“逆反应”)。
26.(12分)乙醇可用来制取乙醛、乙醚、乙酸乙酯等化工原料,也是制取染料、涂料、洗涤剂等产品的原料。
(1)已知常温常压下:
①
CH3CH2OH(l)+3O2(g)2CO2(g)+3H2O(g)
ΔH1= 1366.8
kJ·mol 1
②
2CO(g)+O2(g)2CO2(g)
ΔH2= 566
kJ·mol 1
③
H2O(g)H2O(l)
ΔH3= 44
kJ·mol 1
则CH3CH2OH(l)和O2生成CO和H2O(l)的热化学方程式为
。
(2)在容积为2L的密闭容器中,由CO和H2合成由乙醇的反应为
2CO(g)+
4H2(g)
CH3CH2OH(g)+
H2O(g),
在其他条件不变的情况下,CO的转化率随温度的变化如图所示(注:T1、T2均大于280℃):
( http: / / www.21cnjy.com )
①
根据上图可推知T2_________T1(填“>”、“<”或“=”)。
②
该反应ΔH_________0(填“>”、“<”或“=”);升高温度,上述反应向_________(填“正”或“逆”)反应方向移动。
③该反应的平衡常数表达式为__________________________,降低温度平衡常数将
__________(填“变大”、“变小”或“不变”,下同),反应速率将____________。
27.(12分)已知:I2+2S2O32-=S4O62-+2I-。相关物质的溶度积常数见下表:
物质
Cu(OH)2
Fe(OH)3
CuCl
CuI
Ksp
2.2×10-20
2.6×10-39
1.7×10-7
1.3×10-12
(1)某酸性CuCl2溶液中含有少量的Fe
( http: / / www.21cnjy.com )Cl3,为得到纯净的CuCl2 2H2O晶体,加入_______,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=_________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2 2H2O晶体。
(2)在空气中直接加热CuCl2 2H2O
( http: / / www.21cnjy.com )晶体得不到纯的无水CuCl2,由CuCl2 2H2O晶体得到纯的无水CuCl2的合理方法是_____________________________________________。
(3)某学习小组用“间接碘
( http: / / www.21cnjy.com )量法”测定含有CuCl2 2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取
0.36
g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000
mol/L
Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00
mL。
①可选用________________作滴定指示剂,滴定终点的现象是
________________________________________。
②CuCl2溶液与KI反应的离子方程式为______________________________________。
③该试样中CuCl2 2H2O的质量分数为
。
28.(15分)A、B、C、D四种芳香族化合物,它们的结构简式如下所示:
请填写下列空白:
(1)A的分子式为________________,C中官能团的名称是____________________。
(2)以上四种化合物中,互为同分异构体的是
(填字母符号)。
(3)可用于鉴别A、C的是__________(填序号)。
①酸性高锰酸钾溶液
②碳酸氢钠溶液
③氯化铁溶液
(4)D为原料合成某工程塑料的流程如下:
①
D→E的反应类型______________________;
②
F的结构简式_________________________;
③
G→H反应的化学方程式是
。
2016年春季期末考试卷高二化学评分标准
一、选择题(23小题,每题2分,共46分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
A
C
C
A
D
A
A
B
题号
11
12
13
14
15
16
17
18
19
20
答案
C
C
A
D
B
C
C
B
A
B
题号
21
22
23
答案
C
B
D
二、非选择题(共有5大题,共54分)
24.(6分)(1)C
(2)F
(3)B
(4)D
(5)A
(6)E
25.(9分)
(1)N2(g)
+
3H2(g)
2NH3
(g)
△H
=-93kJ mol-
(3分)
(2)0.008
mol·L—1·min—1
(2分)
0.1[或0.1(mol·L-1
)
-2]
(2分)
逆反应(2分)
26.(12分)(1)CH3CH2OH(l)+2O2(g)=2CO2(g)+3H2O(l)
△H=-932.8
kJ·mol 1
(2分)
(2)①>
(2分)
②<
(2分)
逆(2分)
③K=[c(CH3CH2OH)·c(H2O)]/[c2
(CO)·c4
(H2)](2分)
变大(1分)变小(1分)
27(12分)
(1)Cu(OH)2或CuO或CuCO3或Cu2(OH)2CO3
(1分);
2.6×10-9mol/L;(2分)
(2)在干燥的HCl气流中加热脱水;(2分)
(3)①淀粉溶液;(1分)
蓝色褪去,且半分钟内不恢复原色;(2分)
②2Cu2++4I―=2CuI↓+I2
(2分)
③95%。(2分)
28.(15分)
(1)C11H14O2
(2分)
酚羟基(或羟基)、碳碳双键
(2分)(写结构不得分)
(2)C、D
(2分)
(3)③
(2分)
(4)①取代反应
(2分)
②
(2分)
③(3分)(浓硫酸写催化剂也可)
Al2(SO4)3溶液
NaOH溶液
班级
座号
姓名
准考证号
流水号
16/7/5
密
封
线
内
不
得
答
题
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
