第1章物质及其变化(第1-4节)复习
图片预览






文档简介
课件18张PPT。几种物质类别复习目标:(自己整理15分钟) 1.酸碱盐的定义,及常见化学式举例
2.几种物质的检验方法:CO2、H2O、蛋白质
、SO42-、Cl-、NH4+
3.盐酸、硫酸、氢氧化钠的性质
4.整理酸、碱的通性
复习目标:(自己整理15分钟) 1.酸碱盐的定义
2.几种物质的检验方法:CO2、H2O、蛋白质、SO42-、Cl-、NH4+、CO32-
3.盐酸、硫酸、氢氧化钠、氢氧化钙的性质
4.整理酸、碱的通性
5.碳酸盐的特点 6.铵态氮肥的施用主意事项、酸性土壤的改良
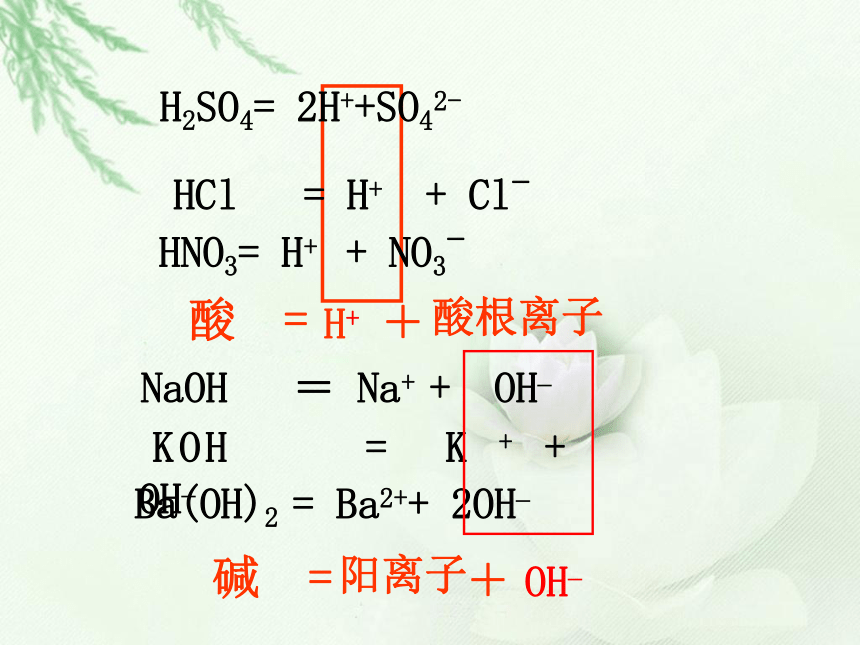
H+酸根离子H2SO4= 2H++SO42-HCl = H+ + Cl-HNO3= H+ + NO3-阳离子OH–阳离子酸根离子几种重要物质的俗称1、NaOH
2、Ca(OH)2
3、CaO
4、CaCO3
5、Na2CO3烧碱 苛性钠 火碱熟石灰(消石灰)生石灰石灰石纯碱 苏打几种物质的检验1、CO2
2、H2O
3、蛋白质
4、SO42-
5、Cl-
6、NH4+几种反应的基本类型化合反应分解反应 NaOH+H Cl=NaCl+H2O
2NaOH+H2SO4=Na2SO4 +2H2O中和反应Na2CO3+CaCl2=CaCO3↓+2NaClHCl+AgNO3= AgCl↓+HNO3复分解反应几种物质的性质浓盐酸具有挥发性刺激性气味盐酸(HCl)酸雾(白雾)浓H2SO4具有吸水性浓硫酸能干燥:H2、O2、CO2 等气体,经常用做干燥剂。硫酸(H2SO4)浓H2SO4具有脱水性浓H2SO4具有很强的腐蚀性氢氧化钠(NaOH)1、易潮解(干燥剂)干燥范围:碱性气体 (NH3)
中性气体 (H2、O2、N2等)注意;不能干燥酸性气体
(HCl、CO2、SO2、H2S等)2、易变质( CO2 )1、 HCl+NaOH=NaCl+H2O
2、 3HCl+Al(OH)3=AlCl3+3H2O
3、 2HCl+CaCO3=CaCl2+H2O+CO2↑
4、 6HCl+Fe2O3=2FeCl3+3H2O
5、 2HCI + Fe = FeCI2 + H2↑一、盐酸能与碱反应生成盐和水。二、盐酸能与某些盐反应生成新盐和新酸。三、盐酸能与某些金属氧化物反应生成盐和水。四、盐酸能使指示剂变色。五、盐酸能和某些金属反应生成盐和氢气。根据化学反应式总结盐酸性质碱的共性1、碱能使酸碱指示剂变色。2、碱+酸=盐+水。NaOH + HCl = NaCl + H2O 2NaOH+H2SO4 = Na2SO4 + 2H2O3、碱+非金属氧化物=盐+水。4、碱 +盐 = 新碱 + 新盐2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl 3NaOH + FeCl3 = Fe(OH)3↓ + 3NaClA3、下列变化中,与其它三种有本质区别的一种变化是 ( )
A、 鸡蛋变臭 B 、分离空气制取氧气
C 、碘加热升华 D 、西瓜榨成西瓜汁A1、有关浓硫酸的说法不正确是 ( )
A、浓硫酸是无色粘稠的油状液体
B、浓硫酸溶于水放出大量的热
C、浓硫酸不慎滴在皮肤上立即用大量的水冲洗
D、稀释浓硫酸时把浓硫酸沿容器壁慢慢注入盛有水的烧杯里,并用玻璃棒不断搅拌
2、区分稀盐酸和稀硫酸,应选用的药品是( )
A、BaCl2溶液 B、NaCl溶液
C、稀HNO3 D、硝酸银溶液
C我会做15、下列四种物质中,能和其他三种物质反应的是( )。
A、盐酸 B、二氧化碳
C、硫酸铜 D、氢氧化钠DA我会做22、下列物质能由金属和盐酸反应制取的是( )
A、FeCl3 B、ZnCl2 C、CuCl2 D、AgCl3、下列各组反应类型中,后者一定包含前者的( )
A、分解反应,复分解反应
B、中和反应,复分解反应
C、置换反应、复分解反应
D、中和反应、化合反应BB1、下列四种物质中,能和其他三种物质反应的是( )。
A、稀硫酸 B、锌 C、铁锈 D、氢氧化铜 他在家里想鉴别碱面(主要成分是碳酸钠)和食盐。
你认为他用下列方法可行吗?
1、观察它们的颜色
2、分别闻它们的气味
3、分别倒入水中观察是否溶解
4、取少量分别倒入食醋
除此之外,如果在实验室里,你能有其它的方法吗?
不行不行不行行Na2CO3+2HCl= 2Na Cl +H2O+ CO2↑Na2CO3+ = CaCO3 ↓ +2NaClNa2CO3 =CaCO3↓+2NaOHCa(OH)2+CaCl2
2.几种物质的检验方法:CO2、H2O、蛋白质
、SO42-、Cl-、NH4+
3.盐酸、硫酸、氢氧化钠的性质
4.整理酸、碱的通性
复习目标:(自己整理15分钟) 1.酸碱盐的定义
2.几种物质的检验方法:CO2、H2O、蛋白质、SO42-、Cl-、NH4+、CO32-
3.盐酸、硫酸、氢氧化钠、氢氧化钙的性质
4.整理酸、碱的通性
5.碳酸盐的特点 6.铵态氮肥的施用主意事项、酸性土壤的改良
H+酸根离子H2SO4= 2H++SO42-HCl = H+ + Cl-HNO3= H+ + NO3-阳离子OH–阳离子酸根离子几种重要物质的俗称1、NaOH
2、Ca(OH)2
3、CaO
4、CaCO3
5、Na2CO3烧碱 苛性钠 火碱熟石灰(消石灰)生石灰石灰石纯碱 苏打几种物质的检验1、CO2
2、H2O
3、蛋白质
4、SO42-
5、Cl-
6、NH4+几种反应的基本类型化合反应分解反应 NaOH+H Cl=NaCl+H2O
2NaOH+H2SO4=Na2SO4 +2H2O中和反应Na2CO3+CaCl2=CaCO3↓+2NaClHCl+AgNO3= AgCl↓+HNO3复分解反应几种物质的性质浓盐酸具有挥发性刺激性气味盐酸(HCl)酸雾(白雾)浓H2SO4具有吸水性浓硫酸能干燥:H2、O2、CO2 等气体,经常用做干燥剂。硫酸(H2SO4)浓H2SO4具有脱水性浓H2SO4具有很强的腐蚀性氢氧化钠(NaOH)1、易潮解(干燥剂)干燥范围:碱性气体 (NH3)
中性气体 (H2、O2、N2等)注意;不能干燥酸性气体
(HCl、CO2、SO2、H2S等)2、易变质( CO2 )1、 HCl+NaOH=NaCl+H2O
2、 3HCl+Al(OH)3=AlCl3+3H2O
3、 2HCl+CaCO3=CaCl2+H2O+CO2↑
4、 6HCl+Fe2O3=2FeCl3+3H2O
5、 2HCI + Fe = FeCI2 + H2↑一、盐酸能与碱反应生成盐和水。二、盐酸能与某些盐反应生成新盐和新酸。三、盐酸能与某些金属氧化物反应生成盐和水。四、盐酸能使指示剂变色。五、盐酸能和某些金属反应生成盐和氢气。根据化学反应式总结盐酸性质碱的共性1、碱能使酸碱指示剂变色。2、碱+酸=盐+水。NaOH + HCl = NaCl + H2O 2NaOH+H2SO4 = Na2SO4 + 2H2O3、碱+非金属氧化物=盐+水。4、碱 +盐 = 新碱 + 新盐2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl 3NaOH + FeCl3 = Fe(OH)3↓ + 3NaClA3、下列变化中,与其它三种有本质区别的一种变化是 ( )
A、 鸡蛋变臭 B 、分离空气制取氧气
C 、碘加热升华 D 、西瓜榨成西瓜汁A1、有关浓硫酸的说法不正确是 ( )
A、浓硫酸是无色粘稠的油状液体
B、浓硫酸溶于水放出大量的热
C、浓硫酸不慎滴在皮肤上立即用大量的水冲洗
D、稀释浓硫酸时把浓硫酸沿容器壁慢慢注入盛有水的烧杯里,并用玻璃棒不断搅拌
2、区分稀盐酸和稀硫酸,应选用的药品是( )
A、BaCl2溶液 B、NaCl溶液
C、稀HNO3 D、硝酸银溶液
C我会做15、下列四种物质中,能和其他三种物质反应的是( )。
A、盐酸 B、二氧化碳
C、硫酸铜 D、氢氧化钠DA我会做22、下列物质能由金属和盐酸反应制取的是( )
A、FeCl3 B、ZnCl2 C、CuCl2 D、AgCl3、下列各组反应类型中,后者一定包含前者的( )
A、分解反应,复分解反应
B、中和反应,复分解反应
C、置换反应、复分解反应
D、中和反应、化合反应BB1、下列四种物质中,能和其他三种物质反应的是( )。
A、稀硫酸 B、锌 C、铁锈 D、氢氧化铜 他在家里想鉴别碱面(主要成分是碳酸钠)和食盐。
你认为他用下列方法可行吗?
1、观察它们的颜色
2、分别闻它们的气味
3、分别倒入水中观察是否溶解
4、取少量分别倒入食醋
除此之外,如果在实验室里,你能有其它的方法吗?
不行不行不行行Na2CO3+2HCl= 2Na Cl +H2O+ CO2↑Na2CO3+ = CaCO3 ↓ +2NaClNa2CO3 =CaCO3↓+2NaOHCa(OH)2+CaCl2
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
