1.5酸和碱之间发生的反应
图片预览





文档简介
(共14张PPT)
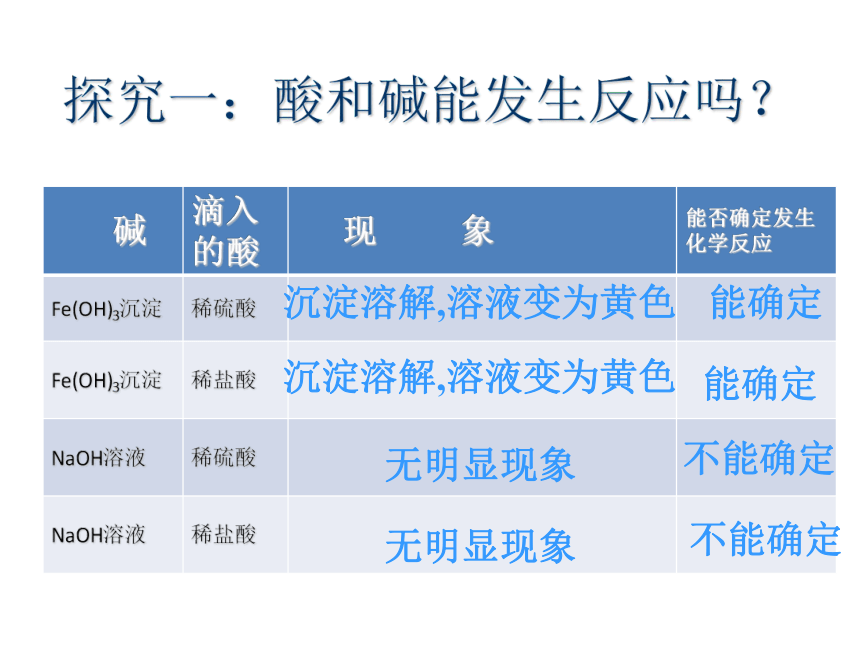
探究一:酸和碱能发生反应吗?
碱 滴入的酸 现 象 能否确定发生化学反应
Fe(OH)3沉淀 稀硫酸
Fe(OH)3沉淀 稀盐酸
NaOH溶液 稀硫酸
NaOH溶液 稀盐酸
沉淀溶解,溶液变为黄色
能确定
沉淀溶解,溶液变为黄色
能确定
无明显现象
不能确定
无明显现象
不能确定
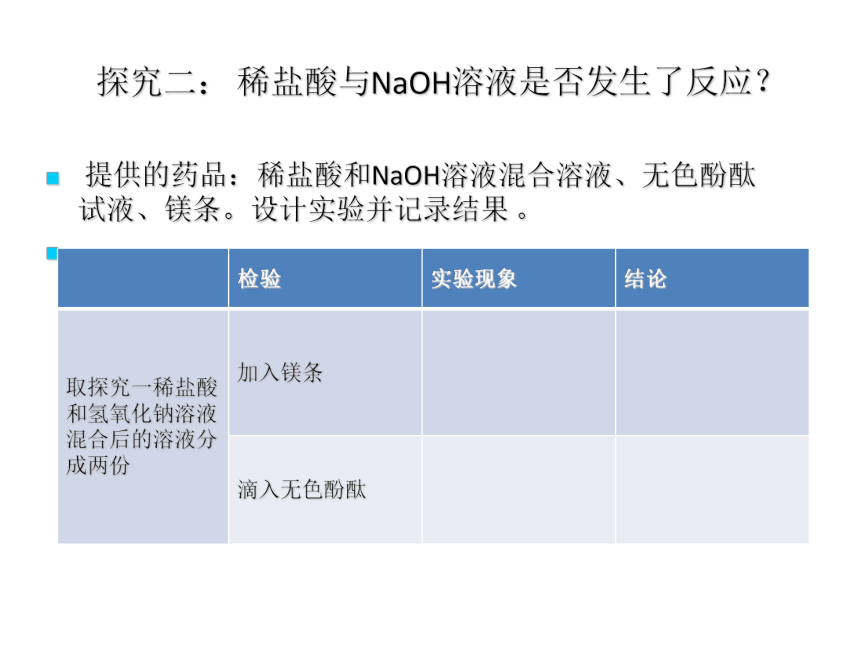
探究二: 稀盐酸与NaOH溶液是否发生了反应?
若溶液中既有酸又有碱?各自用什么物质去检验呢?且要有明显现象?
探究二: 稀盐酸与NaOH溶液是否发生了反应?
提供的药品:稀盐酸和NaOH溶液混合溶液、无色酚酞试液、镁条。设计实验并记录结果 。
检验 实验现象 结论
取探究一稀盐酸和氢氧化钠溶液混合后的溶液分成两份 加入镁条
滴入无色酚酞
可能出现的三种现象
1、有气泡,不变红。
1、有气泡,不变红
2、无气泡,变红
3、无气泡,不变红
有酸 无碱 PH<7
→
→
→
有碱 无酸 PH>7
无酸又无碱 PH=7
这些结论都证明了酸碱不能共存,则一定生成了新物质。
探究三:稀盐酸和氢氧化钠恰好完全反应的产物是什么?
须解决的问题
用什么办法能够知道在稀盐酸和氢氧化钠溶液反应的过程中, 酸碱没有剩余,恰好完全反应?
实验方案:
在1支试管中分别加3毫升左右氢氧化钠溶液,各滴1滴酚酞试液,再分别向两支试管中逐滴加入稀盐酸,边滴边振荡,直到红色刚好褪去。
用滴管吸取3-4滴反应后的溶液滴在蒸发皿中,在酒精灯上蒸发结晶,观察现象。
思考:
酚酞试液在探究二和探究三中的作用有什么区别?
此时溶液的PH值为多少?
根据质量守恒定律,推理蒸发皿上的白色固体粉末的成分。
探究四:酸和碱为什么会发生反应,他们究竟发生了怎样的反应?
酸碱反应的实质:
H++OH -=H2O
请同学们写出探究一中的化学方程式
形成知识
一、酸碱反应
定义:酸 + 碱 = 盐 + 水
实质:H+ + OH- = H2O
结合刚才所学到的知识,你能说出为什么用浓硫酸要用熟石灰反应吗?
H2SO4 + Ca(OH)2 ==CaSO4 + 2H2O
化学方程式:
二:酸碱反应的应用
用于医药
处理工业废水
改良土壤的酸碱性
调整溶液的酸碱性
1.改良土壤的酸碱性
加入酸 性物质
中性土壤
中性土壤
酸性土壤
熟石灰
Ca(OH)2
用于医药
⑴ 中和胃酸过多
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
⑵ 中和蚁酸
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
探究一:酸和碱能发生反应吗?
碱 滴入的酸 现 象 能否确定发生化学反应
Fe(OH)3沉淀 稀硫酸
Fe(OH)3沉淀 稀盐酸
NaOH溶液 稀硫酸
NaOH溶液 稀盐酸
沉淀溶解,溶液变为黄色
能确定
沉淀溶解,溶液变为黄色
能确定
无明显现象
不能确定
无明显现象
不能确定
探究二: 稀盐酸与NaOH溶液是否发生了反应?
若溶液中既有酸又有碱?各自用什么物质去检验呢?且要有明显现象?
探究二: 稀盐酸与NaOH溶液是否发生了反应?
提供的药品:稀盐酸和NaOH溶液混合溶液、无色酚酞试液、镁条。设计实验并记录结果 。
检验 实验现象 结论
取探究一稀盐酸和氢氧化钠溶液混合后的溶液分成两份 加入镁条
滴入无色酚酞
可能出现的三种现象
1、有气泡,不变红。
1、有气泡,不变红
2、无气泡,变红
3、无气泡,不变红
有酸 无碱 PH<7
→
→
→
有碱 无酸 PH>7
无酸又无碱 PH=7
这些结论都证明了酸碱不能共存,则一定生成了新物质。
探究三:稀盐酸和氢氧化钠恰好完全反应的产物是什么?
须解决的问题
用什么办法能够知道在稀盐酸和氢氧化钠溶液反应的过程中, 酸碱没有剩余,恰好完全反应?
实验方案:
在1支试管中分别加3毫升左右氢氧化钠溶液,各滴1滴酚酞试液,再分别向两支试管中逐滴加入稀盐酸,边滴边振荡,直到红色刚好褪去。
用滴管吸取3-4滴反应后的溶液滴在蒸发皿中,在酒精灯上蒸发结晶,观察现象。
思考:
酚酞试液在探究二和探究三中的作用有什么区别?
此时溶液的PH值为多少?
根据质量守恒定律,推理蒸发皿上的白色固体粉末的成分。
探究四:酸和碱为什么会发生反应,他们究竟发生了怎样的反应?
酸碱反应的实质:
H++OH -=H2O
请同学们写出探究一中的化学方程式
形成知识
一、酸碱反应
定义:酸 + 碱 = 盐 + 水
实质:H+ + OH- = H2O
结合刚才所学到的知识,你能说出为什么用浓硫酸要用熟石灰反应吗?
H2SO4 + Ca(OH)2 ==CaSO4 + 2H2O
化学方程式:
二:酸碱反应的应用
用于医药
处理工业废水
改良土壤的酸碱性
调整溶液的酸碱性
1.改良土壤的酸碱性
加入酸 性物质
中性土壤
中性土壤
酸性土壤
熟石灰
Ca(OH)2
用于医药
⑴ 中和胃酸过多
用含有氢氧化铝的胃药中和胃酸中过多的盐酸。
化学方程式:
Al(OH)3 + 3HCl=AlCl3 + 3H2O
⑵ 中和蚁酸
思考:可不可以用NaOH来中和胃酸、蚁酸?为什么?
可涂抹一些含有碱性物质(如氨水NH3·H2O)的药水。
答:不可以。因为NaOH的碱性太强,具有强的腐蚀性。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
